





高中化学人教版 (2019)必修 第一册第三节 物质的量背景图课件ppt
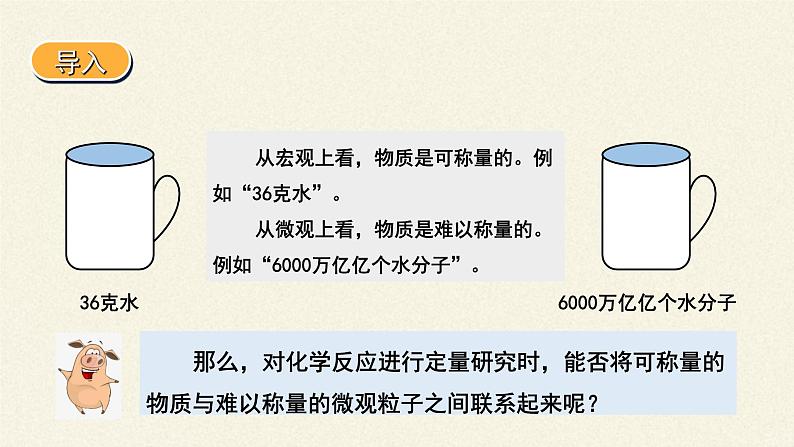
展开杯子里有6000万亿亿个水分子
从宏观上看,物质是可称量的。例如“36克水”。 从微观上看,物质是难以称量的。例如“6000万亿亿个水分子”。
6000万亿亿个水分子
在日常生活、生产和科学研究中,人们常常根据不同的需要使用不同的计量单位。
概念:表示含有一定数目粒子的集合体,通常用字母“n”表示。单位:摩尔,简称:摩,符号:ml
用摩尔作为计量原子、离子或分子等微观粒子的“物质的量”的单位。那么1ml可以代表多少粒子呢?
国际规定,1ml粒子集合体所含的粒子数约为6.02×1023。
概念:1ml任何粒子的粒子数,符号NA。通常用6.02×1023 ml-1表示。
国际单位制(SI)的7个基本单位
物质的量的单位——“ml”,可以计量哪些物质?
作为物质的量的单位,ml可以计量所有微观粒子(包括原子、分子、离子、原子团、电子、质子、中子等),如1mlFe、1mlO2、1mlNa+、1mlSO42-等。
1mlSO42-和1mlH+,哪一个含的粒子更多?
1ml不同物质中所含粒子数是相同的,都是6.02×1023 个粒子。1ml任何粒子集合体都约含有6.02×1023个粒子。
1mlH2O和1mlAl相比,它们的质量相同吗?
1ml不同物质中所含粒子数是相同的,由于不同粒子的质量不同,1ml不同物质的质量也不同。1mlH2O所含水分子数和1mlAl所含的铝原子数都约是6.02×1023,但它们的质量不同。
概念:单位物质的量的物质所具有的质量,通常用字母“M”表示。单位:g/ml
M(H2O)=2×1+1×16 =18g/ml
M(Na2CO3)=2×23+1×112+3×16=106g/ml
1、在0.5mlNa2SO4中含有Na+的数目约为( )个。A.3.01×1023B.6.02×1023C.0.5D.1
解析:0.5mlNa2SO4中钠离子的物质的量为0.5ml×2=1ml,由N=n×NA可知,钠离子的个数为1ml×NAml-1=NA≈6.02×1023,因此选B。
2.下列叙述中错误的是( ) A.1ml任何物质都含有约6.02×1023个原子B.0.012kg12C含有约6.02×1023个碳原子C.在使用摩尔表示物质的量的单位时,应该用化学式指明粒子的种类D.物质的量是国际单位制中七个基本物理量之一
解析:物质并不都是由原子构成的,有的是离子构成的,有的是分子构成的,A错误;0.012kg12C的物质的量为1ml,约含有6.02×1023个碳原子,B正确;在使用摩尔表示物质的量的单位时,应该用化学式指明粒子的种类,C正确;国际单位制中七个基本物理量包含长度、质量、时间、电流、热力学温度、物质的量、发光强度,D正确。因此选A。
3.假设1gN2含a个分子,则阿伏加德罗常数可以表示为( )A.a/28 ml-1 B.a ml-1 C.28a ml-1 D.a/14 ml-1
解析:根据公式n=m/M,可以计算出1g氮气的物质的量是1/28ml,则根据公式n=N/NA,可知,阿伏加德罗常数可以表示成n/N,即表示为28a ml-1,因此选C。
4.含有3.01×1023个氧原子的H2SO4的物质的量是( )A.0.5ml B.0.25mlC.1ml D.0.125ml
解析:3.01×1023 个氧原子的物质的量为0.5ml,1mlH2SO4含有4mlO,所以0.125mlH2SO4含有0.5mlO。因此选D。
概念:表示含有一定数目粒子的集合体,通常用字母“n”表示。单位:摩尔,简称:摩,符号:ml
上节课我们学习了计量微观粒子的新的物理量——物质的量。讨论了如何用物质的量表示一定质量的分子、原子或离子。
在科学研究或实际生产中,涉及气态物质时,测量体积往往比称量质量更方便。因此在研究气体物质时,通常是测量气体的体积,而不是气体的质量。
气体体积和物质的量之间有没有关系呢?
在一定条件下,1ml不同物质的体积如下图所示。
为什么他们的体积会有这些相同和不同之处呢?
提示:物质体积的大小构成因素
物质体积的大小取决于构成这种物质的① 物质的粒子数目② 粒子的大小③ 粒子之间的距离
同温同压下,任何气体粒子之间的距离相等
单位物质的量的气体所占的体积称为气体摩尔体积。
①根据气体摩尔体积的计算公式,你能发现什么?
③气体摩尔体积是否仅适用于纯气体?
标准状况下的气体摩尔体积
①忽视外界条件是标准状况,如常温常压下,1ml某气体的体积不是22.4L;②忽视研究对象是气体,如标准状况下的水、酒精、亚硫酸等不是气体;③将1ml气体的体积与气体摩尔体积的单位混淆,前者单位为L,后者单位为L/ml。
1、填写下列横线 气体摩尔体积是______________________________,符号是___,常用单位为_______。标准状况下,气体摩尔体积约为__________。
解析:气体摩尔体积是单位物质的量的气体所占的体积,符号是Vm ,常用单位为L/ml。标准状况下,气体摩尔体积约为22.4L/ml。
单位物质的量的气体所占的体积
2.同温同压下,若两种气体所占体积不同,其主要原因是( ) A.气体分子的大小不同B.气体分子间平均距离不同C.气体的物质的量不同D.气体的性质不同
解析:物质体积的影响因素为① 物质的粒子数目;② 粒子的大小;③ 粒子之间的距离。选项A中,相同条件下,气体的分子之间的距离相等,且远大于气体分子本身的体积大小,气体分子的大小可以忽略不计,故A错误;选项B中,相同条件下,气体的分子之间的距离相等,故B错误;选项C中,相同条件下,气体的分子之间的距离相等,且远大于气体分子本身的体积大小,影响气体体积的主要因素是气体物质的量的多少,故C正确;选项D中,影响气体体积的因素有分子大小、数目多少以及分子之间的距离,与分子的性质无关,故D错误。因此选C。
3.下列叙述正确的是( )A. 1ml任何气体的体积都为22.4LB. 1ml任何物质在标准状况下所占的体积都为22.4LC.标准状况下,1ml水所占的体积是22.4LD.标准状况下,22.4L任何气体的物质的量都是1ml
解析:选项A中,没有指明该物质所处的状况,包括温度、压强等信息,故A错误;选项B中,没有指明该物质存在的状态,故B错误;选项C中,水在标准状况下不上气体,故C错误;选项D中,是对气体摩尔体积概念的应用,故D正确。选择D选项。
4.设a代表阿伏伽德罗常数,下列说法正确的是( )A.在常温常压下,11.2LCl2含有的分子数为0.5aB.在常温常压下,1ml氦气含有的原子数为aC.32g氧气含原子数为aD.a个O2的质量只有在标准状况下才是32g
解析:选项A中,在标准状况下,11.2LCl2含有的分子数为0.5a,而选项为常温常压下,故A错误;选项B中,氦气为单原子分子,1ml氦气含有原子数目为a,故B正确;选项C中,氧气的摩尔质量为32g·ml-1,且氧气为双原子分子,所以32g氧气含原子数为32g÷32g·ml-1×2a=2a,故C错误;D选项中,a个O2的质量是32g,与状态无关,与外界条件无关,故D错误。因此选B。
物质体积大小的影响因素
① 物质的粒子数目② 粒子的大小③ 粒子之间的距离
概念:单位物质的量的气体所占的体积称为气体摩尔体积
常用单位:L/ml(或 L·ml-1)、m3/ml(或 m3·ml-1)
同温同压下数目相同任何气体的体积相同
实验中总会接触到各种形态的化学物质。它们有的是固态的,有的是气态的,有的是液态的。
在实验中,根据需求不同,我们会选用不同浓度的溶液。例如:用浓硫酸充当吸水剂,用稀硫酸做反应物。
通常用溶液中溶质的质量分数来表示溶液的浓度,它以溶质的质量与溶液的质量之比来表示溶液中溶质与溶液的质量关系。
取用溶液时,更多的是量取溶液的体积。如果知道一定体积的溶液中溶质的物质的量,对于计算化学反应中各物质之间的量的关系是非常便利的,对生产和科学研究也有重要意义。
物质的量浓度表示单位体积的溶液里所含溶质B的物质的量,也称为B的物质的量浓度符号:CB单位:ml/L(或ml·L-1)
①计算公式中各个字母的含义是什么?
V是指溶液的体积,单位为L;n是指溶质的物质的量,单位为ml;c是指溶质的物质的量浓度,单位为ml/L。
②计算公式有哪些适用范围?
适用于溶液中的溶质和密闭容器中的气体。从一定物质的量浓度的溶液中取出任意体积的溶液,物质的量浓度不变。但随体积变化,其中溶质的物质的量发生变化。
③由溶液B的物质的量计算公式,可以求解哪些问题?
体检的一些指标常用物质的量浓度表示
配制500mL0.1ml/L的NaOH溶液,需要NaOH的质量是多少?
提示:可以先通过物质的量浓度的定义,根据nB = cB·V,求得NaOH的物质的量。然后通过质量与物质的量的关系,根据m = n·M,求得NaOH的质量。
解:500mL0.1ml/LNaOH溶液中的NaOH的物质的量为:n(NaOH) = c(NaOH)· B[NaOH(aq)]=0.1ml/L×0.5L=0.05ml
第一步:求NaOH的物质的量
0.05mlNaOH的质量为:m(NaOH) = n(NaOH) · M(NaOH) =0.05ml×40g/ml=2g答:需要NaOH的质量是2g。
第二步:求NaOH的质量
单位体积的溶液里所含溶质B的物质的量
2.下列溶液中,跟200mL0.5ml/L的Na2SO4溶液所含的Na+物质的量浓度相同的是( )A.200mL0.25ml/LNaCl溶液B.200mL1ml/LNaCl溶液C.100mL 0.5ml/LNaOH溶液D.100mL1ml/LNa2CO3溶液
解析:0.5ml/L的Na2SO4溶液所含的Na+物质的量浓度为1ml/L。选项A中,200mL0.25ml/LNaCl溶液中钠离子的物质的量浓度是0.25 ml/L,A错误;选项B中,200mL1ml/LNaCl溶液中钠离子的物质的量浓度是1ml/L,B正确;选项C中,100mL0.5ml/LNaOH溶液中钠离子的物质的量浓度是0.5 ml/L,C错误;选项D中,100mL1ml/LNa2CO3溶液溶液中钠离子的物质的量浓度是2ml/L,D错误。故应选B。
3.从1L物质的量浓度为1ml·L-1的氢氧化钠溶液中取出100mL,下面关于这100mL溶液的叙述中错误的是( )A.物质的量浓度为0.1ml•L-1B.物质的量浓度为1ml•L-1C.含氢氧化钠4gD.含氢氧化钠0.1ml
解析:从一定物质的量浓度的溶液中无论取出溶液多少,其溶质的物质的量浓度、溶质的质量分数、离子浓度都不变,因为溶液属于均匀混合物,但其中所含溶质的量却要发生变化。100mL氢氧化钠溶液中NaOH的物质的量为0.1ml,其质量为4g,物质的量浓度为1ml·L-1。所以只有选项A错误。故应选A。
4.下列各溶液中氯离子(Cl-)的物质的量浓度最大的是( )A.200mL,0.5ml•L-1的FeCl3溶液B.100mL,0.5ml•L-1的MgCl2溶液C.150mL,1ml•L-1的NaCl溶液D.50mL,0.5ml•L-1的CuCl2溶液
解析:选项A中,200ml 0.5ml/L的FeCl3溶液中Cl-离子的物质的量浓度为0.5ml/L×3=1.5ml/L;选项B中,100mL 0.5ml/L的MgCl2溶液中Cl-离子的物质的量浓度为0.5ml/L×2=1ml/L;选项C中,150mL1ml/L的NaCl溶液中Cl-离子的物质的量浓度为1ml/L×1=1ml/L;选项D中,50m L0.5ml/LCuCl2溶液中Cl-离子的物质的量浓度为0.5ml/L×2=1ml/L。因此,A中Cl-离子的物质的量浓度最大,故应选A。
概念:单位体积的溶液里所含溶质B的物质的量,也称B的物质的量浓度
常用单位:ml/L(或 ml·L-1)
物质的量浓度的相关计算
已知溶液的体积和物质的量浓度,求解溶质的质量
化学必修 第一册第三节 物质的量教课内容课件ppt: 这是一份化学必修 第一册第三节 物质的量教课内容课件ppt,共26页。PPT课件主要包含了物质的量,交流与讨论,感受阿伏加德罗常数,mol的质量,归纳总结等内容,欢迎下载使用。
化学必修 第一册第二章 海水中的重要元素——钠和氯第三节 物质的量教案配套ppt课件: 这是一份化学必修 第一册第二章 海水中的重要元素——钠和氯第三节 物质的量教案配套ppt课件,共24页。PPT课件主要包含了物质的量浓度,容量瓶简介等内容,欢迎下载使用。
化学必修 第一册第三节 物质的量课文课件ppt: 这是一份化学必修 第一册第三节 物质的量课文课件ppt,共16页。PPT课件主要包含了一物质的量及其单位,mol,练一练,摩尔质量,nNa2CO3,mNa2CO3,MNa2CO3,g·mol-1,025mol等内容,欢迎下载使用。













