

化学选修4 化学反应原理第三节 盐类的水解教学设计
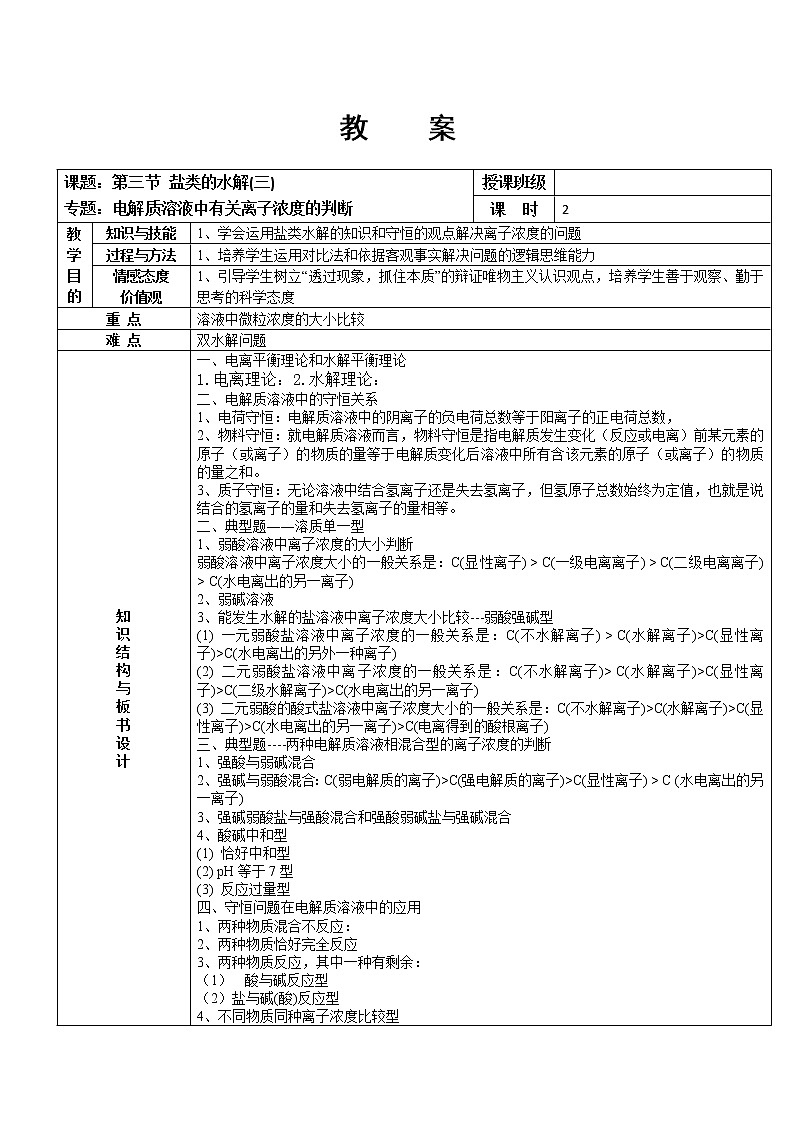
展开课题:第三节 盐类的水解(三)
专题:电解质溶液中有关离子浓度的判断
授课班级
课 时
2
教
学
目
的
知识与技能
1、学会运用盐类水解的知识和守恒的观点解决离子浓度的问题
过程与方法
1、培养学生运用对比法和依据客观事实解决问题的逻辑思维能力
情感态度
价值观
1、引导学生树立“透过现象,抓住本质”的辩证唯物主义认识观点,培养学生善于观察、勤于思考的科学态度
重 点
溶液中微粒浓度的大小比较
难 点
双水解问题
知
识
结
构
与
板
书
设
计
一、电离平衡理论和水解平衡理论
1.电离理论:2.水解理论:
二、电解质溶液中的守恒关系
1、电荷守恒:电解质溶液中的阴离子的负电荷总数等于阳离子的正电荷总数,
2、物料守恒:就电解质溶液而言,物料守恒是指电解质发生变化(反应或电离)前某元素的原子(或离子)的物质的量等于电解质变化后溶液中所有含该元素的原子(或离子)的物质的量之和。
3、质子守恒:无论溶液中结合氢离子还是失去氢离子,但氢原子总数始终为定值,也就是说结合的氢离子的量和失去氢离子的量相等。
二、典型题――溶质单一型
1、弱酸溶液中离子浓度的大小判断
弱酸溶液中离子浓度大小的一般关系是:C(显性离子) > C(一级电离离子) > C(二级电离离子) > C(水电离出的另一离子)
2、弱碱溶液
3、能发生水解的盐溶液中离子浓度大小比较---弱酸强碱型
(1) 一元弱酸盐溶液中离子浓度的一般关系是:C(不水解离子) > C(水解离子)>C(显性离子)>C(水电离出的另外一种离子)
(2) 二元弱酸盐溶液中离子浓度的一般关系是:C(不水解离子)> C(水解离子)>C(显性离子)>C(二级水解离子)>C(水电离出的另一离子)
(3) 二元弱酸的酸式盐溶液中离子浓度大小的一般关系是:C(不水解离子)>C(水解离子)>C(显性离子)>C(水电离出的另一离子)>C(电离得到的酸根离子)
三、典型题----两种电解质溶液相混合型的离子浓度的判断
1、强酸与弱碱混合
2、强碱与弱酸混合:C(弱电解质的离子)>C(强电解质的离子)>C(显性离子) > C (水电离出的另一离子)
3、强碱弱酸盐与强酸混合和强酸弱碱盐与强碱混合
4、酸碱中和型
(1) 恰好中和型
(2) pH等于7型
(3) 反应过量型
四、守恒问题在电解质溶液中的应用
1、两种物质混合不反应:
2、两种物质恰好完全反应
3、两种物质反应,其中一种有剩余:
酸与碱反应型
(2)盐与碱(酸)反应型
4、不同物质同种离子浓度比较型
教学过程
教学步骤、内容
教学方法
【引入】电解质溶液中有关离子浓度的判断是近年高考的重要题型之一。解此类型题的关键是掌握“两平衡、两原理”,即弱电解质的电离平衡、盐的水解平衡和电解质溶液中的电荷守恒、物料守恒原理。首先,我们先来研究一下解决这类问题的理论基础。
【板书】一、电离平衡理论和水解平衡理论
1.电离理论:
【讲解】⑴弱电解质的电离是微弱的,电离消耗的电解质及产生的微粒都是少量的,同时注意考虑水的电离的存在;⑵多元弱酸的电离是分步的,主要以第一步电离为主;
【板书】2.水解理论:
【投影】从盐类的水解的特征分析:水解程度是微弱的(一般不超过2‰)。例如:NaHCO3溶液中,c(HCO3―)>>c(H2CO3)或c(OH― )
理清溶液中的平衡关系并分清主次:
【讲解】⑴弱酸的阴离子和弱碱的阳离子因水解而损耗;如NaHCO3溶液中有:c(Na+) > c(HCO3-)。⑵弱酸的阴离子和弱碱的阳离子的水解是微量的(双水解除外),因此水解生成的弱电解质及产生H+的(或OH-)也是微量,但由于水的电离平衡和盐类水解平衡的存在,所以水解后的酸性溶液中c(H+)(或碱性溶液中的c(OH-))总是大于水解产生的弱电解质的浓度;⑶一般来说“谁弱谁水解,谁强显谁性”,如水解呈酸性的溶液中c(H+)>c(OH-),水解呈碱性的溶液中c(OH-)>c(H+);⑷多元弱酸的酸根离子的水解是分步进行的,主要以第一步水解为主。
【过渡】守恒作为自然界的普遍规律,是人类征服改造自然的过程中对客观世界抽象概括的结果。在物质变化的过程中守恒关系是最基本也是本质的关系之一,化学的学习若能建构守恒思想,善于抓住物质变化时某一特定量的固定不变,可对化学问题做到微观分析,宏观把握,达到简化解题步骤,既快又准地解决化学问题之效。守恒在化学中的涉及面宽,应用范围极广,熟练地应用守恒思想无疑是解决处理化学问题的重要方法工具。
守恒思想是一种重要的化学思想,其实质就是抓住物质变化中的某一个特定恒量进行分析,不探究某些细枝末节,不考虑途径变化,只考虑反应体系中某些组分相互作用前后某种物理量或化学量的始态和终态。利用守恒思想解题可以达到化繁为简,化难为易,加快解题速度,提高解题能力,对溶液中离子浓度大小进行比较可以用守恒法。有关溶液中离子浓度大小比较的问题是中学化学中常见问题。这类题目知识容量大、综合性强,涉及到的知识点有:弱电解质的电离平衡、盐类的水解、电解质之间的反应等,既是教学的重点,也是高考的重点。如何用简捷的方法准确寻找这类问题的答案呢?在电解质溶液中常存在多个平衡关系,应抓住主要矛盾(起主要作用的平衡关系),利用三种守恒关系——电荷守恒(溶液电中性)、物料守恒(元素守恒)、质子守恒(水的电离守恒)。除此之外还有如 质量守恒、元素守恒、电子守恒、能量守恒等这里只讨论电解质溶液中的守恒问题。
【板书】二、电解质溶液中的守恒关系
1、电荷守恒:电解质溶液中的阴离子的负电荷总数等于阳离子的正电荷总数,
[讲]电荷守恒的重要应用是依据电荷守恒列出等式,比较或计算离子的物质的量或物质的量浓度。如(1)在只含有A+、M-、H+、OH―四种离子的溶液中c(A+)+c(H+)==c(M-)+c(OH―),若c(H+)>c(OH―),则必然有c(A+)<c(M-)。
【投影】例如,在NaHCO3溶液中,有如下关系:
C(Na+)+c(H+)==c(HCO3―)+c(OH―)+2c(CO32―)
【注意】书写电荷守恒式必须①准确的判断溶液中离子的种类;②弄清离子浓度和电荷浓度的关系。
【板书】2、物料守恒:就电解质溶液而言,物料守恒是指电解质发生变化(反应或电离)前某元素的原子(或离子)的物质的量等于电解质变化后溶液中所有含该元素的原子(或离子)的物质的量之和。
【讲解】实质上,物料守恒属于原子个数守恒和质量守恒。
【讲解】在Na2S溶液中存在着S2―的水解、HS―的电离和水解、水的电离,粒子间有如下关系
【投影】c(S2―)+c(HS―)+c(H2S)==1/2c(Na+) ( Na+,S2―守恒)
C(HS―)+2c(S2―)+c(H)==c(OH―) (H、O原子守恒)
【讲解】在NaHS溶液中存在着HS―的水解和电离及水的电离。
HS―+H2OH2S+OH― HS―H++S2― H2OH++OH―
【投影】从物料守恒的角度分析,有如下等式:c(HS―)+C(S2―)+c(H2S)==c(Na+);从电荷守恒的角度分析,有如下等式:c(HS―)+2(S2―)+c(OH―)==c(Na+)+c(H+);将以上两式相加,有:c(S2―)+c(OH―)==c(H2S)+c(H+)
【讲解】得出的式子被称为质子守恒
【板书】3、质子守恒:无论溶液中结合氢离子还是失去氢离子,但氢原子总数始终为定值,也就是说结合的氢离子的量和失去氢离子的量相等。
【过渡】现将此类题的解题方法作如下总结。
【板书】二、典型题――溶质单一型
1、弱酸溶液中离子浓度的大小判断
【讲解】解此类题的关键是紧抓弱酸的电离平衡
【点击试题】0.1ml/L 的H2S溶液中所存在离子的浓度由大到小的排列顺序是_________________
解析:在H2S溶液中有下列平衡:H2SH++HS―;HS―H++S2― 。已知多元弱酸的电离以第一步为主,第二步电离较第一步弱得多,但两步电离都产生H+,因此答案应为:c(H+)>c(HS―)>c(S2―)>c(OH―)
【板书】弱酸溶液中离子浓度大小的一般关系是:C(显性离子) > C(一级电离离子) > C(二级电离离子) > C(水电离出的另一离子)
【过渡】同样的思考方式可以解决弱碱溶液的问题
【板书】2、弱碱溶液
【点击试题】室温下,0.1ml/L的氨水溶液中,下列关系式中不正确的是
A. c(OH-)>c(H+)
B.c(NH3·H2O)+c(NH4+)=0.1ml/L
C.c(NH4+)>c(NH3·H2O)>c(OH-)>c(H+)
D.c(OH-)=c(NH4+)+c(H+)
【过渡】下面我们以弱酸强碱盐为例,来介绍一下能发生水解的盐溶液中离子浓度大小比较的解题方法
【板书】3、能发生水解的盐溶液中离子浓度大小比较---弱酸强碱型
【讲解】解此类题型的关键是抓住盐溶液中水解的离子
【点击试题】在CH3COONa 溶液中各离子的浓度由大到小排列顺序正确的是( )
A、c(Na+)>c(CH3COO―)>c(OH―)>c(H+)
B、c(CH3COO―)>c(Na+)>c(OH―)>c(H+)
C、c(Na+)>c(CH3COO―)>c(H+)>c(OH―)
D、c(Na+)>c(OH―)>c(CH3COO―)>c(H+)
解析:在CH3COONa溶液中: CH3COONaNa++CH3COO― ,CH3COO―+H2O CH3COOH+OH― ;而使c(CH3COO―)降低且溶液呈现碱性,则c(Na+)>c(CH3COO―),c(OH―)>c(H+),又因一般盐的水解程度较小,则c(CH3COO―)>c(OH―),因此A选项正确。
【板书】一元弱酸盐溶液中离子浓度的一般关系是:C(不水解离子) > C(水解离子)>C(显性离子)>C(水电离出的另外一种离子)
【点击试题】在Na2CO3溶液中各离子的浓度由小到大的排列顺序是______
解析:在Na2CO3溶液中,Na2CO3==2Na++CO32― ,CO32―+H2OHCO3―+OH― ,HCO3―+H2OH2CO3+OH― 。CO32―水解使溶液呈现碱性,则C(OH―)>C(H+),由于CO32―少部分水解,则C(CO32―)>C(HCO3―),HCO3―又发生第二步水解,则C(OH―)>C(HCO3―),第二步水解较第一步水解弱得多,则C(HCO3―)与C(OH―)相关不大,但C(H+)比C(OH―)小得多,因此C(HCO3―) > C(H+)。此题的答案为:C(H+)
【随堂练习】在Na2S溶液中下列关系不正确的是
A、c(Na+) =2c(HS-) +2c(S2-) +c(H2S)
B.c(Na+) +c(H+)=c(OH-)+c(HS-)+2c(S2-)
C.c(Na+)>c(S2-)>c(OH-)>c(HS-)
D.c(OH-)=c(HS-)+c(H+)+c(H2S)
【点击试题】判断0.1ml/L 的NaHCO3溶液中离子浓度的大小关系
解析:因NaHCO3==Na++HCO3―,HCO3―+H2OH2CO3+OH―,HCO3― H++CO32― 。HCO3―的水解程度大于电离程度,因此溶液呈碱性,且C(OH―) > C(CO32―)。由于少部分水解和电离,则C(Na+)>C(HCO3―)>C(OH―)>C(H+) > C(CO32―)。
【板书】二元弱酸的酸式盐溶液中离子浓度大小的一般关系是:C(不水解离子)>C(水解离子)>C(显性离子)>C(水电离出的另一离子)>C(电离得到的酸根离子)
【随堂练习】草酸是二元弱酸,草酸氢钾溶液呈酸性,在0.1ml/LKHC2O4溶液中,下列关系正确的是(CD)
A.c(K+)+c(H+)=c(HC2O4-)+c(OH-)+ c(C2O42-)
B.c(HC2O4-)+ c(C2O42-)=0.1ml/L
C.c(C2O42-)>c(H2C2O4)
D.c(K+)= c(H2C2O4)+ c(HC2O4-)+ c(C2O42-)
【过渡】下面再让我们利用上述规律来解决一下强酸弱碱盐的问题
【点击试题】在氯化铵溶液中,下列关系正确的是( )
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-) B.c(NH4+)>c(Cl-)>c(H+)>c(OH-)
C.c(NH4+)=c(Cl-)>c(H+)=c(OH-) D.c(Cl-)=c(NH4+)>c(H+)>c(OH-)
【板书】三、典型题----两种电解质溶液相混合型的离子浓度的判断
【讲解】解此类题的关键是抓住两溶液混合后生成的盐的水解情况以及混合时弱电解质有无剩余,若有剩余,则应讨论弱电解质的电离。下面以一元酸、一元碱和一元酸的盐为例进行分析。
【板书】1、强酸与弱碱混合
【点击试题】PH=13的NH3·H2O和PH=1的盐酸等体积混合后所得溶液中各离子浓度由大到小的排列顺序是____________
解析:PH==1的HCl,C(H+)==0.1 ml/L ,PH=13的NH3·H2O,C(OH―)== 0.1 ml/L ,则NH3 ·H2O 的浓度远大于0.1 ml/L ,因此,两溶液混合时生成NH4Cl为强酸弱碱盐,氨水过量,且C(NH3 ·H2O)>C(NH4Cl),则溶液的酸碱性应由氨水决定。即NH3·H2O的电离大于NH4+的水解,所以溶液中的离子浓度由大到小的顺序为:C(NH4+)>C(Cl―)>C(OH―)>C(H+)。
【讲解】需要我们注意的是,强酸弱碱盐溶液中加入一定量的弱碱,解题方法与此题相同。
【板书】2、强碱与弱酸混合
【点击试题】PH=X的NaOH溶液与PH=Y的CH3COOH溶液,已知X+Y=14,且Y<3。将上述两溶液等体积混合后,所得溶液中各离子浓度由大到小的顺序正确的是( )
A、C(Na+)>C(CH3COO―)>C(OH―)>C(H+)
B、C(CH3COO―)>C(Na+)>C(H+)>C(OH―)
C、C(CH3COO―)>C(Na+)>C(OH―)>C(H+)
D、C(Na+)>C(CH3COO―)>C(H+)>C(OH―)
解析:同上,PH==X的NaOH溶液中,C(OH―)==10-(14-X) ml/L,PH==Y的CH3COOH 溶液中,C(H+)==10-Y ml/L,因为X+Y==14,NaOH溶液中C(OH―)等于CH3COOH溶液中C(H+)。因此C(CH3COOH)远大于10-Y ml/L,CH3COOH过量,因此选项B正确。
【讲解】上述两题的特点是PH1+PH2==14,且等体积混合。其溶液中各离子浓度的关系的特点是
【板书】C(弱电解质的离子)>C(强电解质的离子)>C(显性离子) > C (水电离出的另一离子)
3、强碱弱酸盐与强酸混合和强酸弱碱盐与强碱混合
【点击试题】0.2 ml/L的CH3COOK与0.1 ml/L的盐酸等体积混合后,溶液中下列粒子的物质的量关系正确的是( )
A、C(CH3COO―)==C(Cl―)==C(H+)>C(CH3COOH)
B、C(CH3COO―)==C(Cl―)>C(CH3COOH)>C(H+)
C、C(CH3COO―)>C(Cl―)>C(H+)>C(CH3COOH)
D、C(CH3COO―)>C(Cl―)>C(CH3COOH)>C(H+)
解析:两溶液混合后CH3COOK+HCl KCl+CH3COOH,又知CH3COOK过量,反应后溶液中CH3COOK、CH3COOH和KCl物质的量相等。由于CH3COOH的电离和CH3COO―的水解程度均很小,且CH3COOH的电离占主导地位,因此,C(CH3COO―)>C(H+)>C(OH―)。又知C(Cl―)==0.05 ml/L,C(CH3COOH)<0.05 ml/L。因此,选项中D是正确的。
【板书】4、酸碱中和型
(1) 恰好中和型
【点击试题】在10ml 0.1ml·L-1NaOH溶液中加入同体积、同浓度HAc 溶液,反应后溶液中各微粒的浓度关系错误的是( )。
A.c(Na+)>c(Ac-)>c(H+)>c(OH-) B.c(Na+)>c(Ac-)>c(OH-)>c(H+)
C.c(Na+)=c(Ac-)+c(HAC) D.c(Na+)+c(H+)=c(Ac-)+c(OH-)
解析:由于混合的NaOH与HAc物质的量都为1×10-3ml,两者恰好反应生成NaAc,等同于单一溶质,故与题型①方法相同。由于少量Ac-发生水解:Ac- + H2OHAc+ OH-。故有c(Na+)>c(Ac-)>c(OH-)>c(H+),根据物料守恒C正确,根据电荷守恒D正确,A错误。故该题选项为A。
【板书】(2) pH等于7型
【点击试题】常温下,将甲酸和氢氧化钠溶液混合,所得溶液pH=7,则此溶液中( )。
A.c(HCOO-)>c(Na+) B.c(HCOO-)<c(Na+)
C.c(HCOO-)=c(Na+) D.无法确定c(HCOO-)与c(Na+)的关系
解析:本题绝不能理解为恰好反应,因完全反应生成甲酸钠为强碱弱酸盐,溶液呈碱性,而现在Ph=7,故酸略为过量。根据溶液中电荷守恒:c(Na+)+ c(H+)= c(HCOO-)+c(OH-) 因pH=7,故c(H+)= c(OH-),所以有c(Na+)= c(HCOO-),答案为C。
【板书】(3) 反应过量型
【点击试题】常温下将稀NaOH溶液与稀CH3COOH溶液混合,不可能出现的结果是
A.pH>7,且 c(OH—) > c(Na+) > c(H+) > c(CH3COO—)
B.pH>7,且 c(Na+) + c(H+) = c(CH3COO—) + c(OH—)
C.pH<7,且c(CH3COO—) > c(H+) >c(Na+)> c(OH—)
D.pH=7,且c(CH3COO—) > c(Na+) >c(H+) = c(OH—)
【随堂练习】1、将标准状况下的2.24LCO2通入150ml1ml/LnaOH溶液中,下列说法正确的是(A)
A.c(HCO3-)略大于c(CO32-)
B.c(HCO3-)等于c(CO32-)
C.c(Na+)等于c(CO32-)与c(HCO3-)之和
D.c(HCO3-)略小于c(CO32-)
2、向0.1ml·L-1NaOH溶液中通入过量CO2后,溶液中存在的主要离子是( )
A Na+、CO32- B Na+、HCO3- C HCO3-、CO32- D Na+、OH-
【板书】四、守恒问题在电解质溶液中的应用
【讲解】解此类题的关键是抓住溶液呈中性(即阴阳离子所带电荷总数相等)及变化前后原子的个数守恒两大特点。若题中所给选项为阴阳离子的浓度关系,则应考虑电荷守恒,若所给选项等式关系中包含了弱电解质的分子浓度在内,则应考虑物料守恒。
【点击试题】表示0.1 ml/L NaHCO3溶液中有关粒子浓度的关系正确的是( )
A、C(Na+)>C(HCO3―)>C(CO32―)>C(H+)>C(OH―)
B、C(Na+)+C(H+)==C(HCO3―)+C(CO32―)+C(OH―)
C、C(Na+)+C(H+)==C(HCO3―)+2C(CO32―)+C(OH―)
D、C(Na+)==C(HCO3―)+C(CO32―)+C(H2CO3)
解析:A、NaHCO3溶液因为水解大于电离而呈碱性,因此C(OH―)>C(H+)。
B、应考虑电荷守恒,C(CO32―)前应乘以2;C、电荷守恒符合题意;D、含弱电解质分子应考虑物料守恒,在NaHCO3溶液中存在下列关系:NaHCO3==Na++HCO3― ;HCO3―H++CO32― ;HCO3―+H2O H2CO3+OH― 则C(Na+)==C(HCO3―)+C(CO32―)+C(H2CO3)符合题意。故选CD
【板书】1、两种物质混合不反应:
【点击试题】用物质的量都是0.1 ml的CH3COOH和CH3COONa配制成1L混合溶液,已知其中C(CH3COO-)>C(Na+),对该混合溶液的下列判断正确的是( )
A.C(H+)>C(OH-) B.C(CH3COOH)+C(CH3COO-)=0.2 ml/L
C.C(CH3COOH)>C(CH3COO-) D.C(CH3COO-)+C(OH-)=0.2 ml/L
【板书】2、两种物质恰好完全反应
【点击试题】在10ml 0.1ml·L-1NaOH溶液中加入同体积、同浓度HAc溶液,反应后溶液中各微粒的浓度关系错误的是( )。
A.c(Na+)>c(Ac-)>c(H+)>c(OH-)
B.c(Na+)>c(Ac-)>c(OH-)>c(H+)
C.c(Na+)=c(Ac-)+c(HAC)
D.c(Na+)+c(H+)=c(Ac-)+c(OH-)
【板书】3、两种物质反应,其中一种有剩余:
(1)酸与碱反应型
【讲解】关注所给物质的量是物质的量浓度还是pH。 在审题时,要关注所给物质的量是“物质的量浓度”还是“pH”,否则会很容易判断错误。(解答此类题目时应抓住两溶液混合后剩余的弱酸或弱碱的电离程度和生成盐的水解程度的相对大小。)
【点击试题】把0.02 ml·L-1 HAc溶液与0.01 ml·L-1NaOH溶液等体积混合,则混合液中微粒浓度关系正确的是( )
A、c(Ac-)>c(Na+) B、c(HAc)>c(Ac-)
C、2c(H+)=c(Ac-)-c(HAc) D、c(HAc)+c(Ac-)=0.01 ml·L-1
【板书】(2)盐与碱(酸)反应型
【讲解】解答此类题目时应抓住两溶液混合后生成的弱酸或弱碱的电离程度和剩余盐的水解程度的相对大小。
【点击试题】将0.1ml·L-1 醋酸钠溶液20mL与0.1ml·L-1盐酸10mL混合后,溶液显酸性,则溶液中有关粒子浓度关系正确的是( )。
A.c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH)
B.c(CH3COO-)>c(Cl-)+c(CH3COOH)>c(H+)
C.c(CH3COO-)=c(Cl-)>c(H+)>c(CH3COOH)
D.c(Na+)+c(H+)=c(CH3COO-)+c(Cl-)+c(OH-)
【板书】4、不同物质同种离子浓度比较型:
【点击试题】物质的量浓度相同的下列溶液中,NH4+浓度最大的是( )。
A.NH4Cl B.NH4HSO4 C.CH3COONH4 D.NH4HCO3
解析:NH4+在溶液中存在下列平衡:NH4+ + H2O NH3·H2O + H+ B中NH4HSO4电离出大量H+,使平衡向左移动,故B中c(NH4+)大于A中的c(NH4+),C项的CH3COO-和D项的HCO3-水解均呈碱性,使平衡向右移动,故C、D中c(NH4+)小于A中c(NH4+),正确答案为B。
【小结】电解质溶液中离子浓度大小比较问题,是高考的“热点”之一。 多年以来全国高考化学试卷年年涉及这种题型。这种题型考查的知识点多,灵活性、综合性较强,有较好的区分度,它能有效地测试出学生对强弱电解质、电离平衡、电离度、水的电离、pH值、离子反应、盐类水解等基本概念的掌握程度及对这些知识的综合运用能力。
首先必须有正确的思路:
其次要掌握解此类题的三个思维基点:电离、水解和守恒(电荷守恒、物料守恒及质子守恒)。对每一种思维基点的关键、如何切入、如何展开、如何防止漏洞的出现等均要通过平时的练习认真总结,形成技能。
第三,要养成认真、细致、严谨的解题习惯,要在平时的练习中学会灵活运用常规的解题方法,例如:淘汰法、定量问题定性化、整体思维法等。
教学回顾:
高中化学人教版 (2019)选择性必修1第三节 盐类的水解教案设计: 这是一份高中化学人教版 (2019)选择性必修1第三节 盐类的水解教案设计,共5页。教案主要包含了导入新课,新课讲授等内容,欢迎下载使用。
化学选择性必修1第三章 水溶液中的离子反应与平衡第三节 盐类的水解教学设计: 这是一份化学选择性必修1第三章 水溶液中的离子反应与平衡第三节 盐类的水解教学设计,共7页。教案主要包含了导入新课,新课讲授等内容,欢迎下载使用。
高中化学人教版 (新课标)选修4 化学反应原理第三节 盐类的水解教学设计及反思: 这是一份高中化学人教版 (新课标)选修4 化学反应原理第三节 盐类的水解教学设计及反思,共8页。