





化学选择性必修1第二章 化学反应速率与化学平衡实验活动1 探究影响化学平衡移动的因素图文ppt课件
展开在一定条件下,当一个可逆反应达到平衡状态时,即该反应达到了该条件下的最大限度。
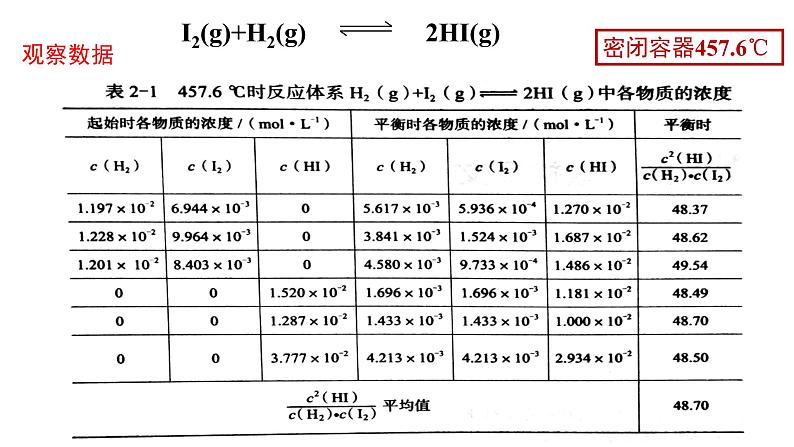
分析教材数据,计算平衡时 的数值。
c(H2)•c(I2)
如何更加准确描述反应所进行的程度呢?
请大家分析表中的数据,你能从中得到什么结论?
I2(g)+H2(g) 2HI(g)
通过分析表数据得出:(1)温度不变时,不管如何改变起始投料(投入反应物、投入生成物、改变各组分的浓度) 数值基本不变,是一个常数,用K表示;化学上叫化学平衡常数(2)常数K与反应的起始浓度大小无关;(3)常数K与正向建立还是逆向建立平衡无关,即与平衡建立的过程无关。(4)常数K只与温度有关,与反应物或生成物的浓度变化无关。
在一定温度时,当一个可逆反应达到平衡状态时,生成物平衡浓度的幂之积与反应物平衡浓度的幂之积的比值是一个常数,这个常数称为化学平衡常数简称平衡常数。用符号K表示。
人们对其他化学平衡体系的数据进行分析,也发现了类似的关系,平衡常数的含义是什么?
2、平衡常数的数学表达式及单位:
浓度的单位为ml·L-1 K的单位为(ml·L-1)n;
其中c为各组分的平衡浓度
注:纯固体和纯液体浓度计为1,不列入平衡常数表达式
当浓度的单位为 ml·L-1,称标准平衡常数,标准平衡常数不写单位。
一般标准平衡常数不写单位
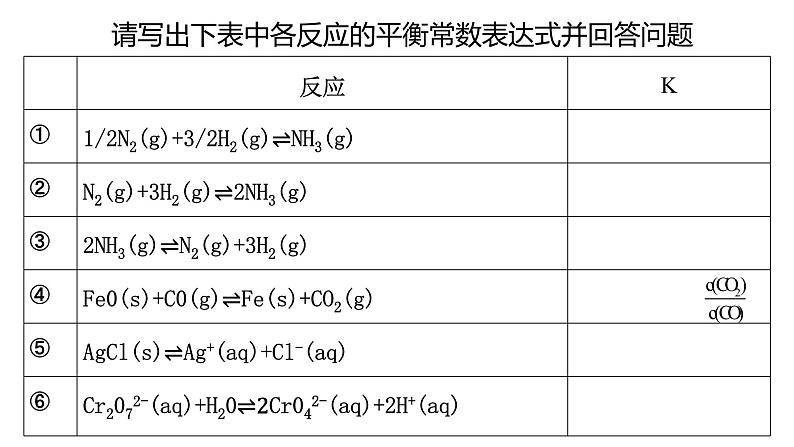
练习:写出下列化学方程式的平衡表达式
请写出下表中各反应的平衡常数表达式并回答问题
3、使用平衡常数应注意的问题
(1)必须指明温度,反应必须达到平衡状态
(2)平衡常数表示反应进行的程度,不表示反应的快慢,即速率大,K值不一定大
(3)在进行K值的计算时,纯固体、纯液体不作考虑,表达式中不需表达
(4)在进行K值的计算时,稀溶液中进行的反应,如有水参加,水的浓度也不必写在平衡关系式中。
非水溶液中的反应,如有水生成或有水参加反应,此时水的浓度不可视为常数,必须表示在平衡关系式中。如酒精和醋酸的液相反应C2H5OH+CH3COOH CH3COOC2H5+H2OK=[CH3COOC2H5][H2O]/([C2H5OH][CH3COOH])
(5)平衡常数的表达式与方程式的书写有关
同一化学反应,可以用不同的化学反应式来表示,每个化学方程式都有自己的平衡常数关系式及相应的平衡常数。由于反应物、生成物的系数不同,所以平衡常数的表达式就不同。对于给定的化学反应,正、逆反应的平衡常数互为倒数。
(6)、多重平衡规则 若干方程式相加(减),则总反应的平衡常数等于分步平衡常数之乘积(商)例1: 2NO (g) + O2 (g) 2NO2 K1 2NO2 (g) N2O4 K2 2NO (g) +O2(g) N2O4 (g) K = K1 K2
例2: C (s) + CO2(g) 2CO(g) K C (s) + H2O (g) CO (g) + H2 (g) K1CO (g) +H2O (g) CO2 (g) + H2 (g) K2
1.已知下列反应的平衡常数:①H2(g) + S(s) H2S(g) K1②S(s) + O2(g) SO2(g) K2则反应③H2(g) + SO2(g) O2(g) + H2S(g)的平衡常数是( ) A.K1 + K2 B.K1–K2 C.K1×K2 D.K1/K2
①对给定的反应来说,K值越大,反应程度越大,转化率越高;反之则转化率越低。
K值越大,正向反应进行的程度越大。
③一般:K >105,认为正反应进行得较完全 K <10-5 认为 正反应很难进行(逆反应较完全) 10-5 ≤K ≤ 105 认为是可逆反应
④平衡常数数值大小,只能大致反映一个可逆反应的正向反应进行的最大程度,并不能预示反应达到平衡所需要的时间。
②K只受温度影响,与反应物或生成物的浓度变化无关。
①判断反应的热效应 对给定的反应来说,K值只随温度变化,不随反应物的浓度变化。吸热反应,升高温度,K会变大。放热反应,升高温度,K会变小
②判断反应进行的方向利用化学平衡常数可以判断一个化学反应是否达到平衡状态。
利用温度改变时K值的变化可判断反应的热效应
Q<K ,V正>V逆,反应向正方向进行
Q=K ,V正=V逆,反应处于平衡状态
Q>K ,V正<V逆,反应向逆方向进行
浓度商中的浓度为任意时刻的浓度,而平衡常数中的浓度为平衡时的浓度。
某温度下,反应H2(g)+I2(g) 2HI(g)的平衡常数K=0.25,请判断H2、I2、HI的浓度分别是下列数值时,体系是否处于平衡状态,如不处于平衡状态,反应将向哪方向进行?(1)c(H2)=0.1ml/L, c(I2)=0.1ml/L,c (HI)=0.2ml/L(2)c(H2)=0.16ml/L,c(I2)=0.16ml/L,c(HI)=0.08ml/L
Q>K,v正<v逆,反应向逆方向进行
K增大→产物所占的比例增大→正反应进行程度增大→反应进行越完全→反应物转化率增大
一般来说,当K>105时,反应基本完全(不可逆反应); 当K<10-5时,反应很难进行
(1)在平衡常数表达式中,反应物浓度用起始浓度,生成物浓度用平衡浓度。( )(2)对于一个可逆反应,平衡正向移动时,平衡常数一定增大。( )(3)某反应为N2(g)+3H2(g) 2NH3(g),其平衡常数表达式为K= ( )(4)平衡常数的大小只与温度有关,而与浓度、压强、催化剂等无关。( )
1.判断正误(正确的打“√”,错误的打“×”)
c(N2)·c(H2)
解析:化学平衡常数是生成物浓度幂之积与反应物浓度幂之积的比值,但固体浓度可视为1,不写入平衡常数的计算式中。
B.改变条件后,该反应的平衡常数一定不变C.如果改变压强并加入催化剂,平衡常数会随之变化D.若平衡时增加A和B的浓度,则平衡常数会减小
解析:化学平衡常数只受温度影响,B、C、D三项错误。
4.对于反应A+B AB,下列平衡常数中,最能说明反应有利于生成AB的是( )A.K=5.1×10-5 B.K=3.5×10-4C.K=4.0×10-7 D.K=8.2×10-9
解析:平衡常数越大,可逆反应进行的程度越大,越有利于生成AB。
5.对于可逆反应:C(s)+CO2(g)⇌2CO(g),在一定温度下,其平衡常数为K,下列条件的变化中,能使K发生变化的是( )A.将C(s)的表面积增大B.增大体系压强C.升高体系温度D.使用合适的催化剂
6.已知450℃时,反应H2(g)+I2(g)⇌2HI(g)的k=50,由此推测在450 ℃时,反应2HI(g) ⇌ H2(g)+I2(g)的化学平衡常数为( ) A.50 B. 0.02 C.100 D.无法确定
人教版 (2019)选择性必修1第二章 化学反应速率与化学平衡第二节 化学平衡教案配套课件ppt: 这是一份人教版 (2019)选择性必修1第二章 化学反应速率与化学平衡第二节 化学平衡教案配套课件ppt,共34页。
人教版 (2019)选择性必修1第二章 化学反应速率与化学平衡第二节 化学平衡优质ppt课件: 这是一份人教版 (2019)选择性必修1第二章 化学反应速率与化学平衡第二节 化学平衡优质ppt课件,共29页。PPT课件主要包含了学习目标,一可逆反应,二化学平衡状态,四化学平衡常数等内容,欢迎下载使用。
高中人教版 (2019)第二节 化学平衡说课ppt课件: 这是一份高中人教版 (2019)第二节 化学平衡说课ppt课件,文件包含选择性必修1第二章第二节第2课时化学平衡常数-教学课件pptx、选择性必修1第二章第二节第2课时化学平衡常数-教学设计docx、选择性必修1第二章第二节第2课时化学平衡常数-作业设计docx等3份课件配套教学资源,其中PPT共27页, 欢迎下载使用。













