





人教版 (2019)选择性必修1实验活动2 强酸与强域的中和滴定教案配套ppt课件
展开通过前面的学习我们知道化学平衡只有在一定的条件下才能保持。当外界条件改变,旧的化学平衡将被破坏,并建立起新的平衡状态。这个过程就叫化学平衡的移动。
1.含义:当一个可逆反应达到平衡后,如果改变浓度、温度、压强等反应条件,原来的平衡状态会被破坏,化学平衡会发生移动,在一段时间后达到新的平衡。用图示表示如下
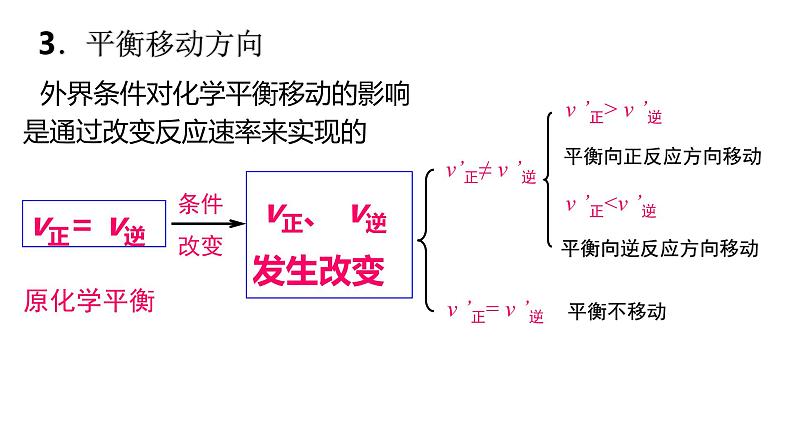
v’正= v ’逆
改变条件,v正、v逆均改变,平衡一定移动吗?
v正、 v逆 发生改变
v ’正> v ’逆
外界条件对化学平衡移动的影响是通过改变反应速率来实现的
二.影响化学平衡移动的条件
1.浓度对化学平衡的影响
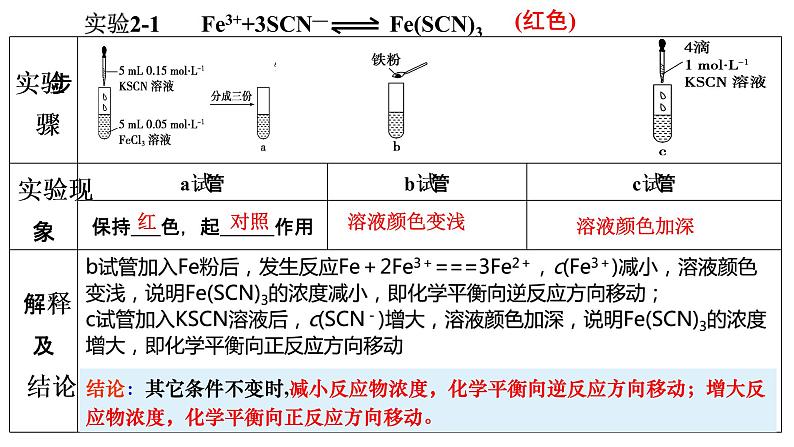
FeCl3溶液与KSCN溶液的反应体系中存在如下平衡: Fe3+ + 3SCN- Fe(SCN)3 (浅黄色) (无色) (红色)
实验2-1 Fe3++3SCN— Fe(SCN)3
b试管加入Fe粉后,发生反应Fe+2Fe3+===3Fe2+,c(Fe3+)减小,溶液颜色变浅,说明Fe(SCN)3的浓度减小,即化学平衡向逆反应方向移动;c试管加入KSCN溶液后,c(SCN-)增大,溶液颜色加深,说明Fe(SCN)3的浓度增大,即化学平衡向正反应方向移动
结论:其它条件不变时,减小反应物浓度,化学平衡向逆反应方向移动;增大反应物浓度,化学平衡向正反应方向移动。
在其他条件不变的情况下: 增大反应物浓度或 减小生成物浓度 增大生成物浓度或 减小反应物浓度
化学平衡向正反应方向移动
化学平衡向逆反应方向移动
用v -t图像表示如下
增加任何一种反应物的浓度, v正 > v逆,平衡向正反应方向移动
减少任何一种反应物的浓度, V正 < V逆,平衡向逆反应方向移动
由以上图示可以得出结论:
1)改变反应物浓度瞬间,只能改变正反应速率 改变生成物浓度瞬间,只能改变逆反应速率
2)改变浓度瞬间, 若v(正)>v(逆),平衡向正反应方向移动 若v(逆)>v(正),平衡向逆反应方向移动
3)新旧平衡速率比较: 增大浓度,新平衡速率大于旧平衡速率 减小浓度,新平衡速率小于旧平衡速率
在等温下,对于一个已达到化学平衡的反应时,当改变反应物或生成物的浓度时,导致浓度商Q发生了改变,但K不变,根据浓度商与平衡常数的大小关系,可以判断化学平衡移动的方向。①Q=K:可逆反应处于平衡状态。②Q<K:平衡向正反应方向移动,直至达到新的平衡状态。③Q>K:平衡向逆反应方向移动,直至达到新的平衡状态。
在含两种或两种以上反应物的反应中,增大一种反应物的浓度,其他物质的转化率提高,而该物质的转化率通常降低。故在实际工业生产中往往增大成本较低的反应物的浓度,以提高成本较高的原料的转化率。降低成本
(4)浓度对化学平衡移动的几个注意点
①对平衡体系中的固态和纯液态物质,其浓度可看作一个常数,增加或减小固态或液态纯净物的量并不影响V正、V逆的大小,所以化学平衡不移动。
②只要是增大浓度,不论增大的是反应物浓度,还是生成物浓度,新平衡状态下的反应速率一定大于原平衡状态的反应速率; 即 v正’= v 逆’ > v正= v 逆 ;减小浓度,新平衡状态下的速率一定小于原平衡状态的反应速率。即v正’= v 逆’ < v正= v 逆
③稀水溶液中增加水的量,视为对别的物质的稀释。稀释溶液,平衡向方程式中化学计量数之和增大的方向移动
在溶液中进行的反应,如果稀释溶液,反应物浓度减小,生成物浓度也减小,v正减小,v逆也减小,但减小的程度不同,总的结果是化学平衡向反应方程式中化学计量数之和大的方向移动。
④改变的浓度必须是真正参与反应的物质的浓度,否则平衡不移动。
(1)试用“浓度对化学平衡的影响”来解释“用排饱和食盐水法收集Cl2可以抑制Cl2的溶解”。
(2)H2O(g) +C(s) CO(g) + H2(g),在密闭容器中进行。一定条件下达到平衡状态,改变下列条件,能否引起平衡移动?CO浓度有何变化? ①增大水蒸汽浓度 ②加入固体炭 ③增加H2浓度
正向移动,CO浓度增大
逆向移动,CO浓度减小
结论:对平衡体系中的固态和纯液态物质,增加或减小固态或液态纯净物的量并不影响v正、v逆的大小,所以化学平衡不移动。
(3)如图是合成氨的反应,N2(g)+3H2(g) 2NH3(g),速率随时间的变化关系图。
①t0时反应从哪方开始?②t1、t2分别改变的条件及平衡移动的方向?
t0 t1 t2
(4)在某容器中,C(s) + H2O(g) ⇌ CO(g) + H2(g)
反应达平衡,在温度、容器体积不变的情况下,向容器中充入一定量的H2,当建立新平衡时( )
A、CO、H2 的浓度都比原平衡时小B、CO、H2 的浓度都比原平衡时大C、H2O(g)、H2 的浓度都比原平衡时大D、 H2O(g)、CO 的浓度都比原平衡时大
可逆反应2A(g)+B(g)⇌C(s)+D(g) 达到平衡时, 要使正反应速率下降,A的浓度增大,应采用的措施是( )A、增大A的浓度 E、减小A的浓度 B、增大B的浓度 F、减小B的浓度 C、增大C的浓度 G、减小C的浓度D、增大D的浓度 H、减小D的浓度
1.某一可逆反应,一定条件下达到了化学平衡。(1)若化学反应速率改变,化学平衡是否发生移动?(2)若化学平衡发生移动,化学反应速率是否一定发生改变?2.有固体(或纯液体)参加的反应,达到平衡后,增加或减少固体(或纯液体)的量,平衡是否会发生移动?
答案:(1)若v(正)、v(逆)依然相等,则平衡不移动,否则移动。(2)只要平衡发生移动,则反应速率一定发生改变。
答案:不会移动,改变固体(或纯液体)的量,不会改变固体(或纯液体)的浓度,平衡不会发生移动。
1.体积一定的恒温密闭容器中加入等物质的量的X、Y,进行如下可逆反应:X(g)+Y(g) Z(g)+W(s) ΔH>0。下列叙述正确的是( )A.若继续充入X,平衡向正反应方向移动,Y的转化率增大B.若继续充入Z,平衡逆向移动,Z的体积分数减小C.若移走部分W,平衡正向移动D.平衡后移走X,上述反应的ΔH减小
解析:B项,通入Z,平衡逆向移动,Z的体积分数增大。C项,W为固体,改变其用量,平衡不移动。D项,ΔH的大小与方程式中各物质的化学计量数及状态有关,与加入反应物的量无关。
2.合成氨所需的氢气可用煤和水作原料经多步反应制得,其中的一步反应为CO(g)+H2O(g) CO2(g)+H2(g) ΔH<0。反应达到平衡后,为提高CO的转化率,下列措施中不正确的是( )A.容器容积不变,再充入CO B.容器的容积不变,及时移走CO2C.增大H2O的浓度 D.减小H2的浓度
解析:一般来说,有两种及两种以上反应物的可逆反应中,在其他条件不变时,增大其中一种反应物的浓度,能使其他反应物的转化率升高,但其本身的转化率反而降低,故A项错误;及时移走CO2可减小CO2的浓度,使平衡正向移动,提高CO的转化率;增大H2O的浓度,平衡正向移动,可提高CO的转化率;减小产物浓度,平衡正向移动,可提高CO的转化率。
人教版 (2019)选择性必修1第二节 化学平衡课文内容课件ppt: 这是一份人教版 (2019)选择性必修1第二节 化学平衡课文内容课件ppt,共59页。
人教版 (2019)选择性必修1第二节 化学平衡优秀ppt课件: 这是一份人教版 (2019)选择性必修1第二节 化学平衡优秀ppt课件,共26页。PPT课件主要包含了学习目标,一化学平衡的移动等内容,欢迎下载使用。
化学选择性必修1第二节 化学平衡教学ppt课件: 这是一份化学选择性必修1第二节 化学平衡教学ppt课件,文件包含选择性必修1第二章第二节第3课时影响化学平衡的因素-教学课件pptx、选择性必修1第二章第二节第3课时影响化学平衡的因素-学案doc、选择性必修1第二章第二节第3课时影响化学平衡的因素-教学设计1docx、选择性必修1第二章第二节第3课时影响化学平衡的因素-作业设计docx等4份课件配套教学资源,其中PPT共27页, 欢迎下载使用。













