






化学人教版 (2019)第二章 化学反应速率与化学平衡本单元综合与测试课文配套课件ppt
展开
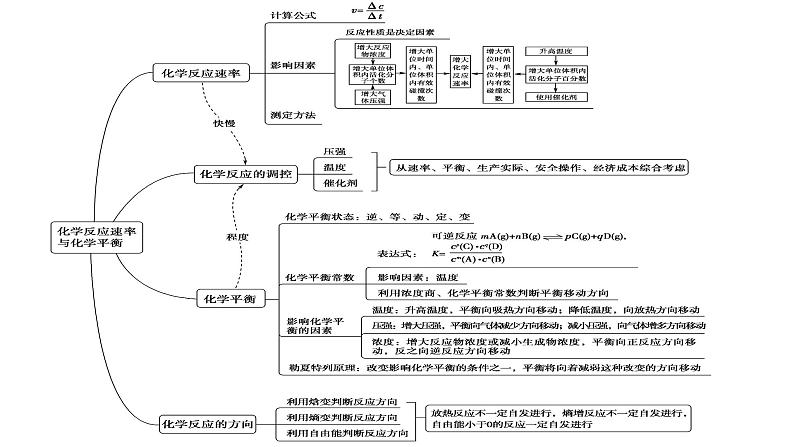
这是一份化学人教版 (2019)第二章 化学反应速率与化学平衡本单元综合与测试课文配套课件ppt,共38页。PPT课件主要包含了表示方法,化学反应速率,1内因,2外因,反应物本身的性质,浓度增大,压强增大,温度升高,催化剂,体积不变等内容,欢迎下载使用。
3、单位:ml/(L·s) ;ml/(L·min)
化学反应速率用单位时间内反应物浓度的减少或生成物浓度的增加来表示化学反应进行快慢的物理量
4、计算化学反应速率时必须明确:
(1) 在同一反应中用不同物质来表示时,其数值可以不同,但都表示同一个反应的速率.因此,表示化学反应的速率时,必须说明反应物中哪种物质做标准.不同物质的速率的比值一定等于化学方程式中相应的化学计量数之比.(2)一般来说,化学反应速率随反应的进行而逐渐减慢.因此,某一段时间内的反应速率,是平均速率,而不是指瞬时速率.(3)化学反应速率一般不能用固体或纯液体表示。
5、 影响化学反应速率的因素
浓度、温度、压强、催化剂
①浓度对反应速率的影响
规律:其他条件不变时,增大反应物浓度,可以增大化学反应速率;减小反应物浓度,可以减小化学反应速率。
解释:在温度一定时,活化分子所占百分含量一定,浓度增大使得单位体积中活化分子的数目增加,单位体积内活化分子百分数不变,单位时间有效碰撞次数增多,因而使反应速率增大
注意:①对于纯液体和或固体反应物,其浓度是常数,因此改变它们的量不会改变化学反应速率。②对于可逆反应,反应物或生成物浓度的改变,其正、逆反应速率的变化也符合上述规律。
②压强对反应速率的影响
规律:对于有气体参加的反应,若其他条件不变,增大压强,反应速率加快,减小压强,反应速率减慢。
对于气体反应,当其它条件不变时,增大压强相当于增大反应物的浓度,反应速率加快;减小压强相当于减少反应物的浓度,反应速率减慢。(只适宜有气体参加的反应,如果只有固体或液体参加的反应,压强的变化对于反应速率可以忽略不计。)
注意:①对于纯液体、溶液或固体反应物,由于压强的变化对它们的浓度几乎无影响,可以认为反应速率不变。②对于有气体参加和有气体生成的可逆反应,增大压强,反应物和生成物浓度都增大,其正、逆反应速率都增大;减小压强,其正、逆反应速率都减小。
解释:增大压强,反应物的浓度增大,单位体积内活化分子数目增多,单位体积内活化分子百分数不变,有效碰撞的几率增大多,反应速率加快。
规律:若其他条件不变,升高温度,反应速率加快,降低温度,反应速率减慢。
②对于可逆反应,升高(或降低)温度,其正、逆反应速率都增大(或减小),但放热反应和吸热反应的反应速率受温度的影响程度不同,即其正、逆反应速率增大(或减小)的程度不同 。
注意:①一般温度每升高10℃,反应速率增加2-4倍。
③温度对化学反应速率的影响:
解释:在浓度一定时,升高温度,反应物分子的能量增加,使原来一部分原来能量较低的分子变成活化分子,从而增加了反应物分子中的活化分子数,使有效碰撞次数增多,因而使反应速率增大。
④催化剂对化学反应速率的影响
解释:催化剂能够降低反应所需要的活化能,这样使更多的反应物分子成为活化分子,大大增加单位体积内反应物分子中活化分子所占百分数,从而提高了有效碰撞的频率,成千上万倍地增大化学反应速率。
规律:若其他条件不变,使用催化剂能够,反应速率加快。
单位体积内分子总数增多,活化分子百分数不变
单位体积内分子总数不变,活化分子百分数增大
单位体积内活化分子数增多
①在一定条件下的可逆反应里,正反应和逆反应速率相等,反应混合物中各组成成分的浓度保持不变的状态叫化学平衡状态
②它的建立与反应途径无关,从正反应或逆反应开始都可以建立平衡状态
浓度、温度、压强发生改变
规律:其他条件不变的情况下,增大反应物的浓度或减小生成物的浓度,平衡正向移动;减小反应物的浓度或增大生成物的浓度,平衡逆向移动
①增大某一反应物浓度,另一反应物转化率↑,自身转化率↓。
②固体或纯液体量的改变不影响速率, 平衡不移动。
用速率时间图像表示如下
生产实际中,常常通过增大廉价原料的浓度使平衡向正反应方向移动,来提高另一种价格较高的原料的转化率。
规律:其他条件不变的情况下,增大压强,平衡向气体体积缩小的方向移动;减小压强,平衡向气体体积增大的方向移动。用图像表示如下
①适用范围:有气体参与
②反应前后气态物质的系数和相同, 改变压强平衡不移动
③压强对平衡的影响是通过改变浓度 来实现的
规律:其他条件不变的情况下,温度升高,平衡向吸热方向移动;温度降低,平衡向放热方向移动。用图像表示如下
催化剂对化学平衡无影响
催化剂同等程度的改变正、逆反应速率,Vˊ正= Vˊ逆
但可缩短反应达平衡所需的时间。
生成物浓度增大,但比原来小
生成物浓度减小,但比原来大
反应物浓度增大,但比原来小
反应物浓度减小,但比原来大
外界条件对化学平衡的影响
体系温度升高,但比原来低
体系温度降低,但比原来高
体积压强增大,但比原来小
向气体体积增大的方向移动
体系压强减小,但比原来大
向气体体积减小的方向移动
四、平衡移动原理(勒夏特列原理)
如果改变影响平衡的一个条件(浓度、压强、温度),平衡就向着能够减弱这种改变的方向移动。
化学平衡移动原理是一条普遍规律。勒夏特列原理适用于所有动态平衡的体系(化学平衡、溶解平衡、电离平衡等),不适用于未达到平衡的体系。
外界条件对反应物转化率的影响
若使平衡向正反应方向移动,反应物转化率一定增大。
(1)反应物不只一种,
(2)反应物只有一种,
①若只增加A的量,A转化率减小,B转化率增大。
②若按原比例同倍数增加A、B的量:
若增加A的量,相当于加压,A转化率与气体系数有关。
若m+n>p+q,A转化率增大
若m+n=p+q,A转化率不变
若m+n 0 有利于反应自发进行,但自发反应不一定都是△S > O。
化学反应进行的方向判据:体系总是要向着使自身能量降低(焓减)、混乱度增大(即熵增)(由有序趋向无序)的方向转变;由焓判据和熵判据组合成的复合判据将更适合于所有的过程。
△ G=△H—T △S
3、复合判据(自由能变化)
1.当△ H0 ,即△ G0, △ S0时,反应不自发进行
3.当△ H>0, △ S>0 或△ H
相关课件
这是一份高中化学人教版 (2019)选择性必修2第二章 分子结构与性质本章综合与测试教学演示课件ppt,共28页。PPT课件主要包含了σ键对数,孤电子对数,分子的立体构型,VSEPR模型,价层电子对数,杂化轨道类型,σ键个数,a-xb2,①确定价层电子对数,②判断VSEPR模型等内容,欢迎下载使用。
这是一份2020-2021学年第二章 化学反应速率和化学平衡综合与测试复习ppt课件,共58页。
这是一份化学第二章 化学反应速率和化学平衡综合与测试复习课件ppt,共23页。PPT课件主要包含了化学反应速率,化学平衡,平衡移动,化学平衡常数,气体体积缩小的方向,气体体积增大的方向,增大压强,50MPa,升高温度,降低温度等内容,欢迎下载使用。









