





高中化学人教版 (新课标)必修1第二节 化学计量在实验中的应用课文内容课件ppt
展开你一口气能喝多少克水?
你知不知道一口气喝下了多少个水分子?
一滴水中所含的水分子数,让全世界65亿人 去数,每人每分钟数100个,日夜不停的数,需要5千年才能数完。
想办法在水分子数和水的质量之间找到一个桥梁——集体单位。。
这个桥梁就是我们今天研究的:化学中常用的物理量-----物质的量
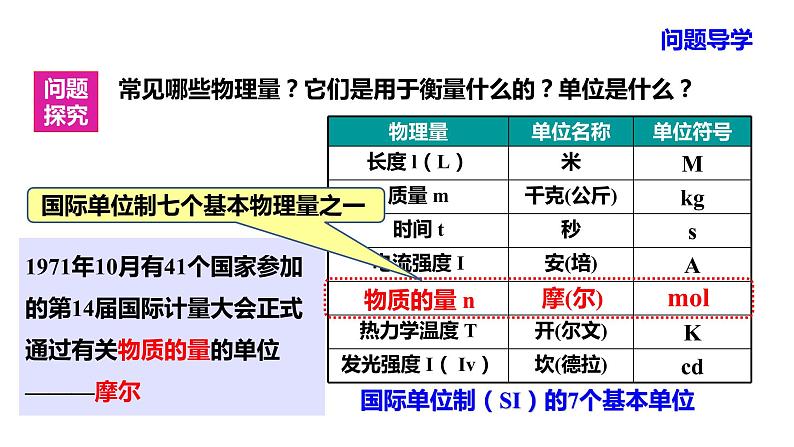
常见哪些物理量?它们是用于衡量什么的?单位是什么?
国际单位制(SI)的7个基本单位
1971年10月有41个国家参加的第14届国际计量大会正式通过有关物质的量的单位———摩尔
单位名称:_______ 符号:_____
1、是国际单位制中七个基本量中的一个,符号:____
2、定义:表示含有一定数目粒子的集合体
(长度、质量、时间、电流、热力学温度、物质的量、发光强度)
1打铅笔:1双袜子:1世纪:
1ml某种微粒是多少个呢?(如:1ml水分子有多少个水分子呢?)
已知1个12C原子质量1.993×10-26 kg,问 0.012 kg12C中有多少个碳原子?
≈ 6.02×1023
1 ml粒子集体所含的粒子数= 12g12C中所含的碳原子数 .
──────────
1.993×10-26 kg
假设每粒小麦的质量0.02g,那么1ml麦粒的质量是多少?
0.02×6.02×1023=1.204×1022g=1.204×1016 (吨)
3、计量对象:原子、分子、离子、质子、中子和电子等微观粒子
3、具体化:用摩尔为单位表示某物质的物质的量时,必须指明物质微粒的名称、符号或化学式。如:1 ml H、1 ml H+、 1 ml H2 ,不能用 “1 ml 氢”这样含糊无意义的表示。
1、专有化:“物质的量”是一个物理量的全称,是一个专有名词;物质的量不能当成物质的数量或质量来理解。
2、微观化:摩尔只能描述原子、分子、离子、质子、中子和电子等微观粒子,不能描述宏观物质。
4、 集体化:物质的量的数值可以是整数,也可以是小数。
关于物质的量的几点重要说明
(1)摩尔是七个物理量之一。(2)物质的量就是物质的质量。 (3)1摩尔美女。(4)1ml氢
物质的量是七个基本物理量之一
物质的量和质量都是基本物理量,二者不能混淆!
物质的量只适用于微观粒子,不能用来说明宏观物质
没有指出是分子、原子或离子
1、判断正误:下面叙述是否正确?原因?
①1ml沙子 ( )②1ml氧 ( )③1mlH2O ( )④1mlOH- ( ) ⑤1mlFe ( )
生平简介 意大利物理学家。1776年8月9日生于都灵市一个律师家庭,1856年7月9日卒于都灵市。1792年进都灵大学法律系学习,取得法学博士学位后,曾开业当律师。1800年弃法从理,十分勤奋,1820年被聘任都灵大学理科教授,都灵科学院院士,还担任过意大利教育委员和度量衡学会会长。
同学们,知道是谁确定的1ml的标准的吗?
知识三、阿伏伽德罗常数
1、定义:1ml任何粒子的粒子数称之为阿伏加德罗常数。
NA 6.02×1023 ml-1
联系: π = 3.14 ???
科学上把0.012 kg12C所含原子数(约为6.02×1023)作为衡量微粒的集合体
1ml任何粒子的粒子数
0.012Kg12C中所含原子数
(NA)单位:ml-1
3、n、N、NA 关系
3、填空①1mlH2SO4中含有———个硫酸分子,约含有__________个硫酸分子②2mlH2O中含有水分子———————————— 个③0.5mlO2中含有氧分子————————————个④1mlC2H5OH中含有———个酒精分子,—————个氢原子,——个氧原子
N = n × NA
4、0.5mlCH4约含有_________个甲烷分子,约含有_________个氢原子,所含原子总数约为____________个
1.505 ×1024
1ml物质的质量到底是多少?
1ml任何微粒的质量以克为单位时,在数值上等于该微粒的相对原子质量或相对分子质量。
原来科学家在确定阿伏加德罗常数时就动了脑筋:NA 定为0.012Kg12C所含的碳原子数目
符号: M 单位:g· ml-1 或 kg· ml-1
1、概念:单位物质的量的物质所具有的质量。
2、数值:等于该物质的式量或相对原子质量
m = M × n
g g/ml ml
1ml O2的质量是( ) O2的摩尔质量是( ) O2的相对分子质量是( )
1、填空:H2SO4的摩尔质量为 、
1mlH2SO4的质量是: 、
1mlH2SO4的相对分子质量是: 、
相对原子质量相对分子质量
2、1mlH2O的质量_____
3mlH2O的质量_____
2mlH2O的质量_____
nmlH2O的质量____
H2O的摩尔质量18g·ml-1
物质的量的意义:把微观粒子和宏观物质联系起来的一座桥梁
÷(6.02×1023)
× 6.02×1023
单位:摩尔,简称摩,符号为 ml
描述对象:分子、原子、质子等微观粒子,不能用于宏观颗粒
表示微观粒子个数多少的物理量,是国际单位制基本物理量之一
NA近似值:6.02×1023ml-1
1ml任何粒子集体含有NA个粒子;
三.摩尔质量:单位物质的量的物质所具有的质量。
数值上等于其相对分子质量(式量)
化学必修1第二节 化学计量在实验中的应用示范课课件ppt: 这是一份化学必修1第二节 化学计量在实验中的应用示范课课件ppt,共17页。PPT课件主要包含了mol,对比宏观,问题微观,物质的量等内容,欢迎下载使用。
化学必修 第一册第三节 物质的量课前预习ppt课件: 这是一份化学必修 第一册第三节 物质的量课前预习ppt课件,共27页。PPT课件主要包含了物质质量,粒子数目,符号n,物质的量,资料卡片,国际单位制SI,×小麦不是微观粒子,×摩尔不是物理量,阿伏伽德罗常数,符号NA等内容,欢迎下载使用。
人教版 (新课标)必修1第一章 从实验学化学第二节 化学计量在实验中的应用背景图ppt课件: 这是一份人教版 (新课标)必修1第一章 从实验学化学第二节 化学计量在实验中的应用背景图ppt课件,共16页。













