

2021届新高考化学模拟培优卷(七)(重庆专版)
展开
2021届新高考化学模拟培优卷(七)(重庆专版)
可能用到的相对分子质量:H-1 C-12 P-31 O-32 Fe-56 Cu-64 Zn-65 Sn-119
一、选择题:本题共14小题,每小题3分,共42分。每小题只有一个选项符合题目要求。
1.下列有关物质的性质与用途具有对应关系的是( )
A.浓硫酸具有脱水性,可用作干燥剂
B.硫酸铁易溶于水,可用作净水剂
C.难溶于水,可用作耐高温材料
D.铅具有还原性和导电性,可用作铅蓄电池的负极材料
2.下列表示正确的是( )
A.乙酸乙酯的实验式:
B.甲基的电子式:
C.的结构示意图:
D.HCl分子的球棍模型:
3.设为阿伏加德罗常数的值,下列说法正确的是( )
A.常温常压下,1 mol 溶于1.0 L中,溶液中的个数之和为2
B.标准状况下,11.2 L与11.2 L HF均含有5个质子
C.56.0 g Fe与1.0 mol 反应,转移电子数为2
D.46.0 g完全燃烧,有5个CH键断裂
4.下列实验设计能达到实验目的的是( )
选项 | 实验目的 | 实验设计 |
A | 制备晶体 | 将饱和溶液蒸干 |
B | 证明溶液中含有 | 向溶液中依次滴加新制氯水和KSCN溶液 |
C | 比较Al和熔点的高低 | 将铝箔在酒精灯上加热至熔化,轻轻晃动 |
D | 验证具有漂白性 | 将通入滴有酚酞的NaOH溶液中,红色褪去 |
A.A B.B C.C D.D
5.下列离子方程式正确的是( )
A.制作印刷电路板原理:
B.向NaClO溶液中滴入少量溶液:
C.已知等浓度的碳酸钠、次氯酸钠、碳酸氢钠溶液pH逐渐减小,向次氯酸钠溶液中通入少量:
D.海水提溴过程中,用足量碳酸钠溶液吸收溴,发生歧化反应生成:
6.分属周期表前三周期的四种元素W、X、Y、Z可形成结构如下的物质,该物质中所有原子均满足稳定结构,W的原子序数最大,Y、Z处于同一周期。下列说法错误的是( )
A.X、Z可形成具有强氧化性的高效消毒剂
B.Y的最高价氧化物对应的水化物中,除了氢原子外所有原子满足8电子稳定结构
C.由Z和W形成的化合物中可以存在共价键
D.X、Y、Z的原子半径从大到小为: Y > Z >X
7.安全是顺利进行实验及避免伤害的保障。下列实验操作正确且不是从实验安全角度考虑的是( )
A.操作①:使用稍浸入液面下的倒扣漏斗检验氢气的纯度
B.操作②:使用CCl4萃取溴水中的溴时,振荡后需打开活塞使漏斗内气体放出
C.操作③:吸收氨气或氯化氢气体并防止倒吸
D.操作④:用食指顶住瓶塞,另一只手托住瓶底,把瓶倒立,检查容量瓶是否漏水
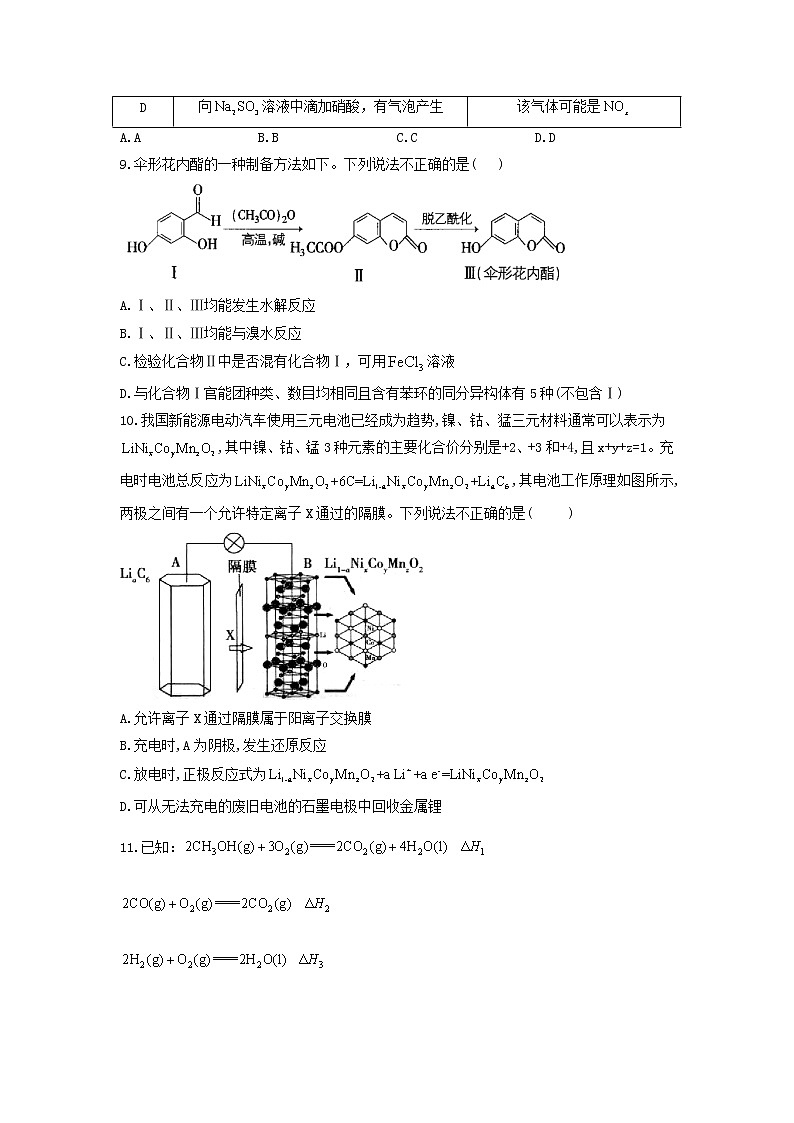
8.根据下列实验操作和现象,所得结论或推论正确的是( )
选项 | 实验操作 | 实验结论或推论 |
A | 向饱和溶液中滴加几滴硼酸,无气泡产生 | 酸性:硼酸>碳酸 |
B | 用pH试纸测得:溶液的pH约为9,溶液的pH约为8 | |
C | 用标准溶液滴定溶液里的,以为指示剂 | |
D | 向溶液中滴加硝酸,有气泡产生 | 该气体可能是 |
A.A B.B C.C D.D
9.伞形花内酯的一种制备方法如下。下列说法不正确的是( )
A.Ⅰ、Ⅱ、Ⅲ均能发生水解反应
B.Ⅰ、Ⅱ、Ⅲ均能与溴水反应
C.检验化合物Ⅱ中是否混有化合物Ⅰ,可用溶液
D.与化合物Ⅰ官能团种类、数目均相同且含有苯环的同分异构体有5种(不包含Ⅰ)
10.我国新能源电动汽车使用三元电池已经成为趋势,镍、钴、猛三元材料通常可以表示为,其中镍、钴、锰3种元素的主要化合价分别是+2、+3和+4,且x+y+z=1。充电时电池总反应为,其电池工作原理如图所示,两极之间有一个允许特定离子X通过的隔膜。下列说法不正确的是( )
A.允许离子X通过隔膜属于阳离子交换膜
B.充电时,A为阴极,发生还原反应
C.放电时,正极反应式为
D.可从无法充电的废旧电池的石墨电极中回收金属锂
11.已知:
下列关于上述反应焓变的判断正确的是( )
A.
B.
C.
D.
12.用高分子吸附树脂提取卤水中的碘(主要以形式存在)的工艺流程如下:
下列说法不正确的是( )
A.经①和④所得溶液中,后者大于前者
B.④的作用是将吸附的碘还原而脱离高分子树脂
C.若②和⑤中分别得到等量,则消耗的
D.由⑥得到碘产品的过程,主要发生的是物理变化
13.化学上常用AG表示溶液中的。25℃时,用0.100的NaOH溶液液滴定20.0 mL 0.100的溶液,AG与 (所加NaOH溶液的体积)的关系如图所示,下列说法错误的是( )
A.25℃时,的电离常数
B.点时,
C.点时,加入NaOH溶液的体积为20 mL
D.点时,溶液中的数量级为
14.由羟基丁酸生成丁内酯的反应为。在298 K下,羟丁酸水溶液的初始浓度为0.180,测得丁内酯的浓度随时间变化的数据如图所示:
则下列说法不正确的是( )
A.该反应在50~80 min内的平均反应速率为
B.120 min时羟基丁酸的转化率为50%
C.298 K时该反应的平衡常数
D.为提高羟基丁酸的转化率,除适当控制反应温度外,还可采用的措施是及时分离出产物丁内酯
二、非选择题:共58分。第15~17题为必考题,每个试题考生都必须作答。第18~19题为选考题,考生根据要求作答。
(一)必考题;共43分。
15.(14分)某小组拟从某种废弃含锌有机催化剂(杂质主要为含有Co的有机络合物,还含少量Fe、Mn等金属的氧化物)中提取金属锌,设计的实验流程如下:
回答下列问题:
(1)若在实验室中灼烧该有机催化剂,需要的硅酸盐仪器有酒精灯、_______________、泥三角等。
(2)写出用硫酸酸浸过程中含锌物质发生的反应的离子方程式_______________;该过程中不能用盐酸代替硫酸进行酸浸,理由是_______________。
(3)过滤I得到的滤液中含有和,加入适量溶液充分搅拌,将和分别氧化成 CoOOH、和,写出溶液和反应的离子方程式_______________。若常温下,过滤Ⅱ后浓度为,则的溶度积_______________。
(4)调节溶液pH时,pH不能太大,理由是_______________。
(5)将含锌化合物X[可表示为]洗涤、干燥,取37.7g充分灼烧,所得气体依次通过装置甲(装有足量浓硫酸的洗气瓶)、装置乙(装有足量碱石灰的干燥管)。装置甲增重9.0g,装置乙增重4.4g,则_______________。
16.(15分)亚硝酰氯(NOCl)是一种黄色气体或红褐色液体,熔点-64.5℃,沸点-5.5℃,具有刺鼻恶臭味,遇水易水解生成与氯化氢。常温常压下,在实验室可用和NO合成NOCl,相关实验装置图(夹持装置略去)如下。已知不稳定,易分解,既有氧化性又有还原性;是微溶于水的白色固体,能溶于硝酸()
(1)制备
①制备的发生装置可以选)______________________(填大写字母),反应的离子方程式为______________________。
②欲收集干燥纯净的,则装置F的作用是______________________。
(2)合成NOCl
①仪器m的名称为_________________。
②实验中用NaOH溶液进行尾气处理,无水的作用是_________________。
③尾气处理时,有同学认为尾气中的某种气体不能完全被吸收。为了充分吸收尾气,可将尾气与_________________(填化学式)同时通入NaOH溶液中。
(3)NOCl与水反应生成与氯化氢。
①要验证反应后的溶液中存在,合理的实验操作步骤及现象是_________________。②设计实验证明是弱酸_________________。
(仅提供盐酸、溶液饱和溶液红色石蕊试纸、蓝色石蕊试纸)。
17.(14分)工业上以与为原料合成尿素,主要反应如下:
①
②
(1)反应的=______________。
(2)在恒温恒容的密闭容器中,下列条件中可以判断反应已经达到平衡状态的是__________。
a.
b.混合气体的平均相对分子质量不再变化
c.单位时间内生成的同时,消耗
d.混合气体的密度不再改变
(3)在固定体积的密闭容器中,使用某种崔化剂,改变原料气配比进行多组实验(各组实验的温度可能相同,也可能不同)测得的平衡转化率如图所示:
①如果要将图中X点对应的平衡状态改变为Y点对应的平衡状态,则应采取的措施是__________。
②Z点对应实验中,的起始浓度为,经过5min后达到平衡状态,则该时段平均反应速率__________。该条件下化学平衡常数__________(保留2位小数)。
③图中Y、Z两点对应的实验温度分别为和,且实验开始时的起始浓度均为,则__________(填“>”“=”或“<”)。
(4)最近我国科学家利用电化学原理处理废水中的尿素,原理示意图如下
①Pd/CFC极为__________(填“正”或“负”)极。
②Ni-Co/Ni极发生的电极反应式为__________。
(二)选考题:共15分。请考生从第18题和第19题中任选一题作答,如果多做,则按所做的第一题计分。
18.(15分)磷元素的化合物在科学研究和工业生产中有许多重要用途。回答下列问题:
(1)下列状态的P中,电离最外层一个电子所需能量最小的是__________(填标号)。
A. B.
C. D.
(2)白磷在空气中缓慢氧化生成,的结构如图1所示。中氧原子的杂化轨道类型为__________,每个分子中含孤电子对的数目为__________。
(3)磷化硼是一种耐磨涂料,它可用作金属的表面保护层。磷化硼晶体晶胞如图2所示。
①在一个晶胞中磷原子空间堆积方式为__________,磷原子的配位数为__________。
②磷化硼晶胞沿着体对角线方向的投影如图3,请将表示B原子位置的圆圈涂黑。
(4)磷化铜()用于制造磷青铜磷青铜是含少量锡、磷的铜合金。磷化铜与水反应产生有毒的磷化氢()气体,分子的空间构型为__________。
(5)磷青铜晶体的晶胞结构如图4所示,该晶体中P原子位于由铜原子形成的__________的空隙中。若晶体密度为,P原子与最近的Cu原子的核间距为__________nm(用含的代数式表示,为阿伏加德罗常数的值)。
19.(15分)磷酸氯喹是一种抗疟药,在细胞水平上能有效抑制新型冠状病毒的感染,查阅文献发现,G()是一种合成磷酸氯喹的医药中间体,它的合成路线如下:
已知:①是氯化杂环的常用试剂,P在反应前后化合价无变化;
②脱羧反应是羧酸分子脱去羧基(—COOH)放出二氧化碳的反应;
③苯胺和甲基吡啶(如)互为芳香同分异构体。
回答下列问题:
(1)化合物A的名称是______________,D中含氧官能团的名称为______________。
(2)E的结构简式为______________。
(3)F→G的反应方程式为______________。
(4)某有机物的分子式为,具有芳香化合物特征,核磁共振氢谱显示有3种不同化学环境的氢,该有机物的结构有______________种,请写出其中的2种______________。
(5)参照上述流图写出以为原料制备的合成路线图(其他试剂任选)______________。
答案以及解析
1.答案:D
解析:浓硫酸用作干燥剂,表现的性质是吸水性,A错误;硫酸铁水解形成氢氧化铁胶体,可用作净水剂,性质与用途不对应,B错误;的熔点很高,因此可用作耐高温材料,C错误;原电池中,负极失电子发生氧化反应,同时需要电极材料能够导电,而铅是金属,能导电,反应中易失去电子,具有还原性,D正确。
2.答案:A
解析:乙酸乙酯的分子式为,实验式为,A正确;甲基的电子式为,B错误;的结构示意图为,C错误;为HCl的比例模型,D错误。
3.答案:C
解析:的反应属于可逆反应,所得混合物中还含有,A错误;标准状况下HF不是气体,B错误;56.0 g Fe与1.0 mol 反应时,铁过量,转移电子数取决于溴,则反应转移电子数为2,C正确;有乙醇和甲醚两种不同结构,若为纯净的乙醇,则含有CH键的数目为5,正确,若为甲醚,则含有CH键的数目为6,D错误。
4.答案:C
解析:将饱和溶液蒸干,受热分解生成和HCl,不能得到晶体,A项错误;证明溶液中含有,应先滴加KSCN溶液,无明显现象,再滴加新制氯水溶液变血红色,B项错误;将铝箔在酒精灯上加热至熔化,轻轻晃动不滴落,说明A熔化但表面的膜没有熔化,从而可以判断氧化铝的熔点高于铝的熔点,C项正确;将通入滴有酚酞的NaOH溶液中,红色褪去的原因是和NaOH溶液反应溶液碱性减弱,体现酸性氧化物的性质,D项错误。
5.答案:D
解析:本题考查离子方程式的正误判断。A项,用溶液刻制印刷电路板,离子方程式为,错误;B项,NaClO为强碱弱酸盐,水溶液呈碱性,离子方程式反应物中不能出现,错误;C项,等浓度的碳酸钠、次氯酸钠碳酸氢钠溶液的pH逐渐减小,则溶液碱性逐渐减弱,的酸性逐渐增强,向次氯酸钠溶液中通入少量,根据较强酸制较弱酸原理,反应的离子方程式为,错误;D项,该反应中发生歧化反应,根据得失电子守恒、电荷守恒及原子守恒,反应的离子方程式为,正确。
6.答案:B
解析:W、X、Y、Z分属周期表前三周期的四种元素,可形成结构如图的物质,该物质中所有原子均满足稳定结构,W的原子序数最大,则W为Na元素,Y、Z处于同一周期,且X、 Y、Z组成的阴离子带有2个负电荷,根据价键理论:Y为B元素,Z为O元素,X为H元素,由此分析解答。根据上述分析,H元素和O元素可形成双氧水,具有强氧化性,A正确;Y的最高价氧化物对应的水化物为,氧原子满足8电子稳定结构,硼原子不满足8电子稳定结构,B错误;根据上述分析,Z为O元素,W为Na元素,由Z和W形成的化合物中既有离子键又有共价键,C正确;根据上述分析,Y为B元素,Z为O元素,X为H元素,X、Y、Z的原子半径从大到小的顺序为Y>Z>X,D正确。
7.答案:D
解析:A、由于连通氢气发生装置的导管在液面以下,所以可以防止点燃不纯氢气时发生爆炸,正确;B、打开活塞使漏斗内气体放出以防止分液漏斗内压强过大引起危险,正确;C、水层在下层不能防止倒吸,操作不正确,错误;D、检查容量瓶是否漏水操作正确,但不是从实验安全角度考虑的,错误,答案选D。
8.答案:D
解析:A项,根据强酸制弱酸的原理,如果硼酸的酸性比碳酸强会生成二氧化碳气体,反应没有气体生成,所以酸性:碳酸>硼酸,错误;B项,没有给出二者初始浓度,无法比较,错误;C项,以标准溶液滴定溶液中的,利用与生成砖红色沉淀,但由于溶液中浓度远大于浓度,故无法比较,和的大小;错误;D项,向溶液中滴加硝酸,亚硫酸钠有还原性,硝酸有强氧化性,二者反应生成硫酸钠、一氧化氮气体和水,正确。
9.答案:A
解析:化合物Ⅰ不含能水解的官能团,不能发生水解反应, A错误;Ⅰ中含有酚羟基,Ⅱ中含有碳碳双键,Ⅲ中含有酚羟基和碳碳双键,Ⅰ、Ⅱ、Ⅲ均能与溴水反应, B正确;Ⅰ中含有酚羟基,Ⅱ中不含酚羟基,则可用溶液检验Ⅱ中是否混有Ⅰ,C正确;符合条件的Ⅰ的同分异构体:(→为CHO插入的位置),除去Ⅰ,共5种,D正确。
10.答案:D
解析:根据充电时电池总反应知,放电时负极反应式为,正极反应式为,将放电时负极、正极反应式左右颠倒,即分别得到充电时阴极、阳极反应式。放电时,A是负极、B是正极,Li+向正极移动,则X是Li+,允许阳离子通过的隔膜为阳离子交换膜,A项正确;充电时,A是阴极,发生还原反应,B项正确;由上述分析可知,C项正确;根据充电时电池总反应知,充电时石墨电极发生C→LiaC6的反应,无法充电的废旧电池的石墨电极中不含有锂元素,不能回收金属锂,D项错误。
11.答案:D
解析:本题考查反应热的大小比较、盖斯定律的应用。甲醇和CO的燃烧均是放热反应,均小于0,A错误;液态水的能量低于气态水的能量,因此氢气完全燃烧生成液态水放热多,则,B错误;已知,,则两式相加得,该反应一定是放热反应,,C错误;已知①,②,③,则①+②×2-③×2,即得到反应: ,根据盖斯定律可知,,D正确。
12.答案:C
解析:分析流程图可知,②向卤水中加入硫酸酸化后通入氯气,氯气可将碘离子氧化为碘单质:,③高分子树脂吸附,④,⑤,⑥碘单质易升华,采用升华的方法提纯,得到碘产品。A项,由前面分析可知经①和④所得溶液中,后者大于前者正确;B项,④发生反应:,作用是将吸附的碘还原脱离高分子树脂,正确;C项,得2mol电子,得6mol电子,若②和⑤中分别得到等量,据电子守恒则消耗,错误;D项,升华为固态物质直接变为气态,属于物理变化,正确。
13.答案:C
解析:本题考查溶液中微粒浓度关系。25℃时,点溶液中,,则,,,,则的电离常数,抑制水的电离,可认为溶液中的全由电离得到,则,A正确;点时加入NaOH溶液的体积为10 mL,溶液为等浓度的的混合溶液,电荷守恒式为,物料守恒式为,两式联立,得,B正确;加入NaOH溶液体积为20 mL时, NaOH与恰好完全反应生成,溶液呈碱性,而点溶液的,即。溶液呈中性,故加入NaOH溶液的体积小于20 mL,C错误;点时,则,结合25℃时 可求,数量级为, D正确。
14.答案:C
解析:本题考查化学反应速率和化学平衡。由图像可知5080 min内丁内酯的浓度由0.05变为0.071,所以,A正确;120 min时丁内酯的浓度为0.09,由题中反应方程式可知羟基丁酸消耗了0.09,所以其转化率为,B正确;达到平衡时丁内酯的浓度为0.132,即反应生成了0.132丁内酯,可求得平衡时羟基丁酸的浓度为,则该反应的化学平衡常数,C错误;提高羟基丁酸的转化率,就是使平衡正向移动,及时分离出产物丁内酯可使平衡正向移动,D正确。
15.答案:(1)坩埚、玻璃棒(2分)
(2)(2分)盐酸可被氧化成有毒气体(2分)
(3)(2分)(2分)
(4)避免发生水解(2分)
(5)1:2:3(2分)
解析:(1)若在实验室中灼烧该有机催化剂,需要的硅酸盐仪器有酒精灯、坩埚、玻璃棒、泥三角等。
(2)灼烧后锌元素转变为ZnO,用硫酸酸浸过程中含锌物质(ZnO)发生的反应的离子方程式为。酸浸之后过滤Ⅰ得到的滤液要经过强氧化剂的氧化,盐酸很容易被氧化成有毒气体,故酸浸过程中不能用盐酸。
(3)溶液将氧化成,其反应的离子方程式为。若常温下过滤Ⅱ后浓度为,滤液的pH=4,,,则该条件下的溶度积。
(4)调节pH时,溶液pH不能太大,理由是避免锌离子发生水解。
(5)灼烧反应灼烧的化学方程式为,装置甲、乙分别吸收,则,,故,因此,,,故。
16.答案:(1)①A(2分)[或B;,或其他合理答案](2分)
②除去中混有的HCl(2分)
(2)①三颈烧瓶(或三口烧瓶)(1分)②防止尾气处理装置中的水蒸气进入m中,避免NOCl与水反应(2分)③(2分)
(3)①取反应后所得溶液少许于试管中,滴加足量溶液,有白色沉淀生成,再滴加稀硝酸,搅拌,仍有白色沉淀,过滤,在滤液中滴加酸性高锰酸钾溶液,若溶液的紫红色褪去,则有存在(2分)②用玻璃棒蘸取饱和溶液,点在红色石蕊试纸上,试纸变蓝,说明是弱酸(2分)
解析:(1)①装置A、B都可以作为实验室制备的反应装置,装置A需要加热,选用和浓盐酸反应制备氯气,离子方程式为,装置B不需要加热,选用高锰酸钾和浓盐酸反应制备氯气,离子方程式为。②制备并收集干燥的氯气时,各装置的接口顺序为a→f→g→c→b→d→e→j→h,其中装置F中盛装饱和食盐水,其作用是除去中混有的HCl。
(2)②尾气处理时将尾气(NO、)通入NaOH溶液中,故无水的作用是防止尾气处理装置中的水蒸气进入m中,避免NOCl与水反应。③与NaOH溶液可以反应,而NO不能与NaOH溶液反应,故需要同时通入, NO、与NaOH溶液才可以反应,以达到消除污染的目的。
(3)①根据题给的信息,要验证溶液中存在,需要从两个方面考虑,一是加入溶液后能生成白色沉淀,再加入稀硝酸,仍有白色沉淀(AgCl),二是过滤后所得的滤液具有还原性。②要证明是弱酸,可证明中存在电离平衡或证明能发生水解,根据题目提供的试剂,应证明饱和溶液呈碱性,故设计的实验方案为用玻璃棒蘸取饱和溶液点在红色石蕊试纸中央,若试纸变蓝,说明是弱酸。
17.答案:(1)-86.98(1分)
(2)bd(2分)
(3)①降低温度(或同比增大和的浓度)(2分)②0.24(2分)0.59(2分)③>(2分)
(4)①正(1分)②(2分)
解析: (1)根据盖斯定律,由①+②可得。
(2),不能说明反应达到平衡状态,a项错误;混合气体的平均相对分子质量不再变化,则对该反应而言说明气体的总质量和总物质的量都不变,反应一定处于平衡状态,b项正确;单位时间内生成的同时,消耗,不能说明正逆反应速率相等,因此不能说明反应已处于平衡状态,c项错误;混合气体的密度不再改变,则说明气体的总质量不变,反应一定处于平衡状态,d项正确。
(3)①由题图可知,从X点对应的平衡状态变为Y点对应的平衡状态,不变,但增大,即
平衡右移,由于该反应为气体分子数减小的放热反应,所以采取的措施为同比增大和的浓度或降低温度。②Z点时,的平衡转化率为60%,建立三段式:
易得,。
③Y点时起始浓度,;Z点时起始浓度,,若温度相同则Y点时的转化率更大,要维持转化率相同,则Y应该向逆反应方向移动,温度应该更大,即。
(4)①该装置为原电池装置,电池工作时,阳离子移向正极, Pd/cFC极为正极。②由反应物和生成物及电荷守恒得Ni-Co/Ni极发生的电极反应式为。
18.答案:(1)A(1分)
(2)(1分)16(2分)
(3)①面心立方最密堆积(1分)4(2分)②或(2分)
(4)三角锥形(2分)
(5)正八面体(2分) (2分)
解析: (1)为基态磷原子的核外电子排布图,失去最外层一个电子所需的能量为第一电离能;为基态磷原子失去两个电子后的核外电子排布图,再失去最外层一个电子所需的能量为第三电离能;为基态磷原子失去三个电子后的核外电子排布图,再失去最外层一个电子所需的能量为第四电离能;第一电离能<第二电离能<第三电离能<第四电离能,故电离最外层一个电子所需能量最小的是A。
(2)从的结构中可以看出,每个O原子都形成2个P-O键,每个O原子还存在2个孤电子对,所以氧原子的杂化轨道类型为;每个分子中,每个P原子含1个孤电子对,每个O原子含2个孤电子对,含孤电子对的数目为1×4+2×6=16。
(3)①黑球为磷原子,根据晶胞结构分析,P原子为面心立方最密堆积,从上底面面心的P原子分析,周围等距且最近的B原子有4个。②根据晶胞结构分析,立方磷化硼晶胞沿着体对角线方向投影可以形成一个六边形,中心B与P重合,六边形中形成两个倒立关系的正三角形,分别由3个B原子(分别与3个P原子重合)或者3个P原子形成,所以画图为:或。
(4)N、P为同主族元素,和的空间构型相同,为三角锥形,则也为三角锥形。
(5)观察磷青铜晶体的晶胞结构,Cu原子位于正方体的六个面的中心位置,形成正八面体的结构,P原子位于正八面体的中心,P原子与最近的Cu原子之间的距离为棱长的,一个晶胞中,Sn原子个数为,Cu原子个数为,P原子个数为1,故磷青铜晶体的化学式为,摩尔质量为,1 mol的体积为,由个晶胞组成,一个晶胞的体积为,棱长=,P原子与最近的Cu原子的核间距为。
19.答案:(1)间氯苯胺(或3-氯苯胺)(2分)羟基、酯基(2分)
(2)(2分)
(3)(2分)
(4)5(2分)(写2种即可)(2分)
(5)(3分)
解析:(1)中两个官能团位于苯环的间位,氨基为主官能团,命名为间氯苯胺,D中含氧官能团的名称为羟基和酯基。
(2)由上述分析可知,E的结构简式为。
(3)F→G是取代反应,Cl原子取代杂环化合物的—OH,化学方程式为。
(4)该有机物的分子式比A的多了两个,由核磁共振氢谱信息,模仿A的结构可以写出3种,为,其中苯胺的结构又可以和甲基吡啶的结构变换,有2种,为。
2021届新高考化学模拟培优卷(四)(湖南专版): 这是一份2021届新高考化学模拟培优卷(四)(湖南专版),共21页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
2021届新高考化学模拟培优卷(五)(辽宁专版): 这是一份2021届新高考化学模拟培优卷(五)(辽宁专版),共19页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
2021届新高考化学模拟培优卷(二)(河北专版): 这是一份2021届新高考化学模拟培优卷(二)(河北专版),共22页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。












