





高中人教版 (新课标)第一节 弱电解质的电离课文配套课件ppt
展开(1)什么叫电解质?(2)什么叫非电解质?
在水溶液中或熔融状态时能够导电的化合物
在水溶液中和熔融状态都不能导电的化合物
下列物质中: ①NaOH溶液 ②NaCl ③盐酸 ④CO2 ⑤CaCO3 ⑥ Fe ⑦硫酸 ⑧乙醇 ⑨融熔CaCl2 ⑩Na2O
能导电的物质是: ;属于电解质的是: ;属于非电解质的是: ;
电解质与非电解质的对象都是化合物,溶于水或融熔状态是导电的条件。
电解质的种类:酸、碱、盐、金属氧化物、水、部分有机物
【学与问】酸、碱、盐都是电解质,在水中都能电离出离子,不同电解质的电离程度是否相同呢?
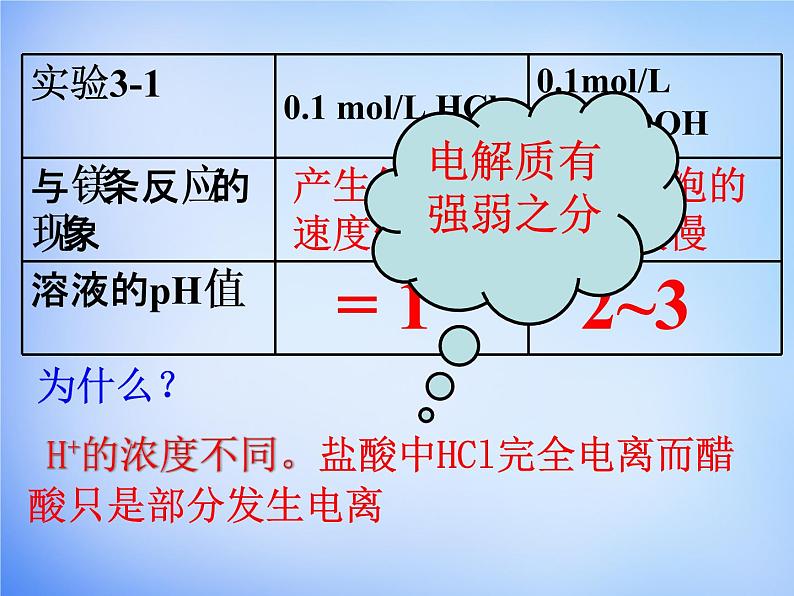
课本P40【实验3-1】
思考:如何判断醋酸、盐酸的酸性强弱?
1、同相浓度下,测试两种酸的pH值
2、同相浓度下,与等量的活泼金属反应
3、同相浓度下,与等量的碳酸钠反应
H+的浓度不同。盐酸中HCl完全电离而醋酸只是部分发生电离
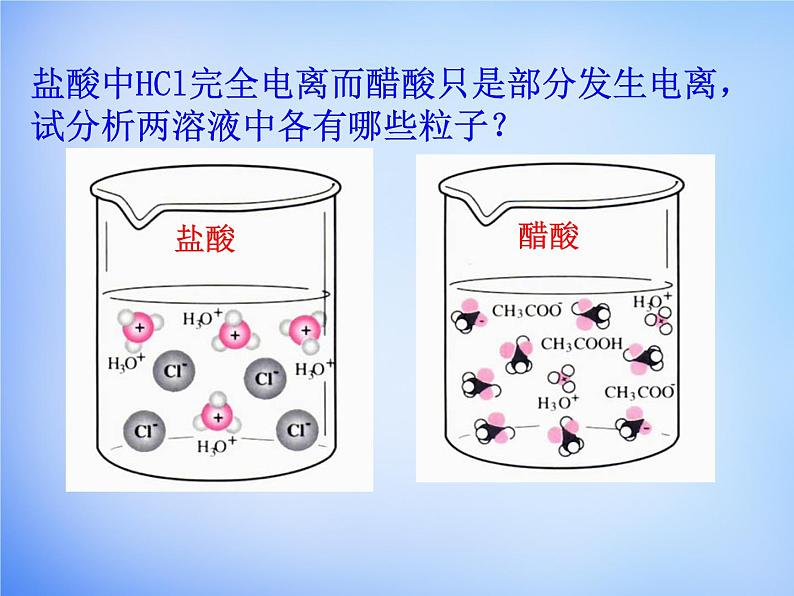
盐酸中HCl完全电离而醋酸只是部分发生电离,试分析两溶液中各有哪些粒子?
强电解质:在水溶液里全部电离成离子的电解质。如:强酸、强碱和大多数盐类。
弱电解质:在水溶液里只有一部分分子电离成离子的电解质。如 :弱酸、弱碱等。
1. 强弱电解质的概念
常见的弱电解质:①弱酸:HF、HClO、H2S、H2SO3、H3PO4、H2CO3 、 CH3COOH等。②弱碱:NH3·H2O、Fe(OH)3、Al(OH)3、Cu(OH)2等。 ③水是极弱的电解质。
常见的强电解质:①强酸:HCl、HBr、HI、H2SO4、HNO3、HClO4等。②强碱:NaOH、KOH、Ba(OH)2、Ca(OH)2等。③绝大多数盐:如NaCl、(NH4)2SO4、BaSO4等。
常见的强电解质和弱电解质
强电解质、弱电解质与其溶解性无关。如:某些难溶或微溶于水的盐,由于其溶解度很小,但是其溶于水的部分,却是完全电离的,所以它们仍然属于强电解质,例如:CaCO3、BaSO4等。
二、 电解质电离方程式的书写 (1)强电解质
——完全电离,书写时用“=”
小结电离方程式:强等号、弱可逆多元弱酸分步写多元弱碱一步完酸式盐看强弱、睇条件
【练习】写出下列电解质电离的方程式CH3COOH、H2S、 NaOH 、Cu(OH)2、K2CO3、KHCO3、KHSO4(水溶液中)、KHSO4(融熔状态)
强电解质与弱电解质的比较
所以,实际上在醋酸的水溶液中存在下面的可逆过程:
三、弱电解质的电离平衡
【思考2】为什么醋酸溶于水时只有部分分子电离成H+和CH3COO-呢?
电离平衡:在一定条件(如温度、浓度)下,当电解质分子电离成离子的速率和离子重新结合生成分子的速率相等时,电离过程就达到了平衡状态,这叫做电离平衡。
动 电离平衡是一种动态平衡
定 条件不变,溶液中各分子、离子 的浓度不变,溶液里既有离子又有分子
变 条件改变时,电离平衡发生移动
逆 弱电解质的电离是一个可逆过程
(1)与化学平衡一样,电离平衡也是动态平衡。
(2)化学平衡原理也适用于电离平衡,当浓度等条件改变时,弱电解质的电离平衡也会发生移动。
1)开始时,V电离 和 V分子化怎样变化?
画出弱电解质电离的V-t图像
2)当V电离 = V结合时,可逆过程达到一种什么样的 状态?
弱电解质电离的V-t图像
在一定条件(如温度、浓度)下, 当电解质分子电离成离子的速率和离子重新结合成分子的速率相等时,电离过程就达到了平衡状态 ——
定 溶液中各分子、离子的浓度不变
变 条件改变时,电离平衡发生移动。
逆 弱电解质的电离
例:在氨水中存在怎样的电离平衡?若向其中分别加入: ①适量的盐酸 ② NaOH溶液 ③ NH4Cl溶液 ④大量的水 ⑤加热 ⑥氨气 ⑦CuCl2溶液 对上述电离平衡有什么影响?
3.影响电离平衡的因素(1)温度 升温平衡向电离方向移动。(电离吸热)(2)浓度 弱电解质浓度越大,电离程度越小。(3)同离子效应 在弱电解质溶液中加入同弱电解质具有相同离 子的强电解质,使电离平衡向左移动(4)化学反应: 电离平衡向右移动
例:0.1ml/L的CH3COOH溶液中
1.弱电解质加水稀释时,电离程度_____,离子浓度______? (填变大、变小、不变或不能确定)
画出用水稀释冰醋酸时离子浓度随加水量的变化曲线。
1.将0 .1ml/L的氨水稀释10倍,随着氨水浓度的降低,下列数据逐渐增大的是( AC ) A.[H+] B. [OH]- C.[OH]- /[NH3·H2O] D.[NH4]+
2020-2021学年第一节 弱电解质的电离授课ppt课件: 这是一份2020-2021学年第一节 弱电解质的电离授课ppt课件,共29页。PPT课件主要包含了电解质,非电解质,强电解质,弱电解质,③④⑨,课堂练习,②③⑥⑦⑧⑨⑩,②③⑥⑧⑩,④酸式盐的电离,习题9等内容,欢迎下载使用。
高中化学人教版 (新课标)选修4 化学反应原理第一节 弱电解质的电离教学演示课件ppt: 这是一份高中化学人教版 (新课标)选修4 化学反应原理第一节 弱电解质的电离教学演示课件ppt,共9页。PPT课件主要包含了知识回顾,强弱电解质,只有水合离子,电离方程式用“”,共价化合物溶于水,纯净物,混合物,化合物,物质的分类,易溶强电解质等内容,欢迎下载使用。
高中化学人教版 (新课标)选修4 化学反应原理第一节 弱电解质的电离教学课件ppt: 这是一份高中化学人教版 (新课标)选修4 化学反应原理第一节 弱电解质的电离教学课件ppt,共29页。PPT课件主要包含了强电解质,弱电解质,③④⑨,课堂练习,②③⑥⑦⑧⑨⑩,②③⑥⑧⑩,④酸式盐的电离,习题9,习题10,P41思考与交流等内容,欢迎下载使用。













