






化学选修4 化学反应原理第一章 化学反应与能量第二节 燃烧热 能源评课课件ppt
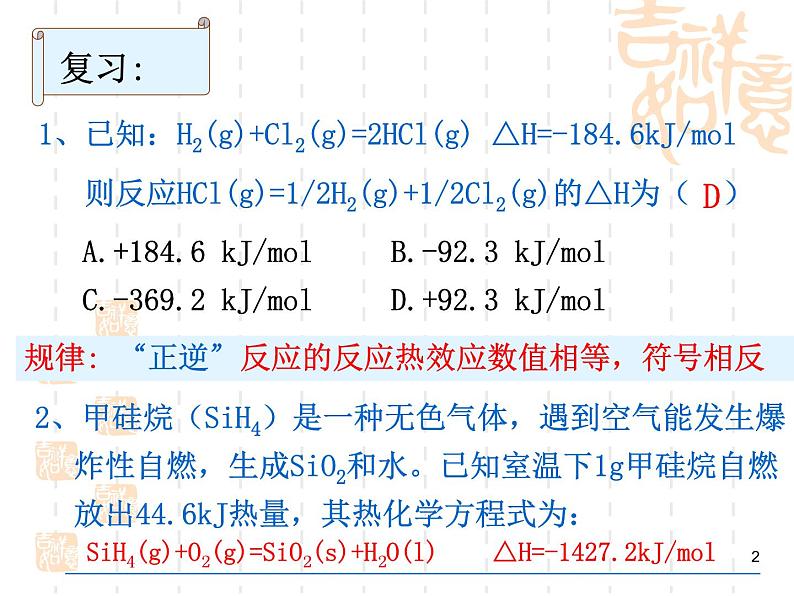
展开1、已知:H2(g)+Cl2(g)=2HCl(g) △H=-184.6kJ/ml 则反应HCl(g)=1/2H2(g)+1/2Cl2(g)的△H为( )
A.+184.6 kJ/ml B.-92.3 kJ/mlC.-369.2 kJ/ml D.+92.3 kJ/ml
2、甲硅烷(SiH4)是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和水。已知室温下1g甲硅烷自燃放出44.6kJ热量,其热化学方程式为: _____________________________________________
SiH4(g)+O2(g)=SiO2(s)+H2O(l) △H=-1427.2kJ/ml
规律: “正逆”反应的反应热效应数值相等,符号相反
3、已知H+(aq)+OH-(aq)=H2O(l) △H=-57.3kJ/ml,计算下列反应中放出的热量。(1)用20g NaOH 配成稀溶液跟足量稀盐酸反应,放出热量为 kJ。(2)用0.1mlBa(OH)2配成稀溶液跟足量稀硝酸反应,放出热量为 kJ。(3)用1ml醋酸稀溶液和足量NaOH溶液反应,放出的热量 (大于、小于、等于)57.3kJ,理 由是 。
醋酸是弱电解质,只是少部分电离,发生电离时要吸热,中和时放热较少
298K,101kPa时,合成氨反应的热化学方程式N2(g)+3H2(g)=2NH3(g) △H =- 92.38kJ/ml。 在该温度下,取1 ml N2(g)和3 ml H2(g)放在一密闭容器中,在催化剂存在下进行反应,测得反应放出的热量总是少于92.38kJ,其原因是什么?
该反应是可逆反应,在密闭容器中进行,该反应将达到平衡状态,1mlN2(g)和3mlH2(g)不能完全反应生成2 ml NH3(g),因而放出的热量总小于92.38kJ
H2(g)+1/2O2(g)==H2O(g) △H1=-241.8kJ/ml 那么,H2的燃烧热△H究竟是多少?如何计算? 已知: H2O(g)==H2O(l) △H2=-44kJ/ml H2(g)+1/2O2(g)==H2O(l) △H=△H1+△H2=-285.8kJ/ml
下列数据△H1表示燃烧热吗?
如何测出下列反应的反应热: C(s)+1/2O2(g)==CO(g) ΔH1=?
①C(s)+1/2O2(g)==CO(g) ΔH1=? ②CO(g)+1/2O2(g)== CO2(g) ΔH2=-283.0kJ/ml③C(s)+O2(g)==CO2(g) ΔH3=-393.5kJ/ml
不能很好的控制反应的程度,故不能直接通过实验测得△H1
① + ② = ③ , 则 ΔH1 + ΔH2 =ΔH3所以,ΔH1=ΔH3-ΔH2 =-393.5kJ/ml+283.0kJ/ml =-110.5kJ/ml
上两例应用了什么规律?
1、与温度、压强有关 2、与物质的状态有关3、与反应物的用量有关4、与反应条件(途径)无关 ——盖斯定律
不管化学反应是分一步完成 或分几步完成,其反应热是相同的。 化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。
请思考:由起点A到终点B有多少条途径?从不同途径由A点到B点的位移有什么关系?
登山的高度与上山的途径无关,只与起点和终点的相对高度有关
△H1 +△H2 ≡ 0
ΔH、ΔH1、ΔH2之间有何关系?
有些化学反应进行很慢或不易直接发生,很难直接测得这些反应的反应热,可通过盖斯定律获得它们的反应热数据。
关键与方法:把热化学方程式当数学方程式,满足数学方程式的一切运算法则,联立求解。
例1:已知下列各反应的焓变①Ca(s)+C(s,石墨)+3/2O2(g)=CaCO3(s) △H1 = -1206.8 kJ/ml②Ca(s)+1/2O2(g)=CaO(s) △H2= -635.1 kJ/ml③C(s,石墨)+O2(g)=CO2(g) △H3 = -393.5 kJ/ml试求④CaCO3(s)=CaO(s)+CO2(g)的焓变
△H4=+178.2kJ/ml
例2:按照盖斯定律,结合下述反应方程式回答问题,已知:①NH3(g)+HCl(g)=NH4Cl(s) △H1=-176kJ/ml②NH3(g)+H2O(l)=NH3(aq) △H2=-35.1kJ/ml③HCl(g) +H2O(l)=HCl(aq) △H3=-72.3kJ/ml④NH3(aq)+ HCl(aq)=NH4Cl(aq) △H4=-52.3kJ/ml⑤NH4Cl(s)+2H2O(l)= NH4Cl(aq) △H5=? 则第⑤个方程式中的反应热△H是________。根据盖斯定律和上述反应方程式得: ⑤=④+③+②-①, 即△H5 = +16.3kJ/ml
例3:写出石墨变成金刚石的热化学方程式 (25℃,101kPa时)
查燃烧热表知:①C(石墨,s)+O2(g)=CO2(g) △H1=-393.5kJ/ml②C(金刚石,s)+O2(g)=CO2(g) △H2=-395.0kJ/ml
所以, ①- ②得: C(石墨,s) = C(金刚石,s) △H=+1.5kJ/ml
例4:同素异形体相互转化但反应热相当小而且转化速率慢,有时还很不完全,测定反应热很困难。现在可根据盖斯提出的观点“不管化学反应是一步完成或分几步完成,这个总过程的热效应是相同的”。已知:
①P4(s、白磷)+5O2(g)=P4O10(s)△H1=-2983.2 kJ/ml
②P(s、红磷)+5/4O2(g)=1/4P4O10(s) △H2= -738.5 kJ/ml
试写出白磷转化为红磷的热化学方程式 。
P4(s、白磷)= 4P(s、红磷) △=-29.2kJ/ml
你知道神六的火箭燃料是什么吗?
例5:某次发射火箭,用N2H4(肼)在NO2中燃烧,生成N2、液态H2O。已知: ①N2(g)+2O2(g)==2NO2(g) △H1=+67.2kJ/ml ②N2H4(g)+O2(g)==N2(g)+2H2O(l) △H2=-534kJ/ml 假如都在相同状态下,请写出发射火箭反应的热化学方程式。
2 N2H4(g)+ 2NO2(g)= 3N2(g)+4H2O(l) △H=-1135.2kJ/ml
思考:为什么在热化学反应方程式中通常可不表明反应条件?
正逆反应的反应热效应数值相等,符号相反。“+”不能省去。
1.已知石墨的燃烧热:△H=-393.5kJ/ml(1)写出石墨的完全燃烧的热化学方程式(2)二氧化碳转化为石墨和氧气的热化学方程式
热化学方程式还可以表示理论可进行实际难进行的化学反应
①C(石墨,s)+O2(g)=CO2(g) △H =-393.5kJ/ml②CO2(g)=C(石墨,s)+O2(g) △H =+393.5kJ/ml
2.已知25℃、101kPa下,石墨、金刚石燃烧的热化学方程式分别为C(石墨)+O2(g)=CO2(g) △H=-393.51kJ·ml-1C(金刚石)+O2(g)=CO2(g) △ H=-395.41kJ·ml-1据此判断,下列说法中正确的是( )A、由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的低B、由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的高C、由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的低D、由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的高
3.已知① CO(g)+1/2O2(g)=CO2(g) ΔH1= -283.0 kJ/ml② H2(g)+1/2O2(g)=H2O(l) ΔH2= -285.8 kJ/ml ③C2H5OH(l)+ 3O2(g)=2CO2(g)+3H2O(l) ΔH3=-1370 kJ/ml 试计算④2CO(g)+4H2(g)=H2O(l)+C2H5OH(l)的ΔH
【解】:根据盖斯定律,反应④不论是一步完成还是分几步完成,其反应热效应都是相同的。下面就看看反应④能不能由①②③三个反应通过加减乘除组合而成,也就是说,看看反应④能不能分成①②③几步完成。①×2 + ②×4 - ③ = ④ 所以,ΔH=ΔH1×2 +ΔH2×4 -ΔH3 =-283.2×2 -285.8×4 +1370 =-339.2 kJ/ml
高中化学人教版 (2019)必修 第一册第一章 物质及其变化第二节 离子反应完整版课件ppt: 这是一份高中化学人教版 (2019)必修 第一册第一章 物质及其变化第二节 离子反应完整版课件ppt,共21页。PPT课件主要包含了学习目标,盖斯定律,方法一虚拟路径法,ΔH3,方法二加合法,加合法,课堂小结,课堂达标等内容,欢迎下载使用。
人教版 (2019)选择性必修1第二章 化学反应速率与化学平衡实验活动1 探究影响化学平衡移动的因素备课ppt课件: 这是一份人教版 (2019)选择性必修1第二章 化学反应速率与化学平衡实验活动1 探究影响化学平衡移动的因素备课ppt课件,共21页。PPT课件主要包含了①+②③,学习目标,图例说明等内容,欢迎下载使用。
2023届高中化学一轮复习微专题课件:盖斯定律在反应热计算中的应用: 这是一份2023届高中化学一轮复习微专题课件:盖斯定律在反应热计算中的应用,共17页。PPT课件主要包含了+2474,-116,+893,+10160等内容,欢迎下载使用。













