






初中化学人教版九年级下册第十一单元 盐 化肥课题1 生活中常见的盐课文内容课件ppt
展开原从水中来, 不敢水中行。 人人都要我, 无我食不成。打一物质
厨师放错盐工人进医院石家庄37人中毒
农户误用某工业盐造成8人食物中毒
亚硝酸钠是工业用盐,它是一种白色不透明晶体,形状很像食盐。亚硝酸盐不仅是致癌物质,而且摄入0.2~0.5 g即可引起食物中毒,3 g可致死。而亚硝酸盐是食品添加剂的一种,起着色、防腐作用,广泛用于熟肉类、灌肠类和罐头等动物性食品。现在世界各国仍允许用它来腌制肉类,但用量严加限制。
1.认识生活中常见的盐,知道氯化钠的用途和获取;2.知道碳酸钠、碳酸氢钠和碳酸钙的用途。
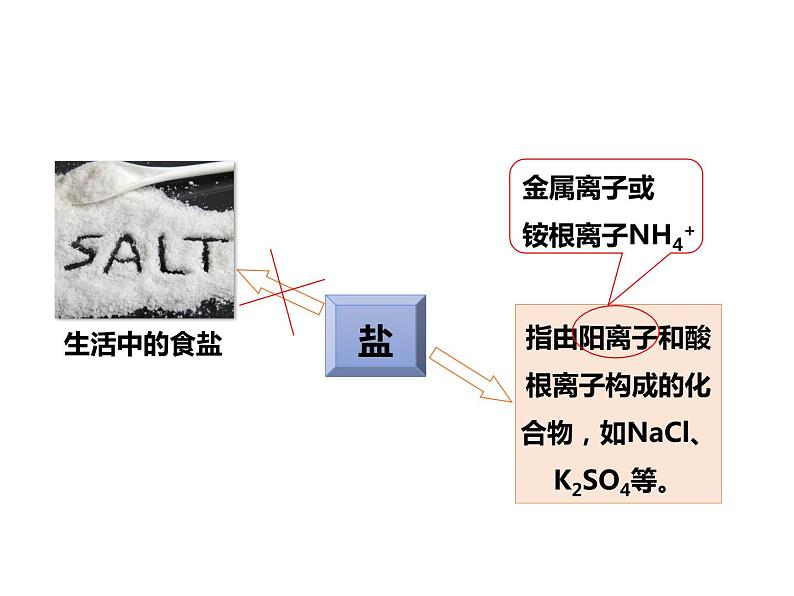
金属离子或铵根离子NH4+
常见的盐——氯化钠(1)俗称:食盐;(2)化学式:NaCl;(3)性状:白色晶体,易溶于水,有咸味,溶液呈中性;(4)主要来源:海水、盐湖、盐井、盐矿。
1)分布 : 氯化钠在自然界中的分布很广,除海水里含有大量的氯化钠外,盐湖、盐井和盐矿中也蕴藏着氯化钠。
2.氯化钠在自然界中的分布与获取
2)获取:通过晾晒海水或煮盐井水,盐湖水等,可以蒸发除去其水分,得到含有较多杂质的氯化钠晶体——粗盐。当有大量粗盐从海水、盐湖水等析出时,就会形成美丽的盐景。
海水“晒盐”等方法得到的是粗盐,含有可溶性和不溶性杂质。
粗盐提纯—去除粗盐中不溶性杂质
思考:上述过程中玻璃棒的用途分别是什么?
(1)俗名:纯碱、苏打;(2)化学式: Na2CO3;(3)纯碱不是碱,而是盐;(4)性状:白色晶体,风化成粉末,易溶于水,水溶液显碱性。
(1)俗名:小苏打;(2)化学式: NaHCO3;(3)性状:白色粉末,能溶于水,水溶液有 弱的碱性,较易分解。
3.碳酸钙
(1)大理石、石灰石主要成分;(2)化学式: CaCO3;(3)性状:多为灰白色矿物,纯净物为白色粉末;不溶于水,能溶于酸。
课题1 生活中常见的盐第2课时 盐的化学性质 复分解反应
【回顾】 请书写出实验室制取CO2的方程式。
CaCO3 + 2 HCl === CaCl2 + H2CO3
【讨论】 根据上述反应,请问Na2CO3和NaHCO3能否与稀盐酸反应?如果能反应,请问它们又会生成什么物质?
1.掌握盐的化学性质;2.知道复分解反应的概念、发生的条件和实质,能判断复分解反应是否能发生。
白色固体溶解,放出使澄清石灰水变浑浊的无色气体
碳酸钠(或碳酸氢钠)与盐酸反应生成了CO2气体
【实验11-1】碳酸钠、碳酸氢钠分别与盐酸反应,是否都能产生CO2 ?
Na2CO3 + 2HCl = 2NaCl +
请同学们写出上述反应的化学方程式:
H2O + CO2 ↑
NaHCO3 + HCl = NaCl +
H2O + CO2 ↑
综上所述:含有碳酸根离子(CO32-)或碳酸氢根离子(HCO3-)的盐都能与盐酸反应,产生CO2 气体。
(含碳酸根或碳酸氢根离子)
碳酸根或碳酸氢根离子检验方法:
【实验11-2】向盛有少量碳酸钠溶液的试管中滴入澄清石灰水,观察现象。现象:分析: Na2CO3 + Ca(OH)2 = CaCO3↓+ 2NaOH
碳酸钠与氢氧化钙反应,生成一种难溶物碳酸钙。
这个原理常用作两种碱之间的相互转化
(1)CaCO3 +2HCl==CaCl2 + H2CO3(2)Na2CO3 + 2HCl==2NaCl + H2CO3(3)NaHCO3 + HCl==NaCl + H2CO3(4)Na2CO3 + Ca(OH)2== 2NaOH + CaCO3↓
①观察:上述几个反应有什么特点? ②讨论:由此,你又有哪些新发现? ③归纳:复分解反应的概念、一般形式与特点。
思考:什么条件下复分解反应才能发生呢???
复分解反应:由两种化合物互相交换成分,生成另外两种化合物的反应。
根据所提供的四种溶液,设计实验证明溶液两两之间是否能发生反应。√表示反应,×表示不反应。
(1)BaCl2+H2SO4=(2)NaOH+H2SO4=(3)Na2CO3+H2SO4=
(4)BaCl2+ Na2CO3=(5)BaCl2+ NaOH =(6)Na2CO3 + NaOH =
BaCl2+H2SO4= BaSO4 +2HCl2NaOH+H2SO4= Na2SO4 + 2H2ONa2CO3+H2SO4= Na2SO4 + H2O + CO2 BaCl2+ Na2CO3= BaCO3 + 2NaClBaCl2+ NaOH =不反应Na2CO3 + NaOH =不反应
Na+、CO3 2 -
溶液中离子种类发生改变
2HCl+Na2CO3 ——
Na2SO4+ + H2O
复分解反应发生时的离子变化
K2SO4 + NaNO3
Na2SO4 + KNO3 ——
溶液中离子种类没发生改变
盐在水中的溶解性各不相同
钾盐、钠盐、铵盐、硝酸盐都可溶;盐酸盐只有氯化银不可溶;硫酸盐只有硫酸钡不可溶;碳酸盐只溶钾、钠、铵,剩下都不溶。
注意:AgCl、BaSO4既不溶于水,也不溶于稀硝酸。
判断下列复分解反应能否发生: H2SO4 + NaNO3—— Na2SO4 + BaCl2—— 2HNO3 + K2CO3—— KNO3 + NaOH——
BaSO4↓+ 2NaCl
2KNO3 + CO2↑+H2O
由两种或两种以上物质生成另一种物质的反应
由一种物质生成两种或两种以上其它物质的反应
由一种单质与一种化合物反应,生成另一种单质与另一种化合物的反应
由两种化合物互相交换成分生成另外两种化合物的反应
AB + C→A +BC
AB + CD→ AD+ BC
反应物为多种而生成物只有一种,即“多变一”
反应物只有一种而生成物有多种,即“一变多”
反应物与生成物都是两种,且都是单质和化合物
反应物和生成物都为化合物
化学基本反应类型的比较
我们已经学过,盐能与金属发生置换反应,如: Fe+CuSO4=Cu+FeSO4
今天学到了,盐能与酸发生复分解反应,如: Na2CO3+2HCl=2NaCl+CO2↑+H2O
盐能与碱发生复分解反应,如: Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
盐还能与盐发生复分解反应,如: Na2SO4+BaCl2=BaSO4↓+2NaCl
1.盐溶液的酸碱性不确定。(如NaCl溶液呈中性,Na2CO3溶液呈碱性,NH4Cl溶液呈酸性)
盐 + 金属 = 新盐 + 新金属
盐 + 酸 = 新盐 + 新酸
盐 + 碱 = 新盐 + 新碱
盐 + 盐 = 新盐 + 新盐
人教版九年级下册课题1 生活中常见的盐评课课件ppt: 这是一份人教版九年级下册课题1 生活中常见的盐评课课件ppt,文件包含课题1生活中常见的盐第1课时pptx、课题1生活中常见的盐第2课时pptx、课题1生活中常见的盐第3课时pptx、课题1生活中常见的盐第4课时pptx、碳酸氢钠与酸反应mp4、碳酸钠与酸mp4、碳酸钠与盐酸微观实质mp4、碳酸钠碳酸氢钠与酸反应mp4、碳酸钠碳酸氢钠与酸反应mp4、硝酸银与氯化钠微观实质mp4、碳酸氢钠与酸反应mp4、硝酸银分解氯化钠与硝酸银反应的方程式mp4、盐酸与氢氧化钠反应微观实质mp4、实验11-2碳酸钠与氢氧化钙的反应mp4、复分解反应的实质1mp4、113粗盐中难溶杂质的去除mp4、碳酸钠与酸mp4等17份课件配套教学资源,其中PPT共85页, 欢迎下载使用。
人教版九年级下册课题1 生活中常见的盐备课ppt课件: 这是一份人教版九年级下册课题1 生活中常见的盐备课ppt课件,共20页。PPT课件主要包含了课堂训练,几种常见离子的检验,①滴加硝酸钡现象,生成白色沉淀,②滴加稀硝酸现象,沉淀不溶解,①滴加硝酸银现象,复分解反应的概念,+CB等内容,欢迎下载使用。
九年级下册课题1 生活中常见的盐教案配套课件ppt: 这是一份九年级下册课题1 生活中常见的盐教案配套课件ppt,共21页。PPT课件主要包含了复分解反应的概念等内容,欢迎下载使用。













