

辽宁省名校联盟2021届高三3月联合考试化学试题(含解析)
展开可能用到的相对原子质量:H 1 O 16 Ca 40 C 59 I 127
一、选择题:本题共15小题,每小题3分,共45分。在每小题列出的四个选项中,只有一项符合题目要求。
1. 下列有关说法错误的是
A. “84消毒液”常用于公共场所消毒,其有效成分为次氯酸钙
B. 中药有效成分的提取常采用萃取的操作方法
C. 我国自主研发的C919大飞机,其外壳主要成分是硬铝合金
D. 医用防护服的核心材料是微孔聚四氟乙烯薄膜,其单体四氟乙烯中所有原子共平面
【答案】A
2. 与互为同分异构体的芳香族化合物有
A. 3种B. 4种
C. 5种D. 6种
【答案】C
3. 常温下,下列各组离子在指定溶液中可能大量共存的是
A. 的溶液中:、、、
B. 的溶液中:、、、
C. 使酚酞变红色的溶液:、、、
D. 由水电离的的溶液中:、、、
【答案】D
4. “暖冰”是科学家将水置于一个足够强的电场中,在时,水分子瞬间凝固形成的。用“暖冰”做了一个如图所示的实验,发现烧杯中酸性溶液褪色。若将烧杯中的溶液换成含有少量KSCN的溶液,溶液呈血红色。则下列说法正确的是
A. “暖冰”是由于在电场中水分子间更易形成氢键,因而可以得到的混合物
B. 时,水凝固形成的“暖冰"所发生的变化是化学变化
C. 该条件下燃烧的产物中可能含有一定量的
D. 烧杯中液体换为淀粉-KI溶液时,能产生蓝色沉淀
【答案】C
5. 厌氧氨化法(Anammx)是一种新型的氨氮去除技术,下列说法中正确的是
A. 中氮原子杂化轨道类型为
B. 1ml中含有键和键共4(设为阿伏加德罗常数的值)
C. 过程Ⅳ中,发生氧化反应
D. 该方法每处理1ml,需要0.5ml
【答案】B
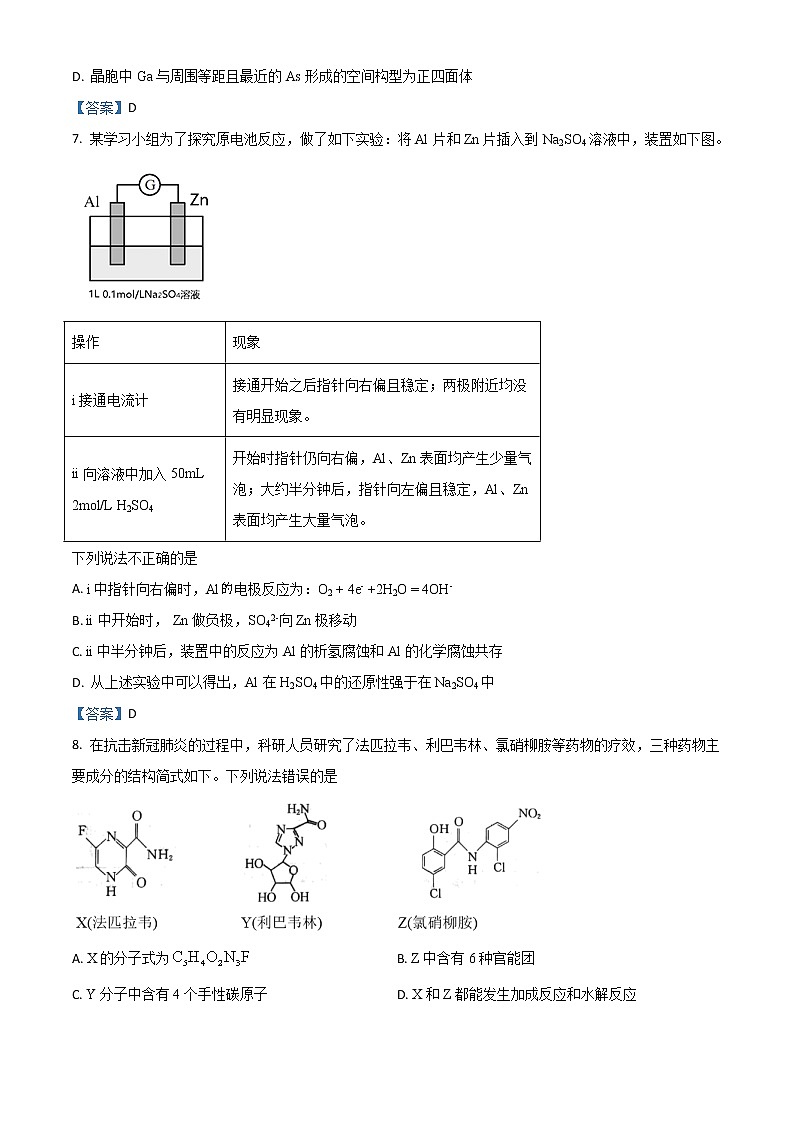
6. 砷化镓是一种重要半导体材料,熔点1238。它在600以下,能在空气中稳定存在,并且不被非氧化性的酸侵蚀。砷化镓晶胞结构如图。下列说法正确的是
A. 砷化镓是一种分子晶体
B. 砷化镓中不存在配位键
C. 晶胞中Ga原子与As原子的数量比为4:1
D. 晶胞中Ga与周围等距且最近的As形成的空间构型为正四面体
【答案】D
7. 某学习小组为了探究原电池反应,做了如下实验:将Al片和Zn片插入到Na2SO4溶液中,装置如下图。
下列说法不正确的是
A. i中指针向右偏时,Al电极反应为:O2 + 4e- +2H2O = 4OH-
B. ii中开始时, Zn做负极,SO42-向Zn极移动
C. ii中半分钟后,装置中的反应为Al的析氢腐蚀和Al的化学腐蚀共存
D. 从上述实验中可以得出,Al在H2SO4中的还原性强于在Na2SO4中
【答案】D
8. 在抗击新冠肺炎的过程中,科研人员研究了法匹拉韦、利巴韦林、氯硝柳胺等药物的疗效,三种药物主要成分的结构简式如下。下列说法错误的是
A. X的分子式为B. Z中含有6种官能团
C. Y分子中含有4个手性碳原子D. X和Z都能发生加成反应和水解反应
【答案】B
9. 某种化合物的结构如图所示。其中X、Y、Z、Q、W为原子序数依次增大的五种短周期主族元素,Q核外最外层电子数与Y核外电子总数相同,X的原子半径是元素周期表中最小的。下列叙述正确的是
A. 电负性:
B. 简单离子半径:
C. Y的氢化物的沸点能大于Q的氢化物的沸点
D. 该化合物中Z和Y原子的杂化方式都相同
【答案】C
10. 某化工厂充分利用工业废气中的CO、,将氯代烃、氯碱工业和甲醇联合生产,减少了环境污染,具体流程如图。下列叙述错误的是
A. 为减少副反应的发生,过程II中的装置需使用阳离子交换膜
B. 过程Ⅳ中的反应是
C. 在联合生产过程中起催化作用
D. 理论上每生成1ml ,可得到1ml
【答案】D
11. 下列实验操作、现象以及原因完全对应的是
A. AB. BC. CD. D
【答案】B
12. 钨(W)在高温下可缓慢升华。碘钨灯中封存的碘蒸气能发生反应:W(s) + I2(g) WI2(g),利用工作时灯泡壁与灯丝的温度差,将沉积在灯泡壁上的钨“搬运”回灯丝上。对于该过程的理解不正确的是
A. 工作时,电能转化为光能和热能
B. 工作时,在灯泡壁和灯丝上发生反应的平衡常数互为倒数
C. W(s) + I2(g) WI2(g) 为放热反应
D. 碘蒸气的作用是延长灯丝的使用寿命
【答案】B
13. 垃圾分类意义重大,工业上回收光盘金属层中的Ag的流程如图所示,下列说法正确的是( )
A. 氧化过程中参加反应的Ag和NaClO的物质的量比之为1:1
B. 为了提高氧化过程的反应速率和产率,氧化过程应该在酸性、加强热条件下进行
C. 氧化过程中,可以用HNO3代替NaClO 氧化Ag
D. 还原过程,若水合肼转化为无害气体,则还原过程的离子方程式为4Ag++N2H4H2O+4OH-=4Ag↓+N2↑+5H2O
【答案】A
14. 近日,我国学者在Science报道了一种氯离子介导的电化学合成方法,能将乙烯高效清洁、选择性地转化为环氧乙烷,电化学反应的具体过程如图所示。在电解结束后,将阴、阳极电解液输出混合,便可反应生成环氧乙烷。下列说法错误的是
A. Ni电极与电源负极相连
B. 工作过程中阴极附近pH增大
C. 电解结束后,输出混合过程前两极电解液KCl浓度相同
D. 该过程总反应为
【答案】C
15. 向等物质的量浓度、NaOH混合溶液中滴加稀盐酸至过量。其中主要含硫物种(、、)的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如图所示(忽略滴加过程气体的逸出)。下列说法正确的是
A. 由X点处的pH,可计算出()
B. X点对应溶液中存在
C. Y点对应溶液中存在
D. X、Y点对应溶液中水的电离程度大小关系为:
【答案】C
二、非选择题:本题共4大题,共55分。
16. 钴是元素周期表第四周期第Ⅷ族元素,其化合物用途广泛。如:作锂电池的正极材料。
I.(1)基态C原子的价层电子排布式为_______。
II.利用原钴矿(含、NiS等杂质)制备的工艺流程如下:
资料:①在含一定量的溶液中:。
②溶于有机胺试剂,有机胺不溶于水。
③盐酸溶液中,有机胺试剂对金属离子的溶解率随盐酸浓度变化如图所示:
(2)步骤i的目的是_______。
(3)步骤ii中出现了淡黄色沉淀,写出发生该反应的离子方程式:_______。
(4)从平衡移动角度解释步骤iii中加入NaCl固体的目的是_______。
(5)步骤vi用作沉钴剂,在一定条件下得到碱式碳酸钴。实验测得在一段时间内加入等量所得沉淀质量随反应温度变化如图所示,分析曲线下降的原因___。
(6)步骤vi沉钴中(常温下进行),若滤液中含量为,此时溶液的pH为___。
(7)步骤viii中和混合后,鼓入空气,经高温烧结得到。该反应的化学方程式是_______。
【答案】 (1). (2). 增大反应物接触面积,加快反应速率,使反应更充分 (3). (4). 加入NaCl固体,可使溶液中Cl-浓度增大,平衡右移,浓度增大,提高其在有机胺试剂中的浓度 (5). 温度过高,分解(或和水解程度增大),浓度降低,沉淀质量减少;(或温度过高分解,沉淀质量减少) (6). 8 (7).
17. 苯乙烯是一种重要的化工原料。
(1)工业上可用乙苯催化脱氢的方法制备苯乙烯。
①已知部分化学键的键能如下:
则(g)⇌(g)+H2(g)的_______。
②下列叙述能说明该反应已达到平衡状态的是_______(填字母)。
a.恒温恒压时,气体密度不变 b. (乙苯)(苯乙烯)
c.消耗1ml乙苯同时生成1ml d.苯乙烯的质量保持不变
③已知:上述反应的速率方程为,,其中、分别为正、逆反应速率常数,为各组分分压。
实际生产中常在恒压条件下掺入高温水蒸气作为反应体系的稀释剂(水蒸气不参加反应)。在一定压强、900K的条件下,乙苯的平衡转化率随着的增大而_______(填“增大”“减小”或“不变”),原因是_______。
④某温度下,测得容器总压()和乙苯转化率随时间变化结果如图所示。平衡常数_______kPa(用平衡分压代替平衡浓度计算);a处的_______。
(2)研究表明金属次卟啉二甲酯能够顺利地选择性催化氧化苯乙烯生成苯甲醛,以该反应原理设计成酸性燃料电池,则电池负极的电极反应式为_______。
【答案】 (1). +124 (2). ad (3). 增大 (4). 恒压下,加入水蒸气稀释剂,相当于减小压强,平衡正向移动,乙苯的平衡转化率增大 (5). 45 (6). 2.5 (7). -8e-+3H2O=+8H++CO2。
18. 碘酸钙是新型食品添加剂。实验室制取的实验流程如图:
已知:碘酸是易溶于水的强酸,不溶于有机溶剂。碘酸钙晶体溶解度随温度降低而减小。
(1)实验流程“转化”步骤是为了制得碘酸,该过程在下图所示的装置中进行。
①当观察到三颈瓶中溶液_______现象时,停止通入氯气。
②“转化”时发生反应的离子方程式为_______。
(2)除去水溶液中少量单质的实验操作为_______(填字母)。
a.萃取分液 b.趁热过滤 c.冷却结晶
实验中用_______溶液检验碘单质的存在与否。
(3)对水层的处理是先用KOH调节pH至10,再在冰水浴中加入溶液。
①用KOH溶液调节的目的是将_______。
②采用冰水浴的目的是_______。
(4)准确称取产品0.6000g于烧杯中,加1:1高氯酸20mL,微热溶解后,冷却,配成250.00mL溶液。移取上述溶液50.00mL置于250mL碘量瓶中,加入1:1高氯酸2mL、3g KI(足量)(发生:),盖上瓶盖,暗处放置3min,加50mL水,加入0.3%淀粉溶液2mL,用0.1000 溶液滴定(发生:)到终点时消耗12.00mL,试计算产品中的质量分数_______。
【答案】 (1). 紫红色接近褪去 (2). (3). a (4). 淀粉 (5). 将残留氯气除去,防止干扰实验 (6). 降低碘酸钙的溶解度,使其析出,便于后续分离 (7). 32.5%
19. 有机物M是用于合成治疗人类免疫缺陷病毒的一种重要的中间体。合成M的路线如下:(部分反应条件或试剂已略去)
已知:
I.;
II.;
III.。
(1)有机物A的名称是_______。
(2)麦芽酚中碳原子的杂化方式为_______。
(3)B→C的反应方程式是_______。
(4)C→D的反应类型是_______。
(5)G的结构简式是_______。
(6)X的分子式为,X的结构简式是_______。
(7)Y的分子式为,Y与X具有相同种类的官能团,下列说法正确的是_______(填字母)。
a. Y与X互为同系物
b. Y能与羧酸发生酯化反应
c. Y在浓硫酸、加热的条件下能发生消去反应
【答案】 (1). 甲苯 (2). sp2、sp3 (3). +NaOH→ +NaBr (4). 氧化反应 (5). (6). (7). bc
操作
现象
i接通电流计
接通开始之后指针向右偏且稳定;两极附近均没有明显现象。
ii向溶液中加入50mL 2ml/L H2SO4
开始时指针仍向右偏,Al、Zn表面均产生少量气泡;大约半分钟后,指针向左偏且稳定,Al、Zn表面均产生大量气泡。
选项
实验操作
实验现象
原因
A
室温下,向浓度均为0.01的和混合溶液中滴加溶液
出现白色沉淀
B
将水蒸气通过灼热的铁粉
铁粉变为黑色
铁可以与水在高温下发生反应
C
取久置的粉末,向其中滴加过量的盐酸
观察到有气泡产生
没有变质
D
相同温度下,将相同大小的钠块分别加到水、醋酸、乙醇中
生成氢气的速率;醋酸>水>乙醇
三种电解质电离出能力:醋酸>水>乙醇
化学键
键能/
412
348
612
436
辽宁省名校联盟2023年高三12月份联合考试化学试题含答案解析: 这是一份辽宁省名校联盟2023年高三12月份联合考试化学试题含答案解析,共13页。
2024辽宁省名校联盟高三上学期12月联合考试化学含解析: 这是一份2024辽宁省名校联盟高三上学期12月联合考试化学含解析,共18页。试卷主要包含了下列叙述正确的是,下图为元素周期表的一部分,下列离子方程式书写正确的是等内容,欢迎下载使用。
2024辽宁省名校联盟高三上学期12月联合考试化学PDF版含解析: 这是一份2024辽宁省名校联盟高三上学期12月联合考试化学PDF版含解析,文件包含辽宁省名校联盟2023-2024学年高三上学期12月联合考试化学PDF版无答案pdf、化学2023年辽宁高三12月联考答案pdf等2份试卷配套教学资源,其中试卷共13页, 欢迎下载使用。












