
2021年中考化学一轮复习课件:第8课时 金属的性质和利用(课件)
展开1. 金属的物理性质:有金属光泽,常温下大多为 态(汞为液态);具有良好的 性、 性和 性;不同金属的密度、熔点、硬度等不同。 2. 用途:用作导线、饰品、炊具、灯丝等。
考点一 金属的物理性质与用途
【易错判断】(1)在常温下,所有金属都是银白色固体( )(2)户外架空的高压线使用的材料为金属铜( )
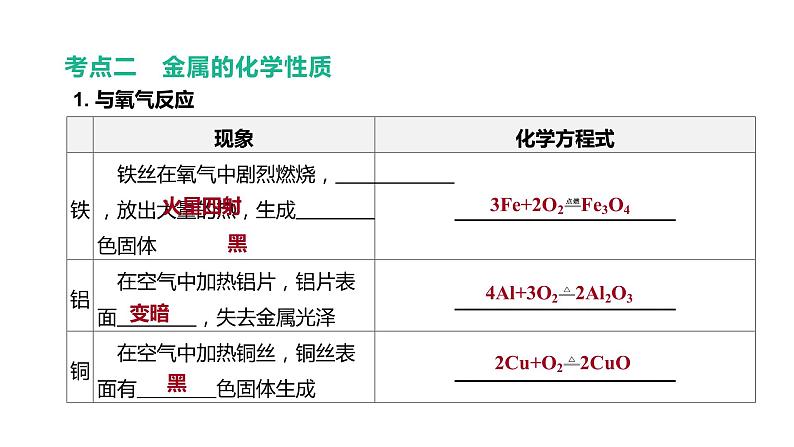
考点二 金属的化学性质
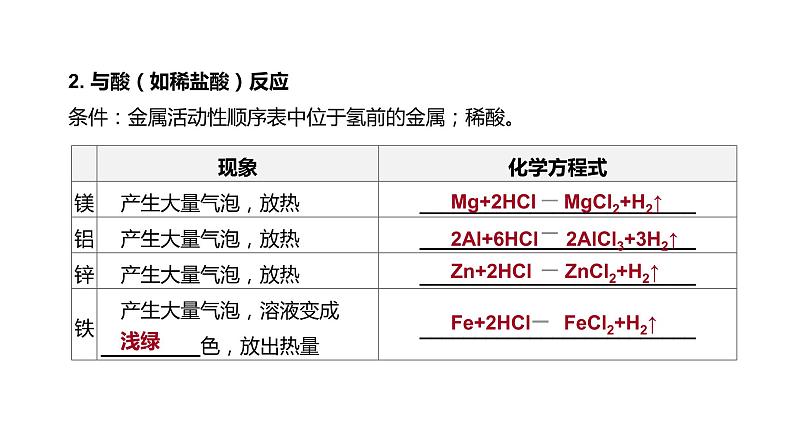
2. 与酸(如稀盐酸)反应 条件:金属活动性顺序表中位于氢前的金属;稀酸。
Mg+2HCl MgCl2+H2↑
2Al+6HCl 2AlCl3+3H2↑
Zn+2HCl ZnCl2+H2↑
Fe+2HCl FeCl2+H2↑
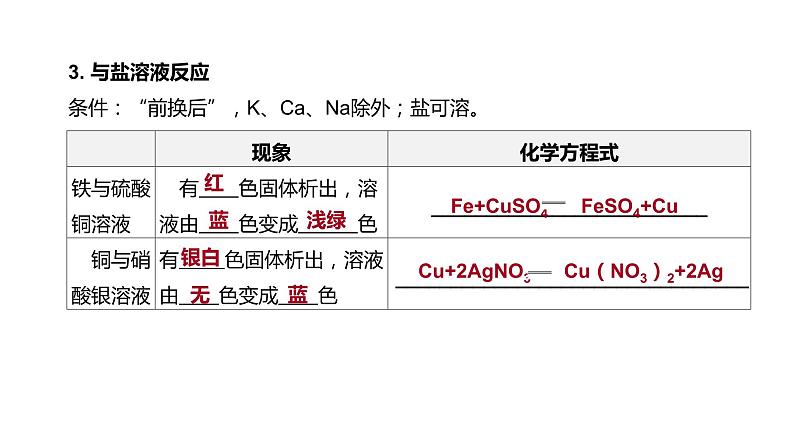
3. 与盐溶液反应 条件:“前换后”,K、Ca、Na除外;盐可溶。
Fe+CuSO4 FeSO4+Cu
Cu+2AgNO3 Cu(NO3)2+2Ag
【易错判断】(1)铝具有良好的抗腐蚀性是因为铝很难与氧气发生反应( )(2)铁丝在氧气中燃烧生成黑色的氧化铁( )(3)铁与稀盐酸反应生成黄色的氯化铁溶液( )(4)“曾青得铁则化为铜”可以用铁与硫酸铜溶液的反应表示,反应后溶液质量变大( )
考点三 金属活动性顺序及其应用
1. 常见金属在溶液中的活动性顺序
2. 应用(1)在金属活动性顺序表中,金属的位置越靠前,它的活动性就越 。 (2)在金属活动性顺序表中,位于 前面的金属能置换出盐酸、稀硫酸中的氢。 (3)在金属活动性顺序表中,位于前面的金属能把位于后面的金属从它们化合物的 里置换出来。
【易错判断】(1)铁能与稀盐酸反应,而铜不能,说明铁的活动性比铜强( )(2)可选用锌片、银片、硫酸铜溶液比较锌、铜、银的金属活动性 ( )
1. 金属材料包括 和 。 2. 合金(1)定义:由一种金属跟其他 (或 )熔合形成的有 __________的物质。 (2)特性:硬度一般比各成分金属 ,熔点一般比各成分金属 ,所以合金比纯金属具有更广泛的用途。 (3)常见的合金:生铁、钢都是铁的合金,其主要成分都是铁,二者的含碳量不同。生铁的含碳量为2%~4.3%,钢的含碳量为0.03%~2%。
【易错判断】(1)合金一定是混合物( )(2)将生铁放入足量的稀盐酸中,固体完全溶解,溶液变成浅绿色( )
由一种 跟一种 作用生成另一种 和另一种 _________的反应叫置换反应。置换反应可用符号表示为A+BC B+AC,可简记为“单换单”。
1. 食品包装中经常用到铝箔。铝块能压制成铝箔是因为铝具有良好的( )A.导电性B.导热性C.延展性D.抗腐蚀性
题组1 金属的物理性质与用途
2. 下列有关说法正确的是( )A.光亮的铜丝放入稀硫酸中,溶液变为蓝色,产生大量气泡B.将打磨好的铜丝在酒精灯上加热,铜丝表面由黑色变为红色C.将铜片放入硝酸银溶液中,溶液由无色变为蓝色D.将铁钉加入稀硫酸中,溶液由无色变为黄色
题组2 金属的化学性质
3. 我国早在古代就有“曾青得铁则化为铜”的记载,意思是可溶性铜的化合物与铁发生反应,得到单质铜。例如:CuSO4+Fe Cu+FeSO4。(1)CuSO4中硫元素的化合价为 ,其溶液颜色为 。 (2)该反应的基本反应类型为 。 (3)除去ZnSO4溶液中少量的CuSO4杂质,下列试剂中最好选用 (填序号)。 A.NaOH溶液D.Zn
4. 如图10-2所示,试管中盛有一段镁条,向试管中加入过量稀盐酸,观察到U形管中a处液面下降,b处液面上升。(1)镁条与稀盐酸反应的化学方程式为 。 (2)U形管中液面发生变化的原因是 。 (3)将试管中的物质换成水和另一种固体,也可以让U形管内液面发生同样的变化,则“另一种固体”是 。
4. 如图10-2所示,试管中盛有一段镁条,向试管中加入过量稀盐酸,观察到U形管中a处液面下降,b处液面上升。(1)镁条与稀盐酸反应的化学方程式为 。
[答案] Mg+2HCl MgCl2+H2↑ [解析]镁和稀盐酸反应生成氯化镁和氢气,化学方程式为Mg+2HCl MgCl2+H2↑。
4. 如图10-2所示,试管中盛有一段镁条,向试管中加入过量稀盐酸,观察到U形管中a处液面下降,b处液面上升。(2)U形管中液面发生变化的原因是 。
[答案]镁和稀盐酸反应放出热量,集气瓶内的气压增大[解析]由于镁和稀盐酸反应能够放出热量,使集气瓶内的气压增大,气体通过导管进入U形管,使U形管中液面发生了变化。
4. 如图10-2所示,试管中盛有一段镁条,向试管中加入过量稀盐酸,观察到U形管中a处液面下降,b处液面上升。 (3)将试管中的物质换成水和另一种固体,也可以让U形管内液面发生同样的变化,则“另一种固体”是 。
[答案]氢氧化钠(或氧化钙)[解析]氢氧化钠溶于水、氧化钙跟水反应都能放出热量,均可以使U形管液面发生同样的变化。
题组3 金属活动性顺序及其应用
5. 能用金属和盐酸直接反应制得的物质是( )①FeCl3 ②ZnCl2 ③CuCl2 ④AlCl3A.①②B.②④C.③④D.①③
[答案]B[解析]铁和盐酸反应生成氯化亚铁,①错误;锌能和盐酸反应生成氯化锌,②正确;铜与稀盐酸不反应,③错误;铝能和盐酸反应生成氯化铝,④正确。
6. 现有X、Y两种金属,分别把它们插入Cu(NO3)2 溶液中,一段时间后,在X表面有红色固体析出,在Y表面无明显变化,则上述金属的活动性顺序是( )A.X>Y>CuB.Y>Cu>XC.Cu>X>YD.X>Cu>Y
[答案]D[解析]在金属活动性顺序表中,排在前面的金属能把排在后面的金属从其盐溶液中置换出来。分别把X、Y两种金属插入Cu(NO3)2溶液中,一段时间后,在X表面有红色固体析出,在Y表面无明显变化,说明X的活动性比铜强,Y的活动性比铜弱,所以这三种金属的活动性顺序是X>Cu>Y。
7. 向CuSO4溶液中加入一定量的铁粉,充分反应后过滤,得滤液和滤渣。向滤渣中加入足量稀盐酸,滤渣部分溶解,有无色气体产生。根据上述实验做出的下列推断不正确的是( )A.金属活动性:Fe>CuB.滤渣中含有铁和铜C.滤液中不含Cu2+D.滤液质量比原溶液质量大
8. 下列物质不属于金属材料的是( )A.赤铁矿B.铜丝C.钛合金D.焊锡
[答案]A[解析]赤铁矿中的主要成分是氧化铁,它既不是纯金属、也不是合金,故赤铁矿不属于金属材料。
9. 国庆70周年双色铜合金纪念币黄白相映,广受欢迎。硬币外环为黄铜合金,内芯为具有独特机读性能的镍带复合白铜造币材料。回答下列问题。(1)纪念币外环的黄铜合金属于 (填“纯净物”或“混合物”)。 (2)铜的化合价有+2价和+1价,写出+1价铜的氧化物的化学式: 。 (3)实验室可通过木炭和氧化铜发生置换反应制取铜单质,该反应的化学方程式为 ,白铜为铜镍合金,其硬度比镍 (填“大”或“小”)。
9. 国庆70周年双色铜合金纪念币黄白相映,广受欢迎。硬币外环为黄铜合金,内芯为具有独特机读性能的镍带复合白铜造币材料。回答下列问题。(1)纪念币外环的黄铜合金属于 (填“纯净物”或“混合物”)。(2)铜的化合价有+2价和+1价,写出+1价铜的氧化物的化学式: 。
[答案] (1)混合物[解析] (1)黄铜合金中含有铜和锌,属于混合物。[答案] (2) Cu2O[解析] (2)氧化物中氧元素显-2价,故+1价铜的氧化物的化学式为Cu2O。
9. 国庆70周年双色铜合金纪念币黄白相映,广受欢迎。硬币外环为黄铜合金,内芯为具有独特机读性能的镍带复合白铜造币材料。回答下列问题。(3)实验室可通过木炭和氧化铜发生置换反应制取铜单质,该反应的化学方程式为 ,白铜为铜镍合金,其硬度比镍 (填“大”或“小”)。
[答案] C+2CuO 2Cu+CO2↑ 大[解析]木炭和氧化铜在高温条件下反应生成铜和二氧化碳,故化学方程式为C+2CuO 2Cu+CO2↑;合金的硬度一般比成分金属的硬度大。
10.明代宋应星所著的《天工开物》中记载了炼锡方法,用化学方程式可表示为2C+SnO2 Sn+2CO↑,该反应属于( )A.置换反应B.分解反应C.化合反应D.复分解反应
考向一 金属的性质和用途
1.【2017·徐州】国产大飞机C919机壳采用了先进的铝锂合金材料。已知金属锂(Li)的活动性比铝强。下列有关说法错误的是( )A.铝锂合金硬度大、密度小B.铝在空气中表面会形成致密的氧化膜C.锂能与盐酸反应,放出热量、生成氢气D.锂能与氧气反应,生成的Li2O中Li显+2价
[答案] D[解析]锂的活动性比铝强,因此锂也能与酸反应,且活泼金属与盐酸反应都放热、生成氢气;Li2O中氧元素的化合价为-2,根据化合物中各元素化合价代数和为零的原则,可知锂元素的化合价为+1。
2. 【2014·徐州】金属及其制品是现代生活中常见的材料,请回答下列问题。(1)铁和铝都可以制作炊具,主要利用了它们的 性。 (2)金属锌可以提取AgNO3废水中的银,这是因为锌的活动性比银 。 (3)将生铁加入足量稀盐酸中,充分反应后得到浅绿色溶液,该溶液中含有的金属离子主要是 (写离子符号),溶液底部残留的黑色不溶物主要是 。
[答案] (2)强[解析] (2)根据金属与金属盐溶液反应的条件,可知锌的活动性比银强。
2. 【2014·徐州】金属及其制品是现代生活中常见的材料,请回答下列问题。 (3)将生铁加入足量稀盐酸中,充分反应后得到浅绿色溶液,该溶液中含有的金属离子主要是 (写离子符号),溶液底部残留的黑色不溶物主要是 。
[答案] Fe2+ 碳[解析]根据溶液的颜色为浅绿色,可知该金属离子为Fe2+;生铁中的碳等物质不能与稀盐酸反应,因此残留的黑色不溶物主要是碳。
3. 拓展 常温下向一定质量的稀盐酸中逐渐加入镁条,充分反应(忽略挥发)。下列图像正确的是( )A.①②B.②③C.①④D.②④
[答案]C[解析]镁和稀盐酸反应生成氯化镁和氢气,由化学方程式可知,每24份质量的镁能置换出2份质量的氢气,所以反应后所得的氯化镁溶液质量大于反应前的稀盐酸质量,随着反应的进行,溶液质量逐渐增加,当盐酸完全反应时,溶液质量不再改变,图①正确;镁和稀盐酸反应是放热反应,随着反应的进行,溶液温度逐渐升高,当盐酸完全反应后,溶液温度会逐渐降回到原温度,图②错误;随着镁条的质量增加,反应生成氢气质量逐渐增加,当盐酸完全反应时,增加镁条的质量,氢气质量不再增加,图③错误;化学反应前后元素的种类和质量均不变,随着镁条质量的增加,溶液中氯元素质量不变,图④正确。
4.拓展【2020·苏州节选】铝是大自然赐予人类的宝物。是现代文明不可缺少的物质基础。(1)人类冶炼和使用金属铝的时间较晚。可能是因为 (填序号)。 a.地壳中铝元素含量少b.冶炼铝的技术要求高
[答案] b[解析]人类冶炼和使用金属铝的时间较晚,是因为铝的化学性质较活泼,冶炼的技术要求高。
4.拓展【2020·苏州节选】铝是大自然赐予人类的宝物。是现代文明不可缺少的物质基础。(2)用铝锂合金制造“神舟号”航天飞船的一些部件,主要是利用其强度高、耐腐蚀和 (写一条)等性质。高温下,铝与Li2O反应可置换出金属锂,写出该反应的化学方程式: 。
[答案]密度小(或质轻等,合理答案均可)2Al+3Li2O Al2O3+6Li[解析]铝锂合金具有强度高、耐腐蚀和质轻的特性,可用于制造航天飞船的一些部件;高温下,铝与Li2O发生置换反应生成金属锂和氧化铝,化学方程式为2Al+3Li2O Al2O3+6Li。
4.拓展【2020·苏州节选】铝是大自然赐予人类的宝物。是现代文明不可缺少的物质基础。(3)用砂纸去除铝片表面的氧化膜,将其浸入硫酸铜溶液中,一段时间后,观察到铝片表面有红色物质析出,并有气泡产生,经检验气体为氢气。①写出生成红色物质的化学方程式: 。 ②硫酸铜溶液中的阳离子有 (填离子符号)。
[答案] ①2Al+3CuSO4 Al2(SO4)3+3Cu ②Cu2+和H+[解析] ①在金属活动性顺序中,铝比铜活泼,能将其从硫酸铜溶液中置换出来,铜为红色物质,化学方程式为2Al+3CuSO4 Al2(SO4)3+3Cu。②由加入铝片后有红色物质铜和氢气产生可知,硫酸铜溶液中的阳离子有Cu2+和H+。
5. 【2019·徐州市区二模】把铁粉和铜粉的混合物放入硝酸银溶液中,充分反应后容器底部有固体。下列说法正确的是( )A.反应后溶液中可能含有Fe2+B.反应后溶液中一定有Fe2+和Cu2+C.剩余固体肯定含有银D.剩余固体肯定含有银和铜
考向二 金属活动性顺序
[答案]C[解析]三种金属活动性强弱关系为Fe>Cu>Ag,故硝酸银溶液先与铁粉反应,当铁反应完,若有硝酸银剩余,硝酸银才能继续与铜粉发生反应。铁与硝酸银反应时生成硝酸亚铁和银,故溶液中一定含有Fe2+,剩余固体中一定有银;由于不能判断铜是否与硝酸银发生了反应,故不能判断溶液中是否有Cu2+,同理,也不能判断剩余固体中是否有铜。
6. 【2015·徐州节选】(1)考古人员在发掘出来的文物中,发现金手镯完好无损,铜镜面有少量铜锈,铁器表面则锈迹斑斑。根据以上现象,你能得到的结论是 。 (2)请你设计一个实验方案,比较铝、铁、铜的金属活动性强弱: 。
[答案] (1)三种金属的活动性顺序是铁>铜>金[解析] (1)金属活动性越强,越容易与氧气反应而生锈,因此通过金属表面锈迹的多少,可判断三种金属的活动性顺序。
6. 【2015·徐州节选】(2)请你设计一个实验方案,比较铝、铁、铜的金属活动性强弱:_____________。
[答案]将两片相同大小的铁片分别加入硫酸铝和硫酸铜溶液中,铁与硫酸铝不反应,铁能与硫酸铜反应,铁片表面有红色固体析出,溶液由蓝色变为浅绿色,因此可判断金属活动性顺序为铝>铁>铜[解析]比较铝、铁、铜的金属活动性强弱时,可以对比铁片分别与硫酸铝、硫酸铜的反应现象,从而判断三种金属的活动性强弱。
7. 【2020·徐州市区二模】某计算机电路板中含有Fe、Cu、Ag、Ni(镍,银白色)等金属,某工厂按如图10-4所示实验流程回收部分金属。已知2Cu+O2+2H2SO4 2CuSO4+2H2O。(1)操作①②的名称是 。 (2)滤液②中阳离子的符号是 。 (3)滤液③和铁粉反应的化学方程式是 。 (4)由图中可以得出Ag、Fe、Ni的活动性由强到弱的顺序是 。
7. 【2020·徐州市区二模】某计算机电路板中含有Fe、Cu、Ag、Ni(镍,银白色)等金属,某工厂按如图10-4所示实验流程回收部分金属。已知2Cu+O2+2H2SO4 2CuSO4+2H2O。(1)操作①②的名称是 。
[答案]过滤[解析]操作①②的名称是过滤,通过过滤分离液体与不溶性固体。
7. 【2020·徐州市区二模】某计算机电路板中含有Fe、Cu、Ag、Ni(镍,银白色)等金属,某工厂按如图10-4所示实验流程回收部分金属。已知2Cu+O2+2H2SO4 2CuSO4+2H2O。(2)滤液②中阳离子的符号是 。
[答案] Fe2+[解析]滤液②中的溶质是硫酸亚铁,故阳离子是Fe2+。
7. 【2020·徐州市区二模】某计算机电路板中含有Fe、Cu、Ag、Ni(镍,银白色)等金属,某工厂按如图10-4所示实验流程回收部分金属。已知2Cu+O2+2H2SO4 2CuSO4+2H2O。(3)滤液③和铁粉反应的化学方程式是 。
[答案] Fe+CuSO4 FeSO4+Cu[解析]滤液③中的硫酸铜和铁粉反应生成硫酸亚铁和铜,反应的化学方程式是Fe+CuSO4 FeSO4+Cu。
7. 【2020·徐州市区二模】某计算机电路板中含有Fe、Cu、Ag、Ni(镍,银白色)等金属,某工厂按如图10-4所示实验流程回收部分金属。已知2Cu+O2+2H2SO4 2CuSO4+2H2O。(4)由图中可以得出Ag、Fe、Ni的活动性由强到弱的顺序是 。
[答案] Fe、Ni、Ag[解析]由图可知,向金属板中加入过量稀硫酸后,Fe、Ni均能与稀硫酸反应,Ag不能与稀硫酸反应,故Ni的金属活动性强于Ag;向滤液①中加入过量铁粉可得到Ni,故Fe的金属活动性强于Ni,则Ag、Fe、Ni的金属活动性由强到弱的顺序是Fe、Ni、Ag。
8. 拓展【2019·临沂】某同学为了探究相关金属的化学性质,做了下列实验:(1)A试管中实验现象是 。 (2)只通过A和B实验尚不能证明铜、银两种金属的活动性强弱,需补充一个实验来证明,补充实验所用试剂合理的是 (填序号)。 A.Cu、Ag、稀盐酸B.Cu、AgNO3溶液(3)实验C中物质充分反应后,某同学对试管中固体的成分提出以下四种猜想:A.Zn、Cu、AgB.Zn、CuC.Cu、AgD.Ag这四种猜想中明显不合理的是 (填序号)。
8. 拓展【2019·临沂】某同学为了探究相关金属的化学性质,做了下列实验:(1)A试管中实验现象是 。
[答案]锌片上附着一层红色的物质,溶液由蓝色变为无色[解析]锌的活动性比铜强,故锌能和硝酸铜反应,生成铜和硝酸锌,现象为锌片上附着一层红色的物质,溶液由蓝色变为无色。
8. 拓展【2019·临沂】某同学为了探究相关金属的化学性质,做了下列实验:(2)只通过A和B实验尚不能证明铜、银两种金属的活动性强弱,需补充一个实验来证明,补充实验所用试剂合理的是 (填序号)。 A.Cu、Ag、稀盐酸B.Cu、AgNO3溶液
[答案] B[解析]通过实验A可知锌的活动性比铜强,通过实验B可知锌的活动性比银强,还需要证明铜和银的活动性强弱关系,Cu、Ag与稀盐酸均不能反应,故无法证明,Cu可与AgNO3溶液反应,可以证明铜的活动性比银强。
8. 拓展【2019·临沂】某同学为了探究相关金属的化学性质,做了下列实验:(3)实验C中物质充分反应后,某同学对试管中固体的成分提出以下四种猜想:A.Zn、Cu、AgB.Zn、CuC.Cu、AgD.Ag这四种猜想中明显不合理的是 (填序号)。
[答案] B[解析]锌片放入硝酸铜和硝酸银的混合溶液中,先进行的是锌和硝酸银的反应,硝酸银完全反应后,再进行锌和硝酸铜的反应。故若锌过量,得到的金属为锌、银、铜;若锌和硝酸铜、硝酸银恰好完全反应,得到的金属是铜和银;此反应的过程中一定有银析出。
【方法点拨】比较三种金属活动性时,通常采用以下两种方法:(1)用活动性最强的金属、活动性居中的金属盐溶液、活动性最弱的金属,即“两金夹一盐”;(2)用活动性最强的金属盐溶液、活动性居中的金属、活动性最弱的金属盐溶液,即“两盐夹一金”。如果三种金属中有两种金属能与酸发生置换反应,则可以在相同条件下,比较金属与酸反应放出热量的多少来判断金属活动性。
9.拓展【2020·潍坊节选】小明同学对金属的有关化学性质进行梳理和总结。请回答下列问题。(1)如图10-6甲,将一锌片投入稀硫酸中,观察到的现象是 ,该反应过程溶液中增加的粒子是 (用符号表示),溶液的pH (填“逐渐增大”“逐渐减小”或“不变”),反应的化学方程式为 。
[答案]锌片表面产生气泡 Zn2+ 逐渐增大 Zn+H2SO4 ZnSO4+H2↑[解析]将一锌片投入稀硫酸中,锌和稀硫酸反应生成硫酸锌和氢气,观察到的现象是锌片表面产生气泡,溶液中增加的粒子是Zn2+,随着反应进行,H2SO4减少,溶液酸性减弱,溶液的pH逐渐增大,化学方程式为Zn+H2SO4 ZnSO4+H2↑。
9.拓展【2020·潍坊节选】小明同学对金属的有关化学性质进行梳理和总结。请回答下列问题。 (2)图乙是将铜丝插入硝酸银溶液中反应的微观示意图,从微观粒子变化的角度分析该反应的实质是 ,反应过程中溶液的质量变化是 (填“增大”“减小”或“不变”)。
中考化学复习基础梳理第8课时金属的化学性质课件: 这是一份中考化学复习基础梳理第8课时金属的化学性质课件,共36页。PPT课件主要包含了金属与氧气反应,金属与酸反应,金属活动性顺序,教你来探究,无明显现象,ZnCu,CuAg,ZnCuAg,FeNO32,含碳量等内容,欢迎下载使用。
人教版化学中考一轮复习--基础梳理--第8课时 金属的化学性质(课件): 这是一份人教版化学中考一轮复习--基础梳理--第8课时 金属的化学性质(课件),共36页。PPT课件主要包含了金属与氧气反应,金属与酸反应,金属活动性顺序,教你来探究,无明显现象,ZnCu,CuAg,ZnCuAg,FeNO32,含碳量等内容,欢迎下载使用。
【备战2023】中考化学一轮复习:第8讲《水与溶液》课件: 这是一份【备战2023】中考化学一轮复习:第8讲《水与溶液》课件,共60页。PPT课件主要包含了导图巧记忆,热点考点,重要考点,一般考点,增强水的导电性,活性炭吸附,溶解性,漏斗边缘,滤纸边缘,玻璃棒等内容,欢迎下载使用。