

高中化学人教版 (2019)必修 第二册第六章 化学反应与能量实验活动6 化学能转化成电能课文配套课件ppt
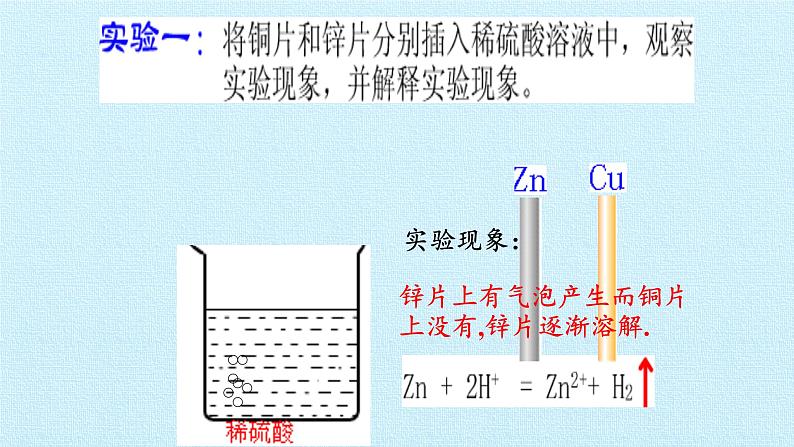
展开锌片上有气泡产生而铜片上没有,锌片逐渐溶解.
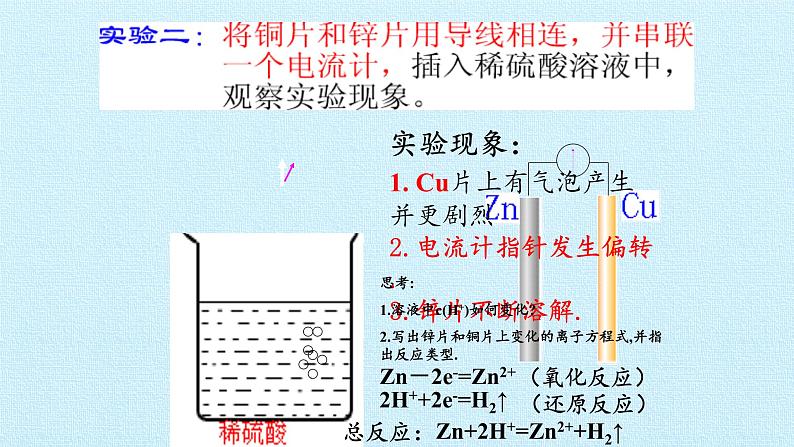
1. Cu片上有气泡产生并更剧烈2.电流计指针发生偏转.3.锌片不断溶解.
思考:1.溶液中c(H+)如何变化?2.写出锌片和铜片上变化的离子方程式,并指出反应类型.
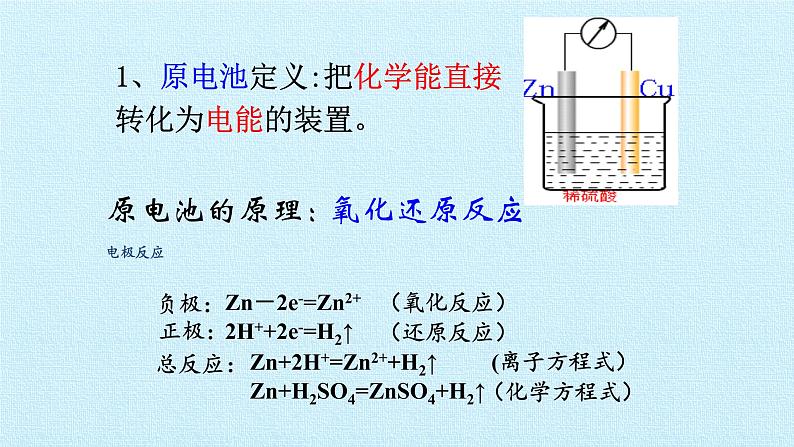
Zn-2e-=Zn2+
2H++2e-=H2↑
Zn+2H+=Zn2++H2↑
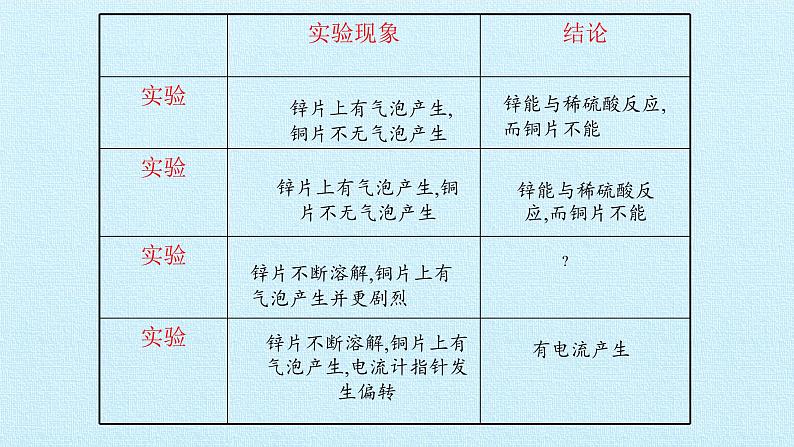
锌片上有气泡产生,铜片不无气泡产生
锌能与稀硫酸反应,而铜片不能
锌片不断溶解,铜片上有气泡产生并更剧烈
锌片不断溶解,铜片上有气泡产生,电流计指针发生偏转
1、原电池定义:把化学能直接转化为电能的装置。
Zn+H2SO4=ZnSO4+H2↑
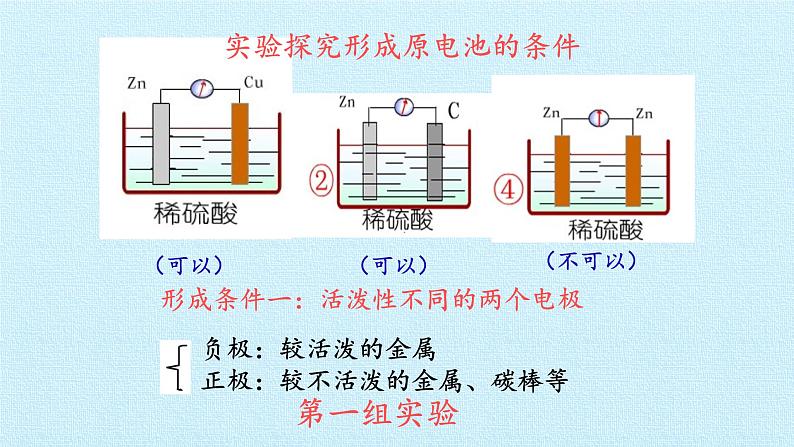
实验探究形成原电池的条件
形成条件一:活泼性不同的两个电极
负极:较活泼的金属正极:较不活泼的金属、碳棒等
形成条件二:电极需插进电解质溶液中
形成条件三:必须形成闭合回路
形成条件四:能自发的氧化还原反应
2、原电池的形成条件
通常情况下: ① 两个电极:活泼金属作负极,不活泼金属或能导电的非金属导体(石墨)作正极; ②两个电极插入电解质溶液中; ③ 构成闭合回路;
④负极能与电解质溶液自发发生氧化还原反应.
1.下列装置哪些可以形成原电池( )
Zn Cu
Fe C(石墨)
Zn Cu
Zn Zn
Fe 陶瓷
Fe Cu
稀H2SO4 CuSO4 溶液 稀H2SO4 稀H2SO4 A B C D
稀H2SO4 CuSO4溶液 酒精 E F G
请指出B C中的正负极,并写出电极反应式
1.Cu片上有气泡产生更剧烈.2.电流计指针发生偏转.3.锌片不断溶解.
失e-,沿导线传递,有电流产生
电子沿导线传递,产生电流
Cu-Zn原电池的工作原理
还原剂(Zn)失去电子,发生氧化反应
氧化剂(H+)在铜极上得到电子,发生还原反应
还原剂失去的电子从锌极流出
失e,沿导线传递,有电流产生
Cu2++2e- =Cu
Zn-2e- =Zn2+
Zn+Cu2+=Zn2++Cu
Zn+CuSO4=ZnSO4+Cu
Zn-2e-=Zn2+ (锌板溶解,发生氧化反应 )
Zn-2e-= Zn2+
2H+ + 2e-=H2↑
Zn+2H+=Zn2++H2↑
锌 铜 原 电 池 工 作 原 理
4、原电池的正负极的判断方法
电子从负极流出电子经导线流入正极
较活泼的电极材料较不活泼的电极材料
质量增加的电极质量减少被腐蚀的电极
有气泡冒出的电极为正极
发生氧化反应的电极发生还原反应的电极
宏观判断:①根据电极材料②根据原电池电极的反应③根据电极增重还是减重④根据电极有气泡冒出:
阴离子移向负极阳离子移向正极
2H++2e-=H2↑
Zn-2e-=Zn2+
Zn-2e- =Zn2+
2H++2e- =H2↑
Fe-2e - =Fe2+
Cu2++2e- =Cu
Fe+Cu2+=Fe2++Cu
3、下列方程式能设计成原电池吗?若能,判断 原电池的正负极。
⑴ Fe+Cu2+=Fe2++Cu
⑵ 2NaOH+H2S04=Na2SO4+2H2O
本节要点:1,原电池概念。2,原电池的形成成条件。3,原电池的工作原理。4,原电池的正负极判断5, 原电池实质:原电池是把氧化反应和还原反应分别在不同的电极上发生,实现化学能向电能的直接转化(了解) 。
高中实验活动6 化学能转化成电能优秀ppt课件: 这是一份高中实验活动6 化学能转化成电能优秀ppt课件,共28页。PPT课件主要包含了化学能,你知道吗,化学能直接电能,实验现象,原电池的原理,氧化还原反应,第一组实验,不可以,第二组实验,第三组实验等内容,欢迎下载使用。
化学必修 第二册实验活动6 化学能转化成电能教学ppt课件: 这是一份化学必修 第二册实验活动6 化学能转化成电能教学ppt课件,共12页。
高中化学人教版 (2019)必修 第二册实验活动6 化学能转化成电能一等奖课件ppt: 这是一份高中化学人教版 (2019)必修 第二册实验活动6 化学能转化成电能一等奖课件ppt,共23页。PPT课件主要包含了不能发生反应,课堂小结等内容,欢迎下载使用。













