






人教版初中化学九年级(下册)期中测试(二)
展开一、选择题(每小题3分,共30分)1.(独家原创试题)黄金一直被认为是富贵的象征,佩戴黄金首饰会让人显 得贵气。在各大商场总能看到“金灿灿”的金制饰品,如戒指、项链、手 链等。消费者在试戴时,售货员会提醒消费者,要轻轻地拉动,防止变形。 据此不能得出的是 ( )A.金的熔点较高 B.金的硬度较小C.金具有良好的延展性 D.金的颜色为金黄色
答案 A 由题中信息可知,金的颜色为金黄色;轻轻地拉动就变形,说明金 的硬度较小;能加工成戒指、项链、手链等,说明金具有良好的延展性。由 题给信息不能得出金的熔点较高的性质。
2.(2016浙江杭州中考)一杯70 ℃的硝酸钾饱和溶液,冷却后有晶体析出(晶 体不含结晶水),若不考虑溶剂的蒸发,则剩余溶液与原溶液相比 ( )A.由饱和溶液变为不饱和溶液 B.溶质质量不变C.溶液质量不变 D.溶质的质量分数减小
答案 D 冷却后有晶体析出,所得溶液为饱和溶液,但溶质的质量减少;由 于溶质的质量减少,溶剂的质量不变,则溶液质量减少,溶质的质量分数减 小。
3.(2019湖南郴州中考)下列关于溶液的说法正确的是( )A.溶液具有均一性、稳定性B.长期放置后不会分层的液体一定是溶液C.气体的溶解度随压强增大而减小D.医用酒精是75%的乙醇溶液,乙醇作溶剂
答案 A 溶液是均一、稳定的混合物;长期放置后不会分层的液体不一 定是溶液,例如蒸馏水;气体的溶解度随温度的升高而降低,随压强的增大 而增大;医用酒精是75%的乙醇溶液,水作溶剂,乙醇作溶质。
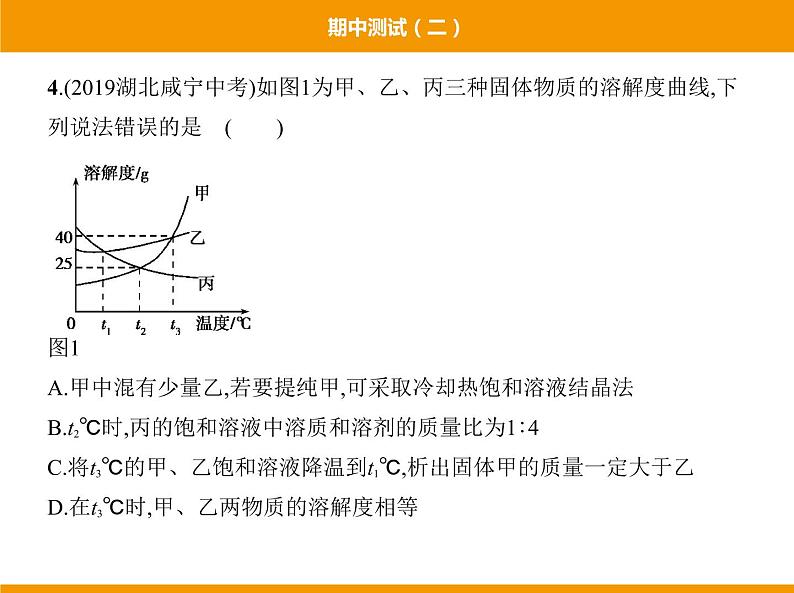
4.(2019湖北咸宁中考)如图1为甲、乙、丙三种固体物质的溶解度曲线,下 列说法错误的是 ( ) 图1A.甲中混有少量乙,若要提纯甲,可采取冷却热饱和溶液结晶法B.t2℃时,丙的饱和溶液中溶质和溶剂的质量比为1∶4C.将t3℃的甲、乙饱和溶液降温到t1℃,析出固体甲的质量一定大于乙D.在t3℃时,甲、乙两物质的溶解度相等
答案 C 甲物质的溶解度受温度影响变化较大,乙物质的溶解度受温度 影响变化较小,所以甲中混有少量乙,若要提纯甲,可采取冷却热饱和溶液 结晶法,故A正确;t2℃时,丙物质的溶解度是25 g,所以丙的饱和溶液中溶质 和溶剂的质量比为25 g∶100 g=1∶4,故B正确;将t3℃的甲、乙饱和溶液降 温到t1℃,饱和溶液的质量不能确定,所以析出固体的质量也不能确定,故C 错误;通过分析溶解度曲线可知,在t3℃时,甲、乙两物质的溶解度相等,故D 正确。
5.用实验探究Al和Cu的金属活动性强弱。若提供的试剂只有:CuCl2溶 液、AlCl3溶液、Al、Cu和稀盐酸。对此下列说法正确的是 ( )A.最多只能设计一种实验方案B.CuCl2溶液是不可或缺的试剂C.选用两种合适的试剂即可达到实验目的D.AlCl3溶液中加入Cu不能探究金属活动性强弱
答案 C 结合提供的试剂可以设计出的方案有:①Al、Cu、稀盐酸;② Al、CuCl2溶液;③Cu、AlCl3溶液。故只有C项说法正确。
6.(2018 四川自贡中考)下列关于铁、锌、铜三种金属及其合金的说法错 误的是 ( )A.铁在潮湿的空气中易生锈B.黄铜(铜与锌的合金)的硬度大于纯铜C.可以用铁桶盛放硫酸铜溶液D.可以用稀硫酸检验锌与铜的金属活动性强弱
答案 C 铁在与氧气、水共存时会发生锈蚀,所以铁在潮湿的空气中易 生锈;合金的硬度一般大于其成分金属的硬度,所以黄铜的硬度大于纯铜; 在金属活动性顺序中,铁排在铜的前面,铁能与硫酸铜反应生成硫酸亚铁和 铜,因此不能用铁桶盛放硫酸铜溶液;锌能和稀硫酸发生反应,铜不能和稀 硫酸发生反应,说明锌的活动性强于铜。
7.(2019辽宁葫芦岛龙岗一模)小明同学要用6%的氯化钠溶液配制100 g 3%的氯化钠溶液,下列说法错误的是( )A.小明同学需要量取水的体积为50 mLB.实验的步骤为计算、称量、量取、溶解、装瓶贴签C.实验中所需玻璃仪器为玻璃棒、胶头滴管、烧杯、量筒、细口瓶D.在其他操作均正确的情况下,若在量取6%的氯化钠溶液过程中,仰视液 面量取了该溶液,则所配制溶液的溶质质量分数大于3%
答案 B 设要加水的质量为x,根据溶液稀释前后溶质的质量不变,则100 g×3%=(100 g-x)×6%,x=50 g(合500 mL),A说法正确。利用浓溶液配制稀溶 液,采用加水稀释的方法,其操作步骤是计算、量取、混匀,B说法错误。用 6%的氯化钠溶液配制100 g 3%的氯化钠溶液,实验中所需玻璃仪器有玻璃 棒、胶头滴管、烧杯、量筒、细口瓶,C说法正确。用量筒量取液体时,仰 视液面,会造成实际量取的6%的氯化钠溶液的体积偏大,使所配溶液的溶 质质量分数偏大,D项说法正确。
8.(2019江苏盐城中考)下表是KCl、NH4Cl、KNO3三种物质在不同温度时 的溶解度:
根据表格信息,可以推知 ( )A.三种物质中溶解度最小的是KClB.40 ℃时,100 g KNO3饱和溶液中含有63.9 g KNO3C.三种物质中,溶解度受温度变化影响最大的是KNO3D.在0 ℃~100 ℃以内的相同温度下,KCl和NH4Cl的溶解度可能相等
答案 C 比较物质溶解度大小,要指明温度,故A错误; 40 ℃时,KNO3的溶 解度是63.9 g,163.9 g KNO3饱和溶液中才含有63.9 g KNO3,故B错误;根据 三种物质的溶解度表格可以看出,三种物质中,溶解度受温度变化影响最大 的是KNO3,故C正确;根据从题表中获取的信息可知,在0 ℃~100 ℃以内的 相同温度下,KCl和NH4Cl的溶解度不可能相等,故D错误。
9.(2018湖南邵阳中考)向AgNO3溶液中加入一定质量铜和锌的混合物,充 分反应后过滤得到无色溶液和滤渣,下列说法正确的是 ( )A.反应后所得的溶液中一定含有Zn(NO3)2,一定不含Cu(NO3)2和AgNO3B.反应后所得的溶液中一定含有Zn(NO3)2,可能含有Cu(NO3)2和AgNO3C.反应后所得的滤渣中一定含有Ag,一定不含Cu和ZnD.反应后所得的滤渣中一定含有Cu,可能含有Zn和Ag
答案 A 向AgNO3溶液中加入一定质量铜和锌的混合物,锌先与硝酸银 反应生成硝酸锌和银,锌完全反应后,铜再与硝酸银反应生成硝酸铜和银。 反应后所得的溶液呈无色,说明铜未参加反应,则AgNO3一定反应完全,故 反应后所得溶液中一定含有Zn(NO3)2,一定不含Cu(NO3)2和AgNO3,故A正 确,B错误;反应后所得的滤渣中一定含有Cu和Ag,可能含有Zn,故C、D错 误。
10.(2019广东中考)取一定量打磨后的铝片于某容器中,再逐渐加入稀盐 酸。加入稀盐酸的质量与有关量的变化关系图错误的是 ( )
答案 B Al和稀盐酸反应生成AlCl3和H2,随着稀盐酸的不断加入,氢气的 质量不断增加,当铝完全消耗,氢气的质量不再变化,选项A对应关系正确; Al与稀盐酸反应生成AlCl3和H2,随着稀盐酸的加入,溶液质量不断增加,当 铝完全反应,再加入稀盐酸,溶液质量虽然增加,但因HCl的相对分子质量小 于AlCl3,所以溶液质量增加的幅度会减小,选项B对应关系不正确;随着稀 盐酸的不断加入,铝片不断反应,质量不断减小,直至减小到0,选项C对应关 系正确;由质量守恒定律可知,反应前后容器中铝元素的质量不变,选项D对 应关系正确。
11.(2017山东德州中考)(6分)人类社会的发展离不开金属。请依据所学知 识填空。(1)下列制品的用途,利用金属导热性的是 。 (2)金属资源在地球上分布广泛。人们在自然界中仅发现金、银等少数金 属单质,其余金属元素都以化合物形式存在。你认为金属的存在形式主要 和 有关。(3)农业上用硫酸铜、生石灰加水配制波尔多液作为杀菌剂。有经验的农 民都不用铁质容器来配制或盛放波尔多液,原因是 (用化学方程式表示)。
二、填空题(共40分)
答案 (1)A(2)金属活动性强弱(或金属失电子能力)(3)Fe+CuSO4 FeSO4+Cu
解析 (2)金属的存在形式主要和金属的活动性强弱有关。(3)铁能与硫酸 铜溶液反应,生成硫酸亚铁和铜。
12.(2019湖南邵阳中考)(6分)如图2为甲、乙、丙三种物质的溶解度曲线 图。请据图回答下列问题: 图2(1)t1℃时,甲、乙、丙三种物质的溶解度由大到小的顺序是 ;(2)欲将t1℃时丙的不饱和溶液变成饱和溶液,可 温度(填“升 高”或者“降低”);(3)现有t1℃时甲、乙、丙三种物质的饱和溶液,将它们均升温至t2℃,则所 得溶液中溶质的质量分数最小的是 。
答案 (1)丙>乙>甲 (2)升高 (3)甲
解析 (1)通过分析溶解度曲线图可知,t1℃时,甲、乙、丙三种物质的溶解 度由大到小的顺序是丙>乙>甲;(2)丙物质的溶解度随温度的升高而减小, 所以欲将t1℃时丙的不饱和溶液变成饱和溶液,可升高温度;(3)将t1℃时 甲、乙、丙三种物质的饱和溶液均升温至t2℃,甲、乙的溶质质量分数不 变,丙的溶质质量分数减小,根据溶解度曲线图可知,所得溶液中溶质的质 量分数最小的是甲。
13.(2019江苏淮安中考)(6分)2019年底,徐宿淮盐铁路将建成通车,淮安人 可实现高铁出行。 图3(1)高铁在建造时使用了大量的新材料,下列属于金属材料的是 (填序号)。A.生产高铁车头的玻璃钢B.制造高铁车身的镁铝合金
C.制造轨道枕木的聚氨酯材料D.建筑高铁路基的钢筋混凝土(2)高铁刹车制动盘使用合金锻钢制作,主要利用该合金耐高温、 等特性。(3)在高铁站的建设中,使用了大量的钢铁。工业上用赤铁矿(主要成分是 氧化铁)和一氧化碳反应冶炼铁,该反应的化学方程式为 。(4)高铁轨道焊接时,可用铝热反应:2Al+Fe2O3 2Fe+Al2O3,该反应的基本类型是 。
答案 (1)B (2)耐磨 (3)Fe2O3+3CO 2Fe+3CO2 (4)置换
解析 (1)金属材料主要包括纯金属及其合金,四种材料中只有镁铝合金属 于金属材料。(2)高铁刹车制动盘使用合金锻钢制作,说明该合金具有耐磨 的特性。(3)赤铁矿的主要成分是氧化铁,其与一氧化碳能在高温条件下生 成铁与二氧化碳。(4)铝热反应是一种单质和一种化合物反应生成另一种 单质和另一种化合物,属于置换反应。
14.(独家原创试题)(4分)表示固体物质的溶解度随温度的变化,一般有列表 法与溶解度曲线法两种。请运用溶解度表与溶解度曲线回答下列问题:
图4(1)B可以表示是 (填“氯化钠”或“硝酸钾”)的溶解度曲线。(2)60 ℃时,向100 g水中加入100 g硝酸钾,所得溶液的溶质质量分数为
,当该溶液从60 ℃降温到30 ℃时,析出晶体的质量为 g。(3)现有50 ℃ A物质的不饱和溶液,在不减少溶剂的情况下,欲使其变成饱 和溶液,下列措施一定不能实现的是 (填序号)。①降低温度 ②升高温度 ③加入A物质
答案 (1)氯化钠 (2)50% 54.2 (3)②
解析 (1)氯化钠的溶解度受温度的影响变化不大,所以B可以表示氯化钠 的溶解度曲线。(2)60 ℃时,向100 g水中加入100 g硝酸钾,能全部溶解,所 得溶液的溶质质量分数为 ×100%=50%;当该溶液从60 ℃降温到30 ℃时,析出晶体的质量为100 g-45.8 g=54.2 g。 (3)由于A的溶解度随温度的升 高而增大,所以在不减少溶剂的情况下,欲使不饱和溶液变成饱和溶液,可 采取加溶质或降低温度的方法,不能通过升高温度的方法实现。
15.(2017安徽中考)(10分)某研究小组为探究“影响铁制品锈蚀快慢的因 素”,取同浓度的稀氨水和稀醋酸用图5所示装置完成表中实验,回答下列 问题。
(1)铁锈的主要成分是 (填化学式)。(2)实验②和④可探究 因素对铁制品锈蚀快慢的影响;欲探究试剂 酸碱性对铁制品锈蚀快慢的影响,应选择的实验是 (填实验序
号)。(3)根据表中实验现象得出的结论是 (写出1点即可)。(4)影响铁制品锈蚀快慢除上述因素外,还有 (写出1点即 可),请设计实验方案: 。
答案 (1)Fe2O3·xH2O(2)温度 ①和②(或③和④)(3)在相同温度下,酸性环境铁生锈更快(其他合理答案均可)(4)试剂浓度(其他合理答案均可) 同温下,将相同的铁钉放入等体积不同 浓度的醋酸溶液中,观察铁锈出现的时间(其他合理答案均可)
解析 (1)铁锈的主要成分是Fe2O3·xH2O。(2)实验②和④的试剂相同,实验 温度不同,所以探究的是温度对铁制品锈蚀快慢的影响。实验①和②(或 ③和④)温度相同,试剂不同,可探究溶液酸碱性对铁制品锈蚀快慢的影 响。(3)由实验①、②可知,温度相同,铁制品在稀醋酸中锈蚀较快;由实验 ②、④可知,试剂相同,铁制品在70 ℃时比在25 ℃时锈蚀更快。(4)影响铁 制品锈蚀的因素除温度、试剂的酸碱性外,还有氧气浓度、试剂浓度等,在 设计实验时注意控制变量。
16.(8分)某化工厂排出的废液中含有AgNO3、Cu(NO3)2和Zn(NO3)2。为了 减少废液对环境的污染,并回收银和铜,某化学小组同学设计了如图6所示 方案进行实验: 图6试回答:(1)加入的固体a是 (写化学式)。(2)固体乙的成分有 。
(3)步骤①中将滤液1与固体甲分离的操作名称是 。(4)写出步骤②中发生反应的化学方程式: 。
答案 (1)Fe (2)Ag、Cu (3)过滤 (4)Fe+H2SO4 FeSO4+H2↑
解析 (1)废液中含有AgNO3、Cu(NO3)2和Zn(NO3)2,加入固体a反应后过滤 所得滤液中只含Zn(NO3)2、Fe(NO3)2,则加入的固体a应是Fe。(2)固体甲是 铁、铜、银的混合物,经两步操作可得到硫酸亚铁溶液,由此可知加入的溶 液b应是稀硫酸,铜、银不与稀硫酸反应,固体乙应是铜、银混合物。(3)步 骤①中将滤液1与固体甲分离的操作名称是过滤。(4)步骤②中发生的反 应是Fe+H2SO4 FeSO4+H2↑。
17.(2019重庆九龙坡模拟)(12分)为了比较金属R与铁、铜的金属活动性强 弱,某学校一个学习小组的同学进行了如下探究活动。【查阅资料】铁的活动性比铜强。【进行猜想】对三种金属的活动性顺序做出如下猜想:猜想一:R>Fe>Cu;猜想二: ;猜想三:Fe>Cu>R。【收集证据】为了验证哪一种猜想成立,甲、乙、丙三位同学分别展开实 验探究。
三、实验探究题(共22分)
铁丝在氧气中点燃可以发生剧烈燃烧,其化学方程式是 。【交流反思】三位同学交流讨论后认为,比较金属活动性强弱的方法有多 种。【归纳总结】他们总结得出比较金属活动性强弱的常见方法有:(1)金属与 是否反应;(2)金属与酸溶液是否反应或反应的剧烈程度;(3)金属与氧气反应的难易和剧烈程度。
答案 【进行猜想】Fe>R>Cu 【收集证据】无明显现象 快 红热 3 Fe+2O2 Fe3O4 【归纳总结】化合物溶液
解析 【进行猜想】根据查阅的资料信息和猜想一和猜想三可确定,猜想 三为Fe>R>Cu。【收集证据】根据题意,猜想一正确,即R>Fe>Cu。甲:将 打磨好的铜丝插入盛有RSO4溶液的试管中,无明显现象;乙:将打磨好的、 粗细相同的R丝、铁丝分别插入体积和溶质的质量分数都相同的稀盐酸 中,R丝表面产生气泡速率比铁丝表面产生气泡速率快;丙:将打磨好的、粗 细相同的R丝、铁丝分别在空气中灼烧,R丝在空气中剧烈燃烧,铁丝在空 气中只能发生红热现象,不能燃烧。铁丝在氧气中点燃可以剧烈燃烧,生成 四氧化三铁。【归纳总结】比较金属活动性强弱的常见方法有:金属与化 合物溶液是否反应、金属与酸溶液是否反应或反应的剧烈程度、金属与 氧气反应的难易和剧烈程度等。
18.(2018内蒙古呼伦贝尔莫旗模拟)(10分)图7是实验室配制一定溶质质量 分数的NaCl溶液的流程图。
图7请回答:(1)应称量 g NaCl,需加水 mL(水的密度为1 g/mL)。(2)某同学按图7所示步骤依次操作,其中操作错误的步骤造成配制的溶液 的溶质质量分数 10%(填“>”“<”或“=”)。(3)若称量NaCl固体时指针向右偏转,则应 直到天 平平衡。(4)取上述正确配制的溶液10 g 加水稀释到 g,可得到5%的NaCl溶 液。
答案 (1)5 45 (2)< (3)继续向左盘添加氯化钠 (4)20
解析 (1)配制10%的氯化钠溶液50 g,需氯化钠的质量为50 g×10%=5 g;需 水的质量为50 g-5 g=45 g,合45 mL。(2)用量筒量取水时,仰视读数,会造成 实际量取的水的体积偏大,则溶质质量分数偏小。(3)称量氯化钠固体时, 先放好砝码和调好游码,然后向左边托盘添加氯化钠,若发现指针向右偏 转,说明氯化钠的质量小于砝码和游码的质量和,故应继续向左盘添加氯化 钠,直至天平平衡。(4)设稀释后的溶液质量为x,根据溶液稀释前后溶质的 质量不变,则10 g ×10%=x×5%,解得 x=20 g。
19.(2019湖北襄阳中考)(8分)文文想通过实验测定稀盐酸的溶质质量分数, 他分四次向182.5 g稀盐酸中加入含有杂质的锌粉(杂质不溶于盐酸也不与 盐酸发生反应),记录所加锌粉质量与产生氢气的质量如下表所示:
请帮文文计算稀盐酸的溶质质量分数。
答案 解:生成氢气的总质量为0.15 g+0.15 g+0.1 g=0.4 g,设182.5 g稀盐酸 中溶质的质量为xZn+2HCl ZnCl2+H2↑ 73 2 x 0.4 g = x=14.6 g稀盐酸的溶质质量分数为 ×100%=8%答:稀盐酸的溶质质量分数为8%。
初中化学人教版九年级下册第十单元 酸和碱课题1 常见的酸和碱图文ppt课件: 这是一份初中化学人教版九年级下册第十单元 酸和碱课题1 常见的酸和碱图文ppt课件,共17页。
初中化学人教版九年级下册课题2 化学肥料获奖ppt课件: 这是一份初中化学人教版九年级下册课题2 化学肥料获奖ppt课件,共30页。PPT课件主要包含了化肥简介,化学肥料,复合肥料,化肥分类,碳酸氢铵,豆科植物根系与根瘤菌,复合肥,微量元素肥料,化肥农药污染及治理,化肥的合理施用等内容,欢迎下载使用。
化学第十一单元 盐 化肥课题2 化学肥料教案配套ppt课件: 这是一份化学第十一单元 盐 化肥课题2 化学肥料教案配套ppt课件,共14页。PPT课件主要包含了Ca3PO42,NH4HCO3,K2SO4,CONH22,NH4+,铵态氮肥,OH-,NH3等内容,欢迎下载使用。












