

2014年(上海市)高考真题化学试题及答案
展开2014普通高等学校招生全国统一考试(上海卷)
化学试题
相对原子质量(原子量):H-1 C-12 O-16 Na-23 S-32 Cl-35.5 Zn-65 As-75
一、选择题(本题共10小题,每小题2分,每题只有一个正确选项)
1.“玉兔”号月球车用Pu作为热源材料。下列关于Pu的说法正确的是
A.Pu与U互为同位素 B.Pu与Pu互为同素异形体
C.Pu与U具有完全相同的化学性质 D.Pu与Pu具有相同的最外层电子数
2.下列试剂不会因为空气中的氧气而变质的是
A.过氧化钠 B.氢硫酸 C.硫酸亚铁 D.苯酚
3.结构为…-CH=CH-CH=CH-CH=CH-CH=CH-…的高分子化合物用碘蒸气处理后,其导电能力大幅提高。上述高分子化合物的单体是
A.乙炔 B.乙烯 C.丙烯 D.1,3-丁二烯
4.在“石蜡→液体石蜡→石蜡蒸气→裂化气”的变化过程中,被破坏的作用力依次是
A.范德华力、范德华力、范德华力
B.用范德华力、范德华力、共价键
C.范德华力、共价键、共价键
D.共价键、共价键、共价键
5.下列分离方法中,和物质的溶解度无关的是
A.升华 B.萃取 C.纸上层析 D.重结晶
二、选择题(本题共36小题,每小题3分,每题只有一个正确选项)
6.今年是门捷列夫诞辰180周年。下列事实不能用元素周期律解释的只有
A.碱性:KOH>NaOH B.相对分子质量:Ar>K
C.酸性:HClO4>H2SO4 D.元素的金属性:Mg>Al
7.下列各组中两种微粒所含电子数不相等的是
A.H3O+和OH- B.CO和N2 C.HNO2和NO2- D.CH3+和NH4+
8.BeCl2熔点较低,易升华,溶于醇和醚,其化学性质与AlCl3相似。由此可推测BeCl2
A.熔融态不导电 B.水溶液呈中性
C.熔点比BeBr2高 D.不与氢氧化钠溶液反应
9.1,3-丁二烯和2-丁炔分别与氢气反应的热化学方程式如下:
CH2=CH-CH=CH2(g)+2H2(g)→CH3CH2CH2CH3(g)+236.6kJ
CH3-C≡C-CH3(g)+2H2(g)→CH3CH2CH2CH3(g)+272.7kJ
由此不能判断
A.1,3-丁二烯和2-丁炔稳定性的相对大小
B.1,3-丁二烯和2-丁炔分子储存能量的相对高低
C.1,3-丁二烯和2-丁炔相互转化的热效应
D.一个碳碳叁键的键能与两个碳碳双键的键能之和的大小
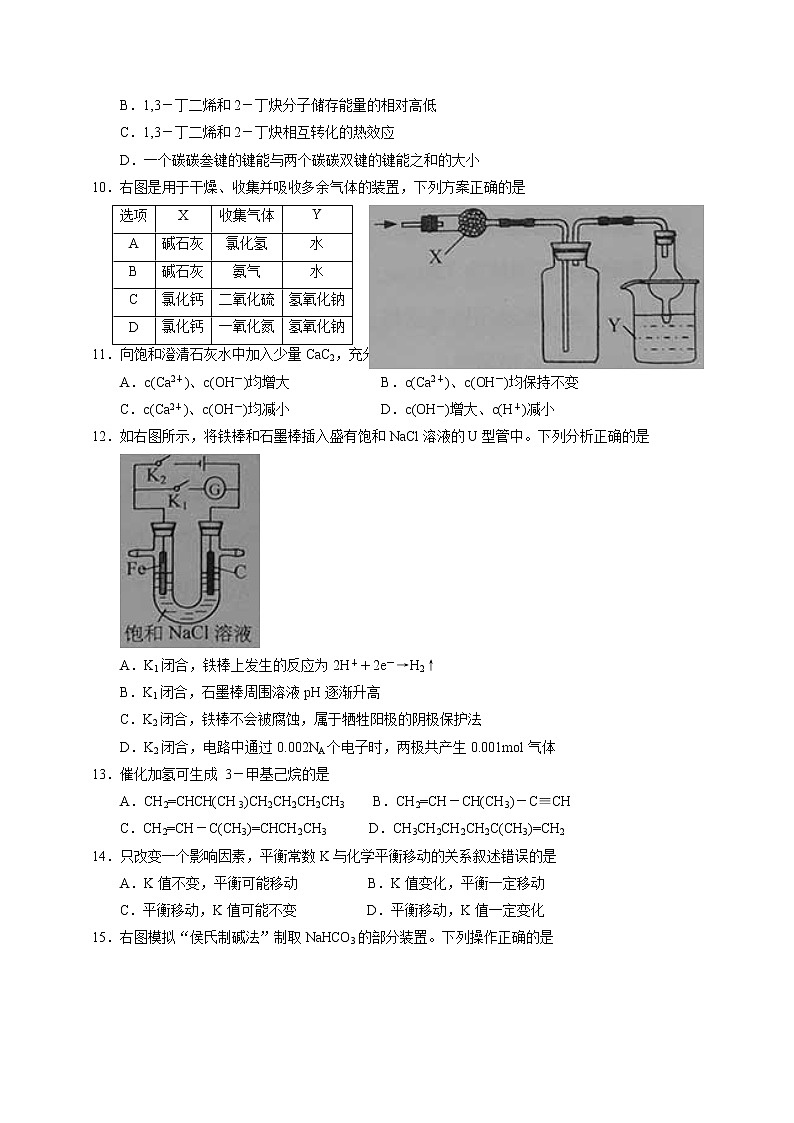
10.右图是用于干燥、收集并吸收多余气体的装置,下列方案正确的是
选项
X
收集气体
Y
A
碱石灰
氯化氢
水
B
碱石灰
氨气
水
C
氯化钙
二氧化硫
氢氧化钠
D
氯化钙
一氧化氮
氢氧化钠
11.向饱和澄清石灰水中加入少量CaC2,充分反应后恢复到原来的温度,所得溶液中
A.c(Ca2+)、c(OH-)均增大 B.c(Ca2+)、c(OH-)均保持不变
C.c(Ca2+)、c(OH-)均减小 D.c(OH-)增大、c(H+)减小
12.如右图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中。下列分析正确的是
A.K1闭合,铁棒上发生的反应为2H++2e-→H2↑
B.K1闭合,石墨棒周围溶液pH逐渐升高
C.K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法
D.K2闭合,电路中通过0.002NA个电子时,两极共产生0.001mol气体
13.催化加氢可生成 3-甲基己烷的是
A.CH2=CHCH(CH3)CH2CH2CH2CH3 B.CH2=CH-CH(CH3)-C≡CH
C.CH2=CH-C(CH3)=CHCH2CH3 D.CH3CH2CH2CH2C(CH3)=CH2
14.只改变一个影响因素,平衡常数K与化学平衡移动的关系叙述错误的是
A.K值不变,平衡可能移动 B.K值变化,平衡一定移动
C.平衡移动,K值可能不变 D.平衡移动,K值一定变化
15.右图模拟“侯氏制碱法”制取NaHCO3的部分装置。下列操作正确的是
A.a通入CO2,然后b通入NH3,c中放碱石灰
B.b通入NH3,然后a通入CO2,c中放碱石灰
C.a通入NH3,然后b通入CO2,c中放蘸稀硫酸的脱脂棉
D.b通入CO2,然后a通入NH3,c中放蘸稀硫酸的脱脂棉
16.含有砒霜(As2O3)的试样和锌、盐酸混合反应,生成的砷化氢(AsH3)在热玻璃管中完全分解成单质砷和氢气。若砷的质量为1.50mg,则
A.被氧化的砒霜为1.98mg
B.分解产生的氢气为0.672ml
C.和砒霜反应的锌为3.90mg
D.转移的电子总数为6×10―5NA
17.用FeCl3溶液腐蚀印刷电路板上的铜,所得的溶液中加入铁粉。对加入铁粉充分反应后的溶液分析合理的是
A.若无固体剩余,则溶液中一定有Fe3+
B.若有固体存在,则溶液中一定有Fe2+
C.若溶液中有Cu2+,则一定没有固体析出
D.若溶液中有Fe2+,则一定有Cu析出
三、选择题(本题共20分,每小题4分,每小题只有一个或两个正确选项。只有一个正确选项的,多选不给分;有两个正确选项的,选对一个给2分,选错一个,该小题不给分)
18.某未知溶液可能含Cl-、CO32-、Na+、SO42-、Al3+。将溶液滴在蓝色石蕊试纸上,试纸变红。取少量试液,滴加硝酸酸化的氯化钡溶液,有白色沉淀生成;在上层清液中滴加硝酸银溶液,产生白色沉淀。下列判断合理的是
A.一定有Cl- B.一定有SO42- C.一定没有Al3+ D.一定没有CO32-
19.下列反应与Na2O2+SO2→Na2SO4相比较,Na2O2的作用相同的是
A.2Na2O2+2CO2→2Na2CO3+O2 B.2Na2O2+2SO3→2Na2SO4+O2
C.2Na2O2+H2SO4→Na2SO4+H2O2 D.3Na2O2+Cr2O3→2Na2CrO4+Na2O
20.向等物质的量浓度的NaOH和Na2CO3的混合液中加入稀盐酸。下列离子方程式与事实不相符的是
A.OH-+CO32-+2H+→HCO3-+H2O B.2OH-+CO32-+3H+→HCO3-+2H2O
C.2OH-+CO32-+4H+→CO2↑+2H2O D.OH-+CO32-+3H+→CO2↑+2H2O
21.室温下,甲、乙两烧杯均盛有5mlpH=3的某一元酸溶液,向乙烧杯中加水稀释至pH=4,关于甲、乙两烧杯中溶液的描述正确的是
A.溶液的体积:10V甲≤V乙
B.水电离出的OH-浓度:10c(OH-)甲≤c(OH-)乙
C.若分别用等浓度的NaOH溶液完全中和,所得溶液的pH:甲≤乙
D.若分别与5mlpH=11的NaOH溶液反应,所得溶液的pH:甲≤乙
22.已知:2[NaAl(OH)4]+CO2→2Al(OH)3↓+Na2CO3+H2O。向含2molNaOH、1molBa(OH)2、2mol[NaAl(OH)4]的混合液中慢慢通入CO2,则通入CO2的量和生成沉淀的量的关系正确的是
选项
A
B
C
D
n(CO2)(mol)
2
3
4
6
n(沉淀)(mol)
1
2
3
3
四、(本题共12分)
合成氨工艺的一个重要工序是铜洗,其目的是用铜液[醋酸二氨合铜(I)、氨水]吸收在生产过程中产生的CO和CO2等气体。铜液吸收CO的反应是放热反应,其反应方程式为:
Cu(NH3)2Ac+CO+NH3[Cu(NH3)3CO]Ac
完成下列填空:
23.如果要提高上述反应的反应速率,可以采取的措施是_________。(选填编号)
a.减压 b.增加NH3的浓度 c.升温 d.及时移走产物
24.铜液中的氨可吸收二氧化碳,写出该反应的化学方程式。
_________________________________________
25.简述铜液吸收CO及铜液再生的操作步骤(注明吸收和再生的条件)。
__________________________________________
26.铜液的组成元素中,短周期元素原子半径从大到小的排列顺序为____________________。其中氮元素原子最外层电子排布的轨道表达式是_________________________。通过比较_____________可判断氮、磷两种非金属元素的非金属性强弱。
27.已知CS2与CO2分子结构相似,CS2的电子式是____________。CS2熔点高于CO2,其原因是__________。
五、(本题共12分)
硫在自然界中以游离态和多种化合态形成出现。硫的化合物大多具有氧化性或还原性。许多金属硫化物难溶于水。
完成下列填空:
28.硫化氢具有还原性,可以和许多氧化剂反应。在酸性条件下,H2S和KMnO4反应生成S、MnSO4、K2SO4和H2O,写出该反应的化学方程式。_________________________________
29.石油化工的废气中有H2S。写出从废气中回收单质硫的两种方法(除空气外,不使用其他原料),以化学方程式表示。_____________________、______________________
30.室温下,0.1mol/L的硫化钠溶液和0.1mol.L的碳酸钠溶液,碱性更强的是_______,其原因是________。
已知:H2S:Ki1=1.3×10-7 Ki2=7.1×10-15
H2CO3:Ki1=4.3×10-7 Ki2=5.6×10-11
31.向ZnSO4溶液中滴加饱和H2S溶液,没有沉淀生成,继续滴加一定量的氨水后,生成ZnS沉淀。用电离平衡原理解释上述现象。__________________________
32.将黑色的Fe2S3固体加入足量盐酸中,溶液中有淡黄色固体生成,产物还有____、______。过滤,微热滤液,然后加入过量的氢氧化钠溶液,可观察到的现象是______________。
六、(本题共12分)
在精制饱和食盐水中加入碳酸氢铵可制备小苏打(NaHCO3),并提取氯化铵作为肥料或进一步提纯为工业氯化铵。
完成下列填空:
33.写出上述制备小苏打的化学方程式。________________________
34.滤出小苏打后,母液提取氯化铵有两种方法:
①通入氨,冷却、加食盐,过滤
②不通氨,冷却、加食盐,过滤
对两种方法的评价正确的是__________(选填编号)
a.①析出的氯化铵纯度更高 b.②析出的氯化铵纯度更高
c.①的滤液可直接循环使用 d.②的滤液可直接循环使用
35.提取的NH4Cl中含少量Fe2+、SO42-。将产品溶解,加入H2O2,加热至沸,再加入BaCl2溶液,过滤,蒸发结晶,得到工业氯化铵。
加热至沸的目的是____________________________。
滤渣的主要成分是_________________、_________________。
36.称取1.840g小苏打样品(含少量NaCl),配成250ml溶液,取出25.00ml用0.1000mol/L盐酸滴定,消耗盐酸21.50ml。
实验中所需的定量仪器除滴定管外,还有__________________。
选甲基橙而不选酚酞作为指示剂的原因是_________________。
样品中NaHCO3的质量分数为__________________。(保留3位小数)
37.将一定质量小苏打样品(含少量NaCl)溶于足量盐酸,蒸干后称量固体质量,也可测定小苏打的含量。若蒸发过程中有少量液体溅出,则测定结果_______。(选填“偏高”、“偏低”或“无影响”)
七、.(本题共12分)
氯气和氯乙烯都是重要的化工产品,年产量均在107t左右。氯气的实验室制备和氯乙烯的工业生产都有多种不同方法。
完成下列填空:
38.实验室制取纯净的氯气,除了二氧化锰、浓盐酸和浓硫酸,还需要_________、________(填写试剂或溶液名称)
39.实验室用2.00mol/L的盐酸和漂粉精[成分为Ca(ClO)2、CaCl2]反应生成氯气、氯化钙和水,若产生2.24L(标准状况)氯气,发生反应的盐酸为_________m,l。
40.实验室通常用向上排空气法收集氯气。设计一个简单实验,验证所收集的氯气中是否含有空气。
_________________
41.工业上用电石-乙炔法生产乙烯的反应如下:
CaO+3CCaC2+CO
CaC2+2H2O→HC≡CH↑+Ca(OH)2
HC≡CH↑+HClCH2=CHCl
电石-乙炔法的优点是流程简单,产品纯度高,而且不依赖于石油资源。
电石-乙炔法的缺点是___________________、_____________________。
42.乙烷和氯气反应可制得ClCH2CH2Cl,ClCH2CH2Cl加热分解得到氯乙烯和氯化氢。设计一种以乙烯和氯气为原料制取氯乙烯的方案(其他原料自选),用化学方程式表示(不必注明反应条件)。
要求:①反应产生的氯化氢必须用于氯乙烯的制备;②不再产生其他废液。
___________________________________
八、(本题共8分)
许多有机化合物具有酸碱性。
完成下列填空:
43.苯酚、苯甲醇、苯甲酸、碳酸的酸性由强到弱的顺序为:_____________________________________。苯胺()具有______。(相同“酸性”、“碱性”或“中性”)
44.常常利用物质的酸碱性分离混合液。某一混合液含苯酚、苯甲醇、苯甲酸和苯胺四种物质,其分离方案如下图:
已知:苯甲醇、苯甲酸、苯胺微溶于水。
A、B、C分别是:A_______ B_________ C_____________
上述方案中,若首先仅仅将苯甲酸与其他三种物质分开,则应加入________。
45.欲将转化为,则应加入____________。
九、(本题共14分)
M是一种治疗直肠癌和小细胞肺癌药物的主要成分,其结构式为(不考虑立体结构,其中R为)。M的一条合成路线如下(部分反应试剂和条件略去)。
完成下列填空:
46.写出反应类型。 反应①_________ 反应③__________
47.写出反应试剂和反应条件。反应②_________ 反应④__________
48.写出结构简式。 B_____________ C_____________
49.写出一种满足下列条件的A的同分异构体的结构简式。
(1)能与FeCl3溶液发生显色反应;(2)能发生银镜反应;(3)分子中有5种不同化学环境的氢原子。
50.丁烷氯代可得到2-氯丁烷,设计一条从2-氯丁烷合成1,3-丁二烯的合成路线。
(合成路线常用的表示方法为:AB……目标产物)
51.已知:R-CO-NHR′与R-CO-OR′的化学性质相似。
从反应④可得出的结论是:_______________________。
十、(本题共14分)
硫有多种含氧酸,亚硫酸(H2SO3)、硫酸(H2SO4)、焦硫酸(H2SO4·SO3)、硫代硫酸(H2S2O3)等等,其中硫酸最为重要,在工业上有广泛的应用。在实验室,浓硫酸是常用的干燥剂。
完成下列计算:
52.焦硫酸(H2SO4·SO3)溶于水,其中的SO3都转化为硫酸。若将445g焦硫酸溶于水配成4.00L硫酸,该硫酸的物质的量浓度为________mol/。
53.若以浓硫酸吸水后生成的H2SO4·H2O计算,250g质量分数为98%的硫酸能吸收多少g水?
54.硫铁矿是工业上制硫酸的主要原料。硫铁矿氧化焙烧的化学反应如下:
3FeS2+8O2→Fe3O4+6SO2 4FeS2+11 O2→2Fe2O3+8SO2
若48mol FeS2完全反应耗用氧气2934.4L(标准状况),计算反应产物中Fe3O4与Fe2O3物质的量之比。
55.用硫化氢制取硫酸,既能充分利用资源又能保护环境,是一种很有发展前途的制备硫酸的方法。
硫化氢体积分数为0.84的混合气体(H2S、H2O、N2)在空气中完全燃烧,若空气过量77%,计算产物气体中SO2体积分数(水是气体)。(已知空气组成:N2体积分数0.79、O2体积分数0.21)
2014年上海高考题化学答案
一、选择题
1.D 2.A 3.A 4.B 5.A
二、选择题
6. B 7.D 8.A 9.D 10.C 11.B 12.B 13.C 14.D 15.C 16.C 17.B
三、选择题
18.BD 19.D 20.C 21.AD 22.AC
四、(本题共12分)
23. bc
24. 2NH3+CO2+H2O→ (NH4)2CO3
(NH4)2CO3+ CO2+H2O→2NH4HCO3
25.①低温加压下吸收CO;②然后将铜洗液转移至另一容器中;③高温低压下释放CO,然后将铜洗液循环利用
26.C>N>O>H ; ;NH3和PH3的稳定性
27.
CS2和CO2都是分子晶体,CS2相对分子质量大,分子间作用力大。
五、(本题共12分)
28.3H2SO4+5H2S+2KMnO4→5S↓+2Mn SO4+K2 SO4+8H2O
点燃 Δ 点燃
29.2H2S+3O2 2SO2+2 H2O, 2H2S+SO2→3S+2 H2O;H2S S+H2或2 H2S+ O2 2S+2 H2O
30.硫化钠溶液;硫化氢的Ki2小于碳酸的Ki2,硫化钠更易水解。
31.饱和H2S溶液中电离产生的S2-很少,因此没有沉淀。加入氨水后,促进H2S电离,S2-离子浓度增大,有沉淀产生。
32.FeCl2 、H2S ;先有白色沉淀生成,然后沉淀转化为灰绿色,最终转化为红褐色。
六、(本题共12分)
33.NH4HCO3+NaCl→NaHCO3↓+NH4Cl
34.ad
35.使Fe3+完全水解为Fe(OH)3;Fe(OH)3 、BaSO4
36.电子天平、 250mL容量瓶 ;选用酚酞作为指示剂,不能确定滴定终点;0.982
37.偏高
七、(本题共12分)
38.饱和氯化钠溶液、氢氧化钠溶液
39. 100
40.用试管收集氯气,收集满后将试管倒立在氢氧化钠溶液中,观察试管内有无残留气体。
41.高耗能 会污染环境
42.答案示例:
CH2=CH2+Cl2→CH2ClCH2Cl CH2ClCH2Cl→ CH2=CHCl+HCl
HC CH+HCl→CH2=CHCl
八、(本题共8分)
43.苯甲酸>碳酸>苯酚>苯甲醇 碱性
44. NaOH溶液或Na2CO3 溶液 CO2 盐酸 NaHCO3溶液
45. H2O
九(本题共14分)
46.取代反应 氧化反应
47. C2H5OH,浓硫酸,加热
(1)NaOH/ H2O,加热
(2)盐酸;或盐酸,加热
COOC2H5
48.
COOH H2N
COOC2H5
R
CH2CHO
49
H3C CH3
OH
50.CH3CHClCH2CH3 CH3CH=CHCH3 Br2 /CCl 4
CH3CHBrCHBrCH3 CH2=CHCH=CH2
51. 酰胺(肽键)水解比醋水解困难
十:
52. 1.25
53 . 250×98%÷98×14=40g
54. 2934.4÷22.4=131mol 设Fe3O4 amol Fe2O3 bmol
3a+2b=48 8a+11÷2b=131 a=4 b=18
n(Fe3O4):n(Fe2O3)=2:9
55. 设混合气体为1体积,0.84体积硫化氢完全燃烧生成0.84体积二氧化硫和0.84体积水,消耗1.26体积氧气。
所需空气为1.26÷0.21×1.77=10.62体积
φ(SO2)=0.84÷(10.62-1.26+1.84)=0.075
《高考真题》精品解析:2022年海南省高考真题化学试题(解析版): 这是一份《高考真题》精品解析:2022年海南省高考真题化学试题(解析版),共23页。试卷主要包含了 化学物质在体育领域有广泛用途, 在2,1mlB等内容,欢迎下载使用。
《高考真题》精品解析:2022年湖北省高考真题化学试题(原卷版): 这是一份《高考真题》精品解析:2022年湖北省高考真题化学试题(原卷版),共10页。试卷主要包含了 下列实验装置或现象错误的是等内容,欢迎下载使用。
《高考真题》精品解析:2022年湖北省高考真题化学试题(解析版): 这是一份《高考真题》精品解析:2022年湖北省高考真题化学试题(解析版),共20页。试卷主要包含了 下列实验装置或现象错误的是等内容,欢迎下载使用。












