




人教版 (新课标)必修1第二节 化学计量在实验中的应用示范课课件ppt
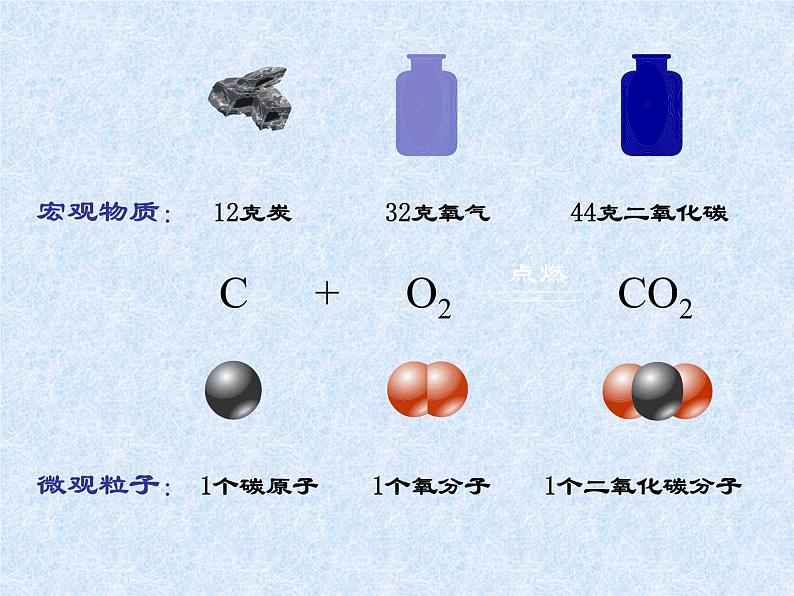
展开微观粒子: 1个碳原子 1个氧分子 1个二氧化碳分子
宏观物质: 12克炭 32克氧气 44克二氧化碳
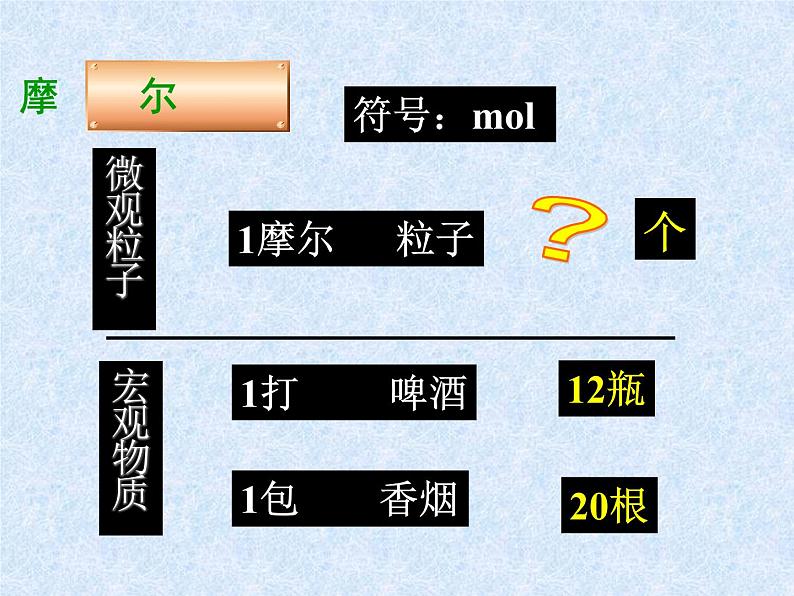
①国际单位制七个基本物理量之一,符号为n
② 表示一定数目粒子的集合体。
③单位:摩尔,简称:摩,符号为ml
(1)“物质的量”是一个整体,不可拆开。 (2)物质的量仅用于计量微观粒子,不适用于宏观物质。(3)使用物质的量时一般用化学式表示,若用中文,则必须指明微粒的种类。如:1摩尔H、1摩尔CO2 、 1ml钠离子等。
(A)1 摩尔氧(B)1 摩尔H(C)2 摩尔大米(D)硫酸的物质量为3摩尔(E)0.5 摩 二氧化碳
思考:判断下列说法是否正确
1摩尔 粒子
指质子数为6,中子数为6的碳原子
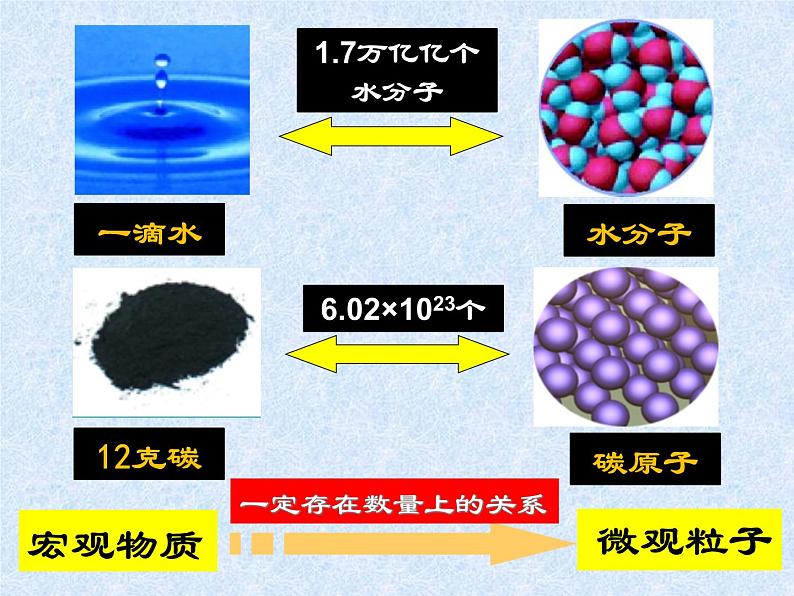
国际上规定:1ml任何粒子所含的粒子数与0.012kg 12C中所含的碳原子数相同。
(1)等于0.012kg 12C所含的原子数。(2) 约为6.02×1023 ml-1(3)含义:1ml 任何粒子的粒子数,叫阿伏加德罗常数,即NA。
麦粒的总数= 1 + 2 + 4 + 8 + … + 263 = 264 – 1 =1.845 × 1019
这竟是全世界在2000年内所生产的全部小麦!
2、如果把6.02×1023个直径为2.5cm的硬币排成一行,可以来回于地球与太阳之间240.8亿次
1、3.01×1023个CO2的物质的量是多少?
2、1.204×1024个H2O 的物质的量是多少?
3、2 ml Mg变成Mg2+时失去电子数是多少?
4、N个 CO2的物质的量是多少?
2×2×6.02×1023 个
微观: 1个碳原子 1个氧分子 1个二氧化碳分子
宏观: 12克炭 32克氧气 44克二氧化碳
6.02×1023个 6.02×1023个 6.02×1023个
1摩尔 1摩尔 1摩尔
1ml12C的质量是多少克?
1ml其他物质的质量是多少克?
3、分析以上计算结果可得出什么规律?
结论:1ml任何粒子或物质的质量以克为单位时,其数值都与该粒子的相对原子质量或相对分子质量相等。
6.02×1023个水分子1ml
6.02×1023个铝原子1ml
物质的量的意义:是联系宏观和微观的纽带或桥梁。表达式:
2、1ml任何物质的质量,我们可以通过摩尔质量求出,若要通过质量求体积 还要知道什么?
3、下面就请同学们计算填表:(气体是指相同状况下)
分析上述两表,得出什么结论?
1、1ml不同固态或液态物质,体积不同。2、在相同条件下,1ml不同气体物质体积基本相同。
那么不同状态的物质,体积大小跟哪些因素有关呢?举一个例子:同学们在做操的时候,你们班在操场上所占的面积和哪些因素有关?
首先我们来分析1ml固态和液态物质体积为什么不同。
固态结构微粒间的距离很小
液态结构微粒间的距离也小
1ml固体或液体物质的体积只与构成这种物质的粒子大小有关,由于不同的物质粒子大小不相等,所以1ml不同的固体和液体体积大小不同。
下面我们来分析1ml不同气态物质在相同条件下体积为什么基本相同。
将1ml液态水加热变成1ml气态水,体积将会发生变化吗?
原因:由液态到气态,粒子间距显著增大。
分子平均距离是分子直径的10倍左右
现在我们来分析一下温度和压强对气体体积的影响
结论:温度升高,体积增大,温度降低,体积减小
原因:温度升高,粒子间距增大,温度降低,粒子间距减小。
结论:压强增大,体积减小,压强减小,体积增大
原因:压强增大,粒子间距减小,压强减小,粒子间距增大。
影响1ml物质体积大小的因素
如果温度和压强一定,则微粒间的平均距离一定,体积也就一定。
(相同,但不一定是22.4L)
PV = nRT(P:压强 V:体积 T:热力学温度)
国际单位制(SI)的7个基本物理量
如何配制100ml 1.00ml/L的NaCl溶液?
归纳:1、实验过程中需要什么仪器? 2、实验步骤如何进行?
托盘天平或量筒、烧杯、玻璃棒、容量瓶、胶头滴管、
① 计算② 称量(托盘天平或量筒)③ 溶解(烧杯、玻璃棒)④ 转移和洗涤( 容量瓶、玻璃棒)⑤ 定容(胶头滴管)⑥ 摇匀⑦ 装瓶贴签
配制100mL 1.00ml/L 的NaCl溶液
常用的有: 100ml. 250ml. 500ml.1000ml
配制溶液时,选用和所配溶液体积相等或稍大的容量瓶进行配液.
1.使用前检查是否漏水
2.使用前用蒸馏水洗净
3.不准将溶质直接转移入容量瓶加水溶解
溶液注入容量瓶前需恢复到室温,这是因为溶质在烧杯内稀释或溶解时常有热效应(如NaOH、H2SO4)。未等溶液冷却就定容,会使浓度偏高。
1)称量时左盘高,右盘低
2)称量时称量物放在右盘,而砝码放在左盘
3)量筒量取液体药品时仰视读数
4)量筒量取液体药品时俯视读数
2、溶解、转移、洗涤产生误差
6)未洗涤溶解用的玻璃棒和烧杯
7)洗涤液未转入容量瓶中而倒入废液缸中
5)溶解过程中有少量液体溅出烧杯
10)定容时液面低于刻度线
11)未等溶液冷却就定容
12)定容后发现液面高于刻度线后,用滴管吸出少量溶液
13)摇匀后发现液面低于刻度再加水
14.原容量瓶洗净后未干燥
15.容量瓶中含有少量的水
16.往容量瓶中加水时有少量加到瓶外
有一瓶18.4ml/L的硫酸溶液1L,现往里加水加到10L,请问,此溶液中H2SO4总的物质的量有没有变化?物质的量浓度有没有变化?如果有请计算出来。
n(H2SO4)浓=n(H2SO4)稀 C浓×V浓 = C稀×V稀18.4ml/L×1L=C稀×10L C稀=1.84ml/L
如果把6.02×1023个直径为2.5cm的硬币排成一行,可以来回于地球与太阳之间240.8亿次。
如果把 6.02×1023 粒米给全球60亿人吃,每人每天吃一斤,要吃14万年,所以物质的量只用来表示原子、分子、离子等微观粒子。
2020-2021学年第二节 化学计量在实验中的应用教学ppt课件: 这是一份2020-2021学年第二节 化学计量在实验中的应用教学ppt课件,共20页。
人教版 (新课标)必修1第二节 化学计量在实验中的应用图片ppt课件: 这是一份人教版 (新课标)必修1第二节 化学计量在实验中的应用图片ppt课件,共26页。
高中化学第一节 物质的分类教案配套课件ppt: 这是一份高中化学第一节 物质的分类教案配套课件ppt,共30页。PPT课件主要包含了测测你的眼力,清洁用品,思考·交流,H2SO4,HCl,HNO3,H2S,含氧酸,无氧酸,一元酸等内容,欢迎下载使用。














