




人教版 (新课标)必修1第二节 离子反应多媒体教学ppt课件
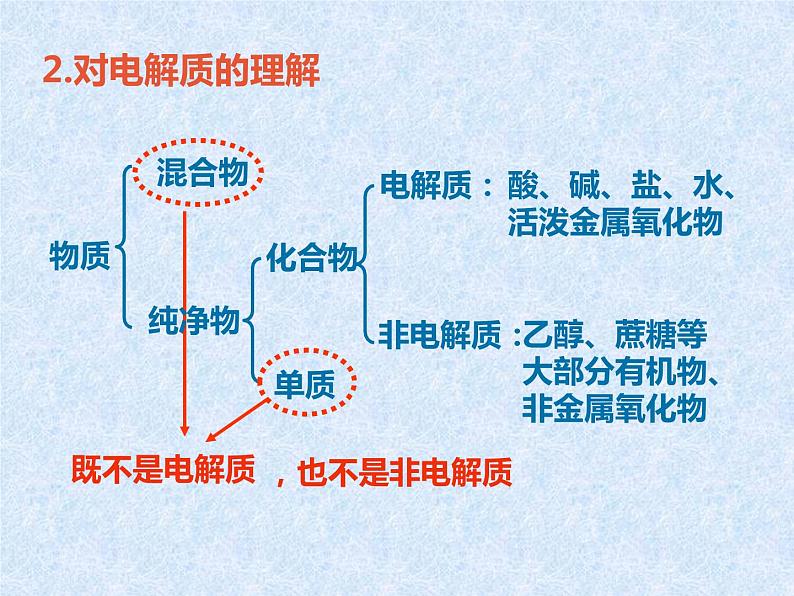
展开1.概念:在水溶液中或熔融状态下能够导电的化合物。上述状态下不导电的化合物是非电解质。 电解质: 如 H2SO4、NaOH、KNO3等; 酸、碱、盐、部分金属氧化物和水是电解质。非电解质:乙醇、苯、蔗糖等大部分有机物,CO2,SO2等大部分非金属氧化物,NH3。
乙醇、蔗糖等大部分有机物、非金属氧化物
酸、碱、盐、水、活泼金属氧化物
(1)铁丝和盐酸能导电,所以二者是电解质,液态硫酸不导电,所以硫酸是非电解质,对吗?并分析。(2) 蔗糖和澄清石灰水是电解质吗?(3)某些难溶于水的化合物。如BaSO4、AgCl等,由于它们的 溶解度太小,难测其水溶液的导电性,他们是电解质吗?答案:(1)不对。因为电解质和非电解质都是化合物,而铁是单质,盐酸是混合物,故两者既不是电解质,也不是非电解质;硫酸溶液能导电,硫酸是电解质。(2)不是。蔗糖在水溶液中和熔融状态下都不导电,是非电解质,澄清石灰水是溶液,是混合物。(3) 是,熔融状态下导电,包括部分金属氧化物
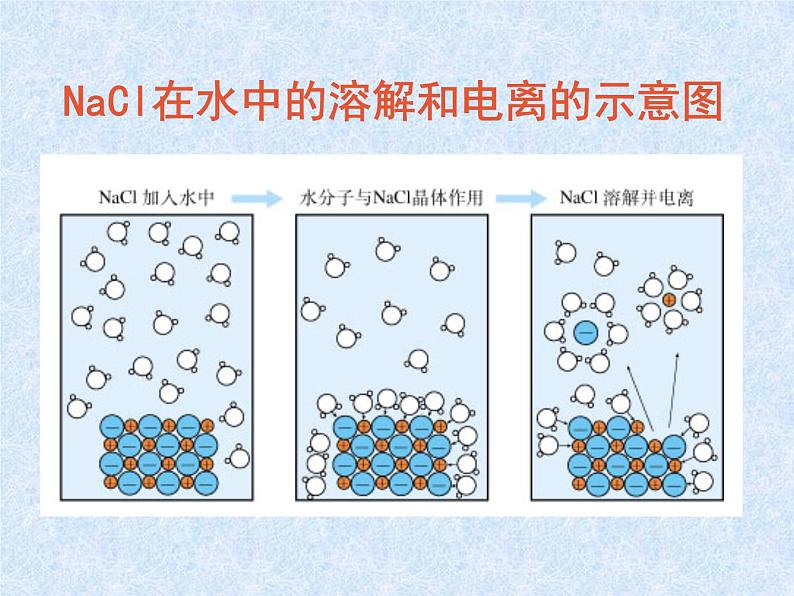
1.概念:电解质在溶于水或受热熔化时,离解成自由移动的离子的过程。
为什么电解质在水溶液里或熔融状态下能够导电?氢氧化钡固体和液态硫酸为什么不能导电?
【提示】因为此时它们发生了电离。
结果:产生了能够自由移动的离子。
NaCl在水中的溶解和电离的示意图
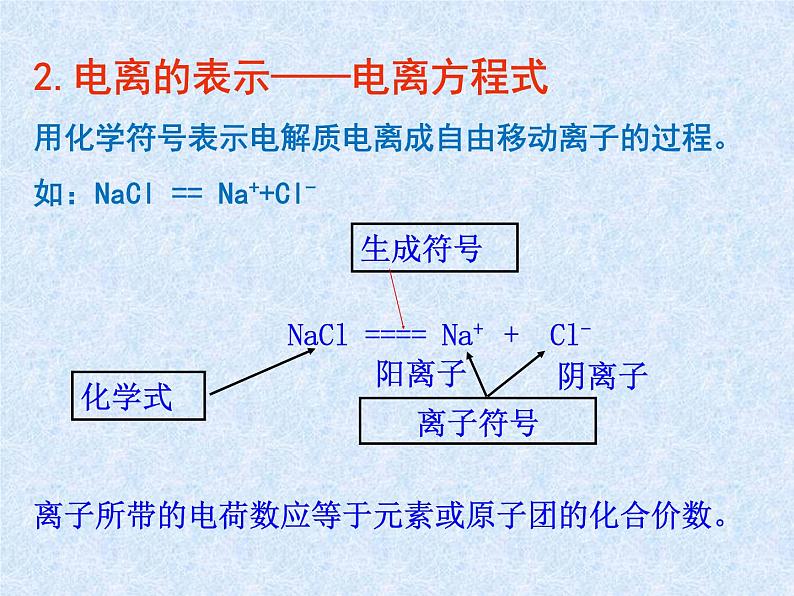
2.电离的表示——电离方程式用化学符号表示电解质电离成自由移动离子的过程。如:NaCl == Na++Cl-
NaCl ==== Na+ + Cl-
离子所带的电荷数应等于元素或原子团的化合价数。
Al2(SO4)3==2Al3++3SO42-
(2)书写步骤:①阴阳离子部分拆开写,但原子团不能拆,例如NO3-、SO42-、OH-、NH4+、CO32-等不能拆。②构成物质的原子或原子团的个数在书写成离子时为化学计量数。
③电离方程式左右两边正负电荷之和相等。
下列电离方程式正确的是( )A.MgCl2==Mg+2 + 2Cl-B.NaHCO3==Na+ + H+ + CO32-C.H2SO4==H 2+ + SO42-D.Ba(OH)2==Ba2++2OH-
【提示】NaHCO3 的第一步电离应该电离出Na+ 和HCO3- 。
①金属铜 ②固态NaCl ③SO2 ④H2SO4 ⑤碳棒 ⑥酒精水溶液 ⑦KOH溶液 ⑧蔗糖 ⑨ KOH ⑩MgO ⑪熔融状态的KNO3 ⑫葡萄糖 电解质: ; 非电解质: ;能导电: 。
电解质是指在水溶液中或熔融状态下能自身电离而导电的化合物。
1.写出下列酸的电离方程式: HCl 、HNO3、H2SO4
H2SO4 == 2H+ + SO42-
HCl == H+ + Cl-
HNO3 == H+ + NO3-
▲酸:电离时生成的阳离子全部是H+的化合物。
2.写出下列碱的电离方程式: NaOH、KOH、Ba(OH)2
NaOH == Na+ + OH-
▲碱:电离时生成的阴离子全部是OH-的化合物。
Ba(OH)2 == Ba2+ + 2OH-
KOH == K+ + OH-
3.写出下列盐的电离方程式: NaCl、NH4NO3、Fe2(SO4)3、NaHSO4
NaCl == Na+ + Cl-
▲盐:电离时能生成金属离子(铵根离子)和酸根离子的化合物。
NH4NO3 == NH4++ NO3-
Fe2(SO4)3 == 2Fe3+ + 3SO42-
NaHSO4== Na+ + H+ + SO42-
1、在水溶液中或熔融状态下能导电的物质是电解质( )2、电解质在水溶液中的电离程度都是相同的( )3、强电解质溶液的导电性比弱电解质溶液的导电性强( )
在水溶液中能全部电离的电解质。包括强酸、强碱、大多数盐和活泼金属氧化物。
在水溶液中部分电离的电解质。包括弱酸、弱碱、水。
溶液的导电性与溶液中离子的浓度及离子所带电荷有关,离子浓度越大,离子所带电荷越多,溶液导电性越大。
§2.2 离子反应 离子反应及其发生的条件(2课时)
了解离子反应的本质;正确书写离子方程式。(重点)
离子反应:有离子参加的反应
BaCl2+CuSO4=BaSO4↓+CuCl2
(1)CuSO4溶液与BaCl2溶液的反应为什么说是离子之间的反应?(2)CuSO4固体与BaCl2固体充分混合,能发生反应吗?
混合前,溶液中各存在哪些离子?请写出电离方程式:
混合后,宏观上看到什么现象?
CuSO4==Cu2++SO42-
BaCl2==Ba2++2Cl-
化学反应方程式是 CuSO4+ BaCl2== BaSO4 ↓+ CuCl2反应的实质是 Ba2++ SO42-==BaSO4 ↓
定义:用实际参加反应的离子的符号来表示离子反应的式子叫做离子方程式。
如何正确书写一个离子反应的离子方程式呢?
3.离子方程式的书写步骤
一写:写出正确的化学方程式(基础) CuSO4+ BaCl2== BaSO4 ↓+ CuCl2
二拆:把易溶于水、易电离的物质拆写成离子形式,难溶于水、难电离的物质(如水)以及气体、单质、氧化物等用化学式表示(关键)Cu2++SO42- + Ba2++2Cl- ==BaSO4 ↓+ Cu2++2Cl-
三删:删去方程式两边不参加反应的离子(包括离 子的存在形式和化学计量数都必须相同), 最后化学计量数比化为整数比。Cu2++SO42- + Ba2++2Cl- ==BaSO4 ↓+ Cu2++2Cl-
四查:①是否符合客观规律; ②原子个数是否守恒; ③电荷是否守恒; ④离子的改写是否正确。 Ba2++SO42-=BaSO4↓
其实每一步都很重要哦!
一写、二拆、三删、四查
⑴Na2CO3 溶液与澄清石灰水反应 有白色 CaCO3 沉淀生成 ;⑵Na2CO3 溶液与 CaCl2 溶 液反应也有白色 CaCO3 沉淀生成 ;请问这两种反应的实质是否相同?化学方程式分别为:⑴ , ⑵ ; 离子反应方程式分别为:⑴ ,⑵ ;
离子方程式与一般的化学方程式不同,它不仅可以表示某一个具体的化学反应,而且还可以表示同一类型的离子反应。
课本实验2-2
请写出下列酸碱中和反应的化学方程式和离子方程式:(1)盐酸与氢氧化钠溶液混合________________________________________,_____________________________。(2)硫酸与氢氧化钾溶液混合_________________________________________,____________________________。(3)硝酸与氢氧化钡溶液混合_______________________________________,_____________________________。
酸与碱中和反应的实质:由酸电离出的H+与由碱电离出来的OH-结合生成了H2O。
是否所有的酸碱中和反应都能用 H++OH-=H2O来表示?
1 Cu(OH)2 + HCl ——2 NH3·H2O + HNO3 ——3 NaOH + CH3COOH ——4 Ba(OH)2 + H2SO4 ——5 硫酸和氢氧化镁 :6 盐酸和氢氧化铁:7 硝酸和氢氧化钠:8 硫酸和氢氧化铜:
人教版 (2019)必修 第一册第二节 离子反应多媒体教学ppt课件: 这是一份人教版 (2019)必修 第一册第二节 离子反应多媒体教学ppt课件,共22页。PPT课件主要包含了电解质和非电解质,电解质的电离,学习目标与核心素养,学习目标,核心素养,课前导入,物质的导电性实验探究,水溶液,熔融状态,化合物等内容,欢迎下载使用。
人教版 (新课标)必修1第二节 富集在海水中的元素--氯课前预习ppt课件: 这是一份人教版 (新课标)必修1第二节 富集在海水中的元素--氯课前预习ppt课件,共32页。PPT课件主要包含了新闻链接,谈一谈,想一想,氯气的物理性质,黄绿色气体,密度比空气大,有刺激性气味有毒,水溶性,氯气的化学性质,氯原子的结构等内容,欢迎下载使用。
高中化学人教版 (新课标)必修1第二节 几种重要的金属化合物教学ppt课件: 这是一份高中化学人教版 (新课标)必修1第二节 几种重要的金属化合物教学ppt课件,共39页。PPT课件主要包含了钠的重要化合物,思考与交流,实验3-5,Na2O2的用途,请思考,碳酸钠和碳酸氢钠,科学探究,振荡时间长时可溶解,固体量减小,溶液变红较深等内容,欢迎下载使用。













