





高中化学人教版 (新课标)必修1第三节 氧化还原反应多媒体教学ppt课件
展开
这是一份高中化学人教版 (新课标)必修1第三节 氧化还原反应多媒体教学ppt课件,共16页。PPT课件主要包含了思考与交流,分类标准得氧失氧,同时发生,+1钾钠氢与银,+2钙镁钡与锌,+3金属元素铝,+3铁元素,助记词等内容,欢迎下载使用。
1.请举几个氧化反应和还原反应的实例,指出这类化学反应的分类标准是什么?
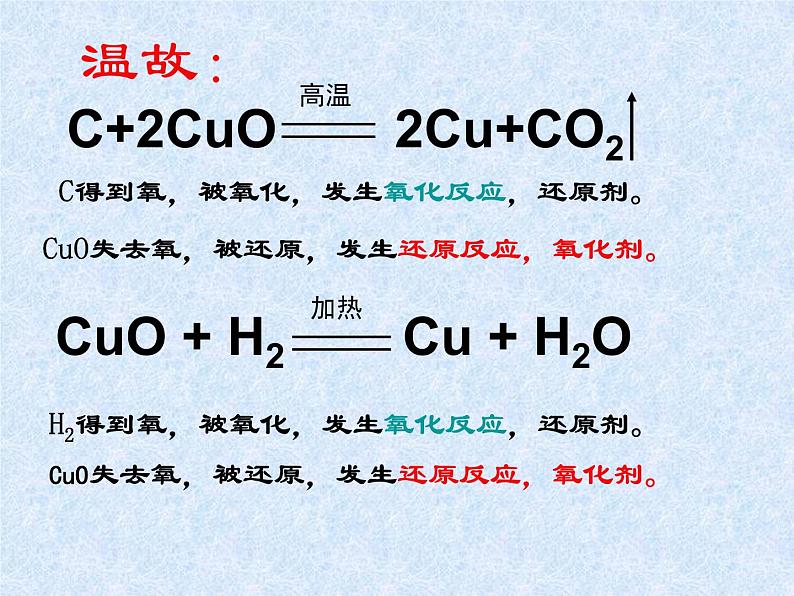
CuO + H2 = Cu + H2O 中CuO失氧,发生还原反应;H2得氧,发生氧化反应。
2CuO + C = 2Cu + CO2中CuO失氧,发生还原反应;C得氧,发生氧化反应。
2.氧化反应和还原反应是分别独立进行的吗?
氧化反应和还原反应总是同时进行的。
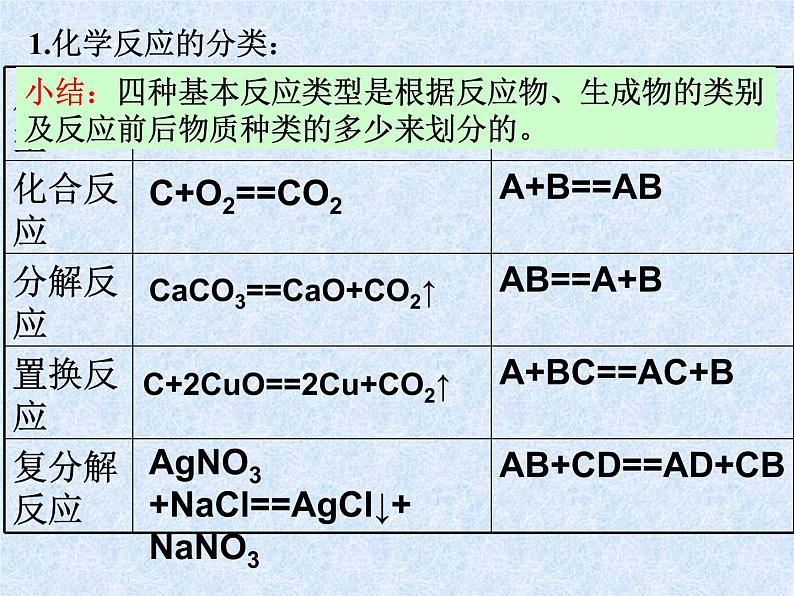
小结:四种基本反应类型是根据反应物、生成物的类别及反应前后物质种类的多少来划分的。
CaCO3==CaO+CO2↑
C+2CuO==2Cu+CO2↑
AgNO3+NaCl==AgCl↓+NaNO3
(1)CuO+H2= Cu+H2O (2)H2SO4+Ba(OH)2=BaSO4+2H2O (3)CO2+Cu+H2O=Cu(OH)2CO3 (4)NH4HCO3=NH3+H2O+CO2
请分析下面反应属于哪一类型?
化合反应分解反应置换反应复分解反应
(3)(4)(1)(2)
属于上面四种类型中的哪种?
Fe2O3 失氧,被还原,发生还原反应CO 得氧,被氧化,发生氧化反应
一种物质被还原,另一种物质被氧化的反应叫氧化—还原反应
C得到氧,被氧化,发生氧化反应,还原剂。
CuO失去氧,被还原,发生还原反应,氧化剂。
H2得到氧,被氧化,发生氧化反应,还原剂。
一、氧化还原反应的概念:
CuO + CO == Cu + CO2
1、从得氧失氧角度分析:
得氧,被氧化,氧化反应
失氧,被还原,还原反应
分析下列反应中各元素化合价在反应前后有无变化,如何变化。
Fe + CuSO4 = FeSO4 + Cu
Zn + 2HCl = ZnCl2 + H2
NaOH + HCl = NaCl + H2O
Cl:-1、+1、+5、+7
N:-3、+2、+4、+5
Mn:+2、+4、+6、+7
一价氯氢钾钠银,二价氧钙钡镁锌;三铝金,四硅五价磷;二三铁,二四碳锡铅;二四六硫都具全,二价铜汞最常见
思考:若从化合价变化来分,应怎样对化学反应进行分类?
一类是化合价有变化的反应一类是化合价没有变化的反应
+2 -2 0 0 +1 -2
发生还原反应,被还原,化合价降低,
化合价降低,被还原,发生还原反应
发生氧化反应,被氧化,化合价升高,
0
+2
+4
化合价升高,被氧化,发生氧化反应
-2
2、从化合价角度分析:
0 +2 +2 0
0 +1 +2 0
,被氧化,发生氧化反应
,被还原,发生还原反应
不仅有得失氧的化学反应是氧化还原反应,只要化学反应前后化合价有变化的反应都是氧化还原反应
1、有元素化合价升降的反应是氧化还原反应(氧化还原反应的标志和判断依据)2、化合价升高被氧化,该物质作还原剂;化合价降低被还原,该物质作氧化剂。3、同一氧化还原反应中,化合价升高的总价数=化合价降低的总价数。4、不仅能分析有得、失氧的反应,也能分析无得、失氧但反应前后元素化合价有变化的反应。
练习:
1、判断下列反应是不是属于氧化还原反应?
相关课件
这是一份鲁科版 (2019)第3节 氧化还原反应教学课件ppt,共60页。PPT课件主要包含了新知自主预习,课堂互动探究,CONTENTS,课后巩固训练,课堂达标训练等内容,欢迎下载使用。
这是一份高中化学人教版 (新课标)必修1第三节 氧化还原反应教课课件ppt,共23页。PPT课件主要包含了练习一,氧化剂KMnO4,还原剂HCl,氧化剂FeCl3,还原剂Fe,标变价,列变化,求总数,配系数,细检查等内容,欢迎下载使用。
这是一份高中化学人教版 (新课标)必修1第三节 氧化还原反应教案配套课件ppt,共11页。PPT课件主要包含了还原剂,氧化产物,还原产物,氧化剂等内容,欢迎下载使用。









