





2020-2021学年第三节 氧化还原反应多媒体教学课件ppt
展开【学习目标】1、了解SO2的物理性质,掌握SO2的主要化学性质;2、了解可逆反应的概念,知道SO2的漂白原理。
4-3-1 硫 二氧化硫 三氧化硫
4、硫,俗称_____,是一种___色晶体,____于水, ____于酒精,易溶于____。
5、空气污染物的来源: 工厂石油、天然气、煤等含硫化石燃料的燃烧。
①S + O2 SO2
② 2H2S + 3O2 2SO2 + 2H2O↑
(二)二氧化硫(SO2)
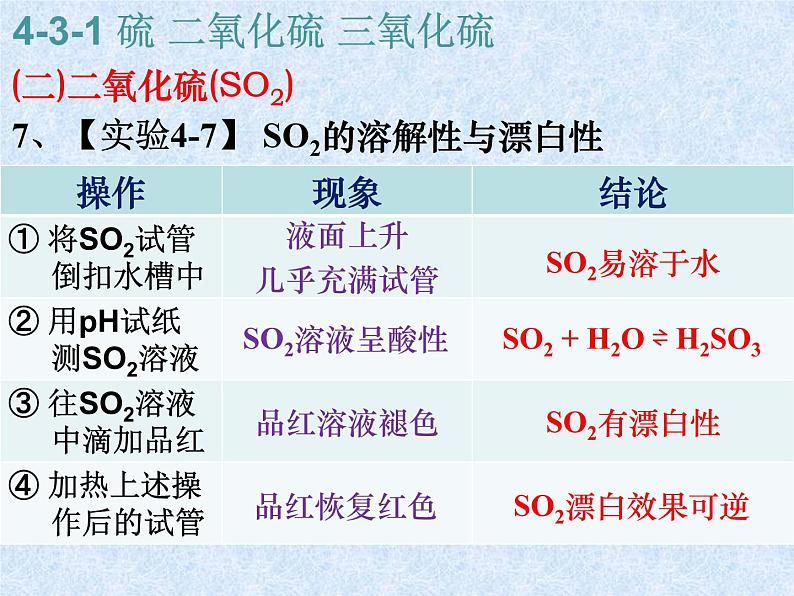
液面上升几乎充满试管
SO2溶液呈酸性
SO2易溶于水
SO2 + H2O ⇌ H2SO3
SO2有漂白性
SO2漂白效果可逆
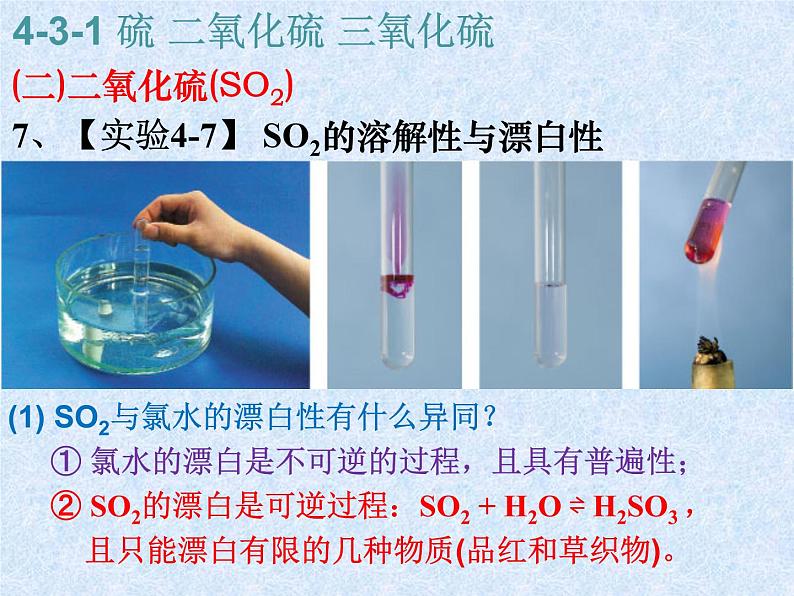
7、【实验4-7】 SO2的溶解性与漂白性
(1) SO2与氯水的漂白性有什么异同? ① 氯水的漂白是不可逆的过程,且具有普遍性; ② SO2的漂白是可逆过程:SO2 + H2O ⇌ H2SO3 , 且只能漂白有限的几种物质(品红和草织物)。
(2) 可逆反应:为什么加热后品红溶液又出现了红色? SO2的漂白是和品红生成不稳定的无色物质, 加热逆向反应生成SO2, SO2挥发后品红恢复红色: SO2 + H2O ⇌ H2SO3
9、如何鉴别SO2和CO2 ? ① 澄清石灰水 ② 品红溶液 (1) 澄清石灰水不能鉴别: CO2 + Ca(OH)2 = CaCO3↓ + H2O SO2 + Ca(OH)2 = CaSO3↓ + H2O (2) 品红溶液可以: CO2不能漂白品红溶液; SO2能够漂白品红溶液。
10、SO2的氧化性和还原性 S ← SO2 → SO3 ① SO2 + O2 SO3 ② SO2 + 2H2S = 3S↓ + 2H2O
(三)三氧化硫(SO3)
11、硫粉在过量的中O2燃烧, 能否直接生成SO3? 不能,只能生成SO2, SO2要生成SO3,还需要催化剂等条件: SO2 + O2 SO3
12、SO2与SO3都具有酸性氧化物的通性, 完成下列表格:
(1) ⑥中反应方程式为:______________________。(2) ①中现象_____________,证明SO2溶液有__性。(3) ②中的品红溶液_________,证明SO2有____性。(4) ③中现象______________,证明SO2有____性。(5) ④中现象______________, 证明SO2有____性。6) ⑤的作用是_______,____________________。
Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O
石蕊试液变红
产生淡黄色沉淀
紫红色褪为无色
SO2 + 2NaOH = Na2SO3 + H2O
16.下列有关SO3的说法正确的是 A.S在过量O2中充分燃烧生成SO3 B.标准状况下,1 ml SO3的体积为22.4 L C.将SO3加入BaCl2溶液有白色沉淀 D.SO2、SO3均具有漂白性,能使石蕊褪色
21.(1) 将SO2通入品红,现象_________________, 加热溶液煮沸后,现象为_______________; 将Cl2通入品红,现象__________________, 加热溶液煮沸后,现象为________________。 (2) 将Cl2通入石蕊,现象__________________; 将SO2通入石蕊,现象_________________。 (3) SO2使溴水褪色,是否是SO2的漂白性? 否,Br2有氧化性,SO2有还原性, 是发生氧化还原反应使溴水褪色。 SO2使红色酚酞溶液褪色,是SO2的漂白性? 否,是发生酸碱中和使酚酞变色。
高中化学人教版 (2019)必修 第二册第一节 硫及其化合物教课内容课件ppt: 这是一份高中化学人教版 (2019)必修 第二册第一节 硫及其化合物教课内容课件ppt,共26页。PPT课件主要包含了一硫的存在形态,二硫的性质,硫的物理性质,硫的化学性质,1还原性,与O2反应,2氧化性,与Fe反应,与Cu反应,与Hg反应等内容,欢迎下载使用。
高中化学第三章 铁 金属材料实验活动2 铁及其化合物的性质说课ppt课件: 这是一份高中化学第三章 铁 金属材料实验活动2 铁及其化合物的性质说课ppt课件,共23页。PPT课件主要包含了ⅥA族,自然界的硫单质,火山口附近的硫,自然界的硫化合物,黄铁矿,白铁矿,磁黄铁矿,硫的性质,硫的化学性质,2还原性等内容,欢迎下载使用。
2020-2021学年第四章 非金属及其化合物第三节 硫和氮的氧化物说课ppt课件: 这是一份2020-2021学年第四章 非金属及其化合物第三节 硫和氮的氧化物说课ppt课件,共45页。PPT课件主要包含了实验4-7,SO2的物理性质,问题讨论,实验现象,品红溶液褪色,二氧化硫的用途,物理性质,化学性质,课堂小结,信使分子NO等内容,欢迎下载使用。













