



化学必修2第二节 元素周期律教学课件ppt
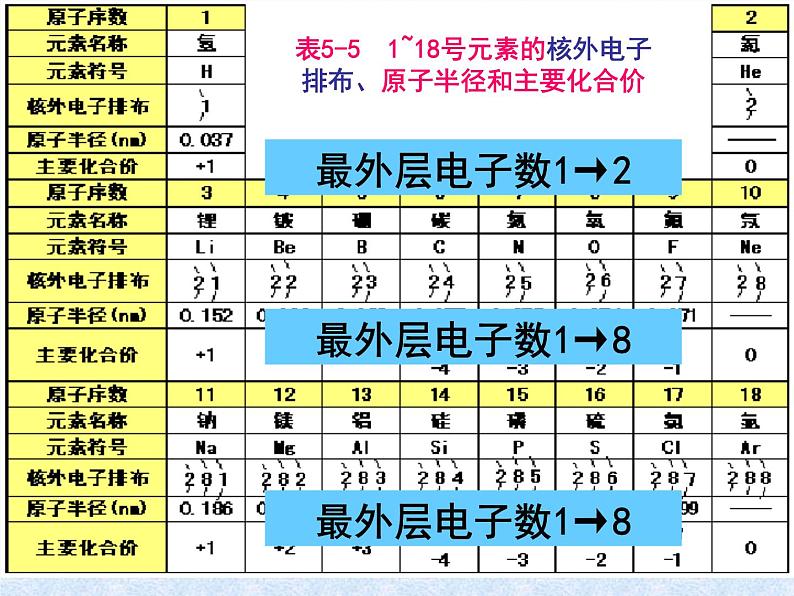
展开1、请写出1~18号元素符号及原子结构示意图并比较有关数据,从中能找出什么规律?
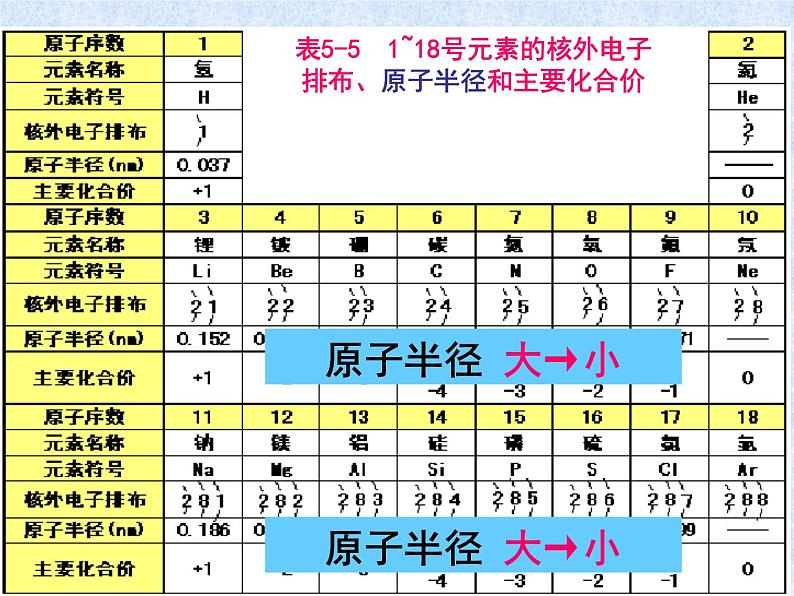
表5-5 1~18号元素的核外电子排布、原子半径和主要化合价
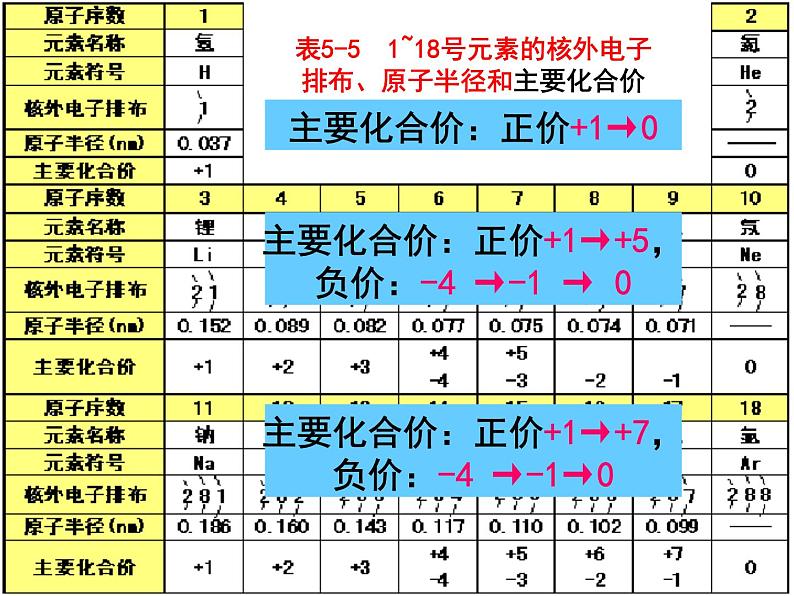
主要化合价:正价+1→0
主要化合价:正价+1→+5,负价:-4 →-1 → 0
主要化合价:正价+1→+7,负价:-4 →-1→0
最高正价:+1 → +7
负价始于Si , - 4 → -1 →0
结论:随着原子序数的递增,元素原子的电子层 排布、原子半径、化合价呈现周期性的变化。
2、随着原子序数的递增,原子的核外电子层排布、元素的原子半径、元素的化合价呈现什么规律性的变化?
例题:下列化合物中,阳离子与阴离子半径比最小的是( )
(A) NaF (B) LiI (C) CsF (D) LiF
阳离子半径:Li+ < Na+
资料P12、活学活用 P15习题4
为什么随原子序数的递增,元素原子的电子层排布、原子半径、化合价呈现周期性变化呢?
随原子序数的递增,元素原子核外电子排布的周期性变化,决定了原子半径、化合价呈现周期性变化。
元素的金属性和非金属性是否也随原子序数的变化呈现周期性变化呢?
元素的金属性和非金属性的强弱根据什么来判断?
①金属与水或酸反应越容易,金属性越强;②最高价氧化物对应的水化物(氢氧化物) 碱性越强,金属性越强;③金属单质与某些盐溶液反应置换另一金属。
元素金属性强弱判断依据:
①非金属与H2化合越容易,非金属性越强; ②气态氢化物越稳定, 非金属性越强; ③最高价氧化物对应的水化物(含氧酸) 酸性越强,非金属性越强;④非金属与某些盐溶液反应置换另一非金属
元素非金属性强弱判断依据:
(1)镁与冷水和热水反应比较
(1)比较钠比镁与水反应的难易程度?
加热前,镁条表面附着 ,加热沸腾后有 冒出,溶液变 色。
镁与铝均能与盐酸反应产生气泡。但镁反应比铝剧烈。
(2)镁与铝与盐酸反应比较
有大量气泡产生,试管烫手,反应速度很快。
有大量气泡产生,试管烫手,反应速度快。
(2)比较镁和铝与盐酸反应的难易程度?
NaOH( )
Al(OH)3( )
浮于水面,熔成小球,四处游动,嘶嘶作响,溶液变红;与酸反应更为剧烈。
(4) Na Mg Al 金属性逐渐 .
常温下和加热时,遇水无明显现象;与酸反应剧烈,放出无色气体。
上述实验证明,第三周期元素金属性、非金属性的递变规律:
Na Mg Al Si P S Cl
金属性逐渐 ,非金属性逐渐 。
对其他周期元素性质进行研究,也可以得到类似的结论。
∴ 同一周期元素,从左到右, 金属性逐渐减弱,非金属性逐渐增强。
比较第三周期非金属与氢气反应条件及含氧酸的酸性强弱 (P16)
元素周期表中元素性质递变规律
从+1--+7或-4---- -1
氧化性增强,还原性减弱
还原性增强,氧化性减弱
碱性逐渐减弱,酸性逐渐增强
碱性逐渐增强,酸性逐渐减弱
生成由难渐易稳定性逐渐增强
生成由易渐难稳定性逐渐减弱
元素原子的最外层电子排布
+1→+7-4→-1→0
金属性减弱非金属性增强
随着原子序数的递增,元素的性质呈现周期性变化 ,这叫做元素周期律。
三、元素周期表和元素周期律的应用
1、元素的位、构、性三者之间的关系及其应用
(1)结构决定位置:原子序数=核电荷数 周期序数=电子层数 主族序数=最外层电子数
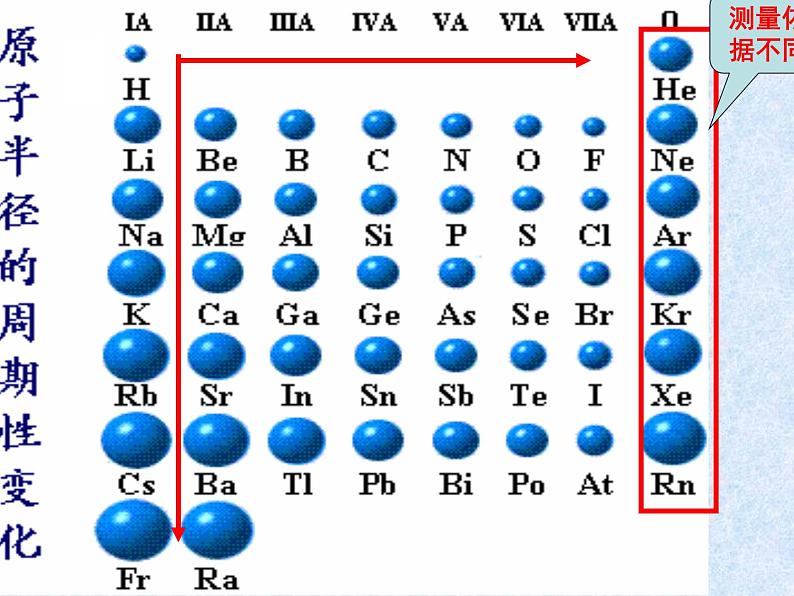
最外层电子数和原子半径
元素的金属性、非金属性强弱
单质的氧化性、还原性强弱
(2)结构决定性质: 最外层电子数=主族元素的最高正价数 =8-负价数
(3)位置决定性质: 同周期:从左到右,递变性
2、金属元素、非金属元素的分区: 分界线左边是金属元素,分界线右边是非金属元素,最右一个纵行是稀有气体元素。见下图:
什么元素的金属性最强?什么元素的非金属性最强它们分别位于元素周期表中的什么位置?
3、元素的化合价与元素在周期表中的位置关系(1)主族元素:最高正价数 = 主族序数 = 最外层电子数(2)非金属元素: |最高正价|+|最低负价|= 8
4、应用(P18)。(1)预言未知元素并证实.(2)分界处找半导体材料.(3)在非金属区域找制农药元素.(4)过渡区寻找催化剂和耐高温、 耐腐蚀的合金材料.
练习:1、下列变化的比较, 不正确的是:( )A. 酸性强弱: HClO4 > H2SO4 > H3PO4 > H2SiO3 B. 原子半径大小: Na > S > OC. 碱性强弱: KOH > NaOH > LiOH D. 还原性强弱: F- > Cl- > I-
2、硒是人体肝脏和肾脏的组成元素之一,现在含有元素硒(Se) 的保健品已经进入市场, 已知它与氧元素同族, 与 K 同周期, 关于硒的说法中不正确的是:( )A. 原子序数为 34 B. 最高价氧化物的水化物的分子式为: H2SeO4C. Se 的非金属性比 Br 弱 D. 气态氢化物的稳定性比硫化氢气体强
1.某元素原子核外L层电子数是其它层电子数之和的2倍,则该元素的核电荷数为: A.6 B.8 C.12 D.162、A元素原子的L层比B元素原子的L层少3个电子,B原子核外电子总数比A原子核外电子总数多5个,则A与B形成的化合物的化学式为: A. A2B3 B. BA2 C. AB4 D.B3A2
2020-2021学年第二节 资源综合利用,环境保护备课ppt课件: 这是一份2020-2021学年第二节 资源综合利用,环境保护备课ppt课件,共60页。PPT课件主要包含了第四章,有机物,无机物,碳元素,氧氮硫,2煤的综合利用,煤的焦化,焦炉气,煤焦油,可燃性气体等内容,欢迎下载使用。
高中化学人教版 (新课标)必修2第二章 化学反应与能量综合与测试复习ppt课件: 这是一份高中化学人教版 (新课标)必修2第二章 化学反应与能量综合与测试复习ppt课件,共55页。PPT课件主要包含了化学反应与能量,第二章,章末复习提升,化学反应中的能量变化,●典例透析,答案C等内容,欢迎下载使用。
高中人教版 (新课标)第一节 化学能与热能背景图ppt课件: 这是一份高中人教版 (新课标)第一节 化学能与热能背景图ppt课件,共60页。PPT课件主要包含了化学反应与能量,第二章,可逆反应,不可逆反应,氧化还原反应,非氧化还原反应,吸热反应,放热反应,放出热量,吸收热量等内容,欢迎下载使用。













