

2020-2021学年第二节 有机化合物的结构特点教案
展开一.有机物中碳原子的成键特点与简单有机分子的空间构型
第二课时
[思考回忆]同系物、同分异构体的定义?(学生思考回答,老师板书)
[板书]
二、有机化合物的同分异构现象、同分异构体的含义
同分异构体现象:化合物具有相同的分子式,但具有不同的结构现象,叫做同分异构体现象。
同分异构体:分子式相同, 结构不同的化合物互称为同分异构体。
(同系物:结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称为同系物。)
[知识导航1]
引导学生再从同系物和同分异构体的定义出发小结上述2答案,从中得出对“同分异构”的理解:
(1)“同分”—— 相同分子式 (2)“异构”——结构不同
分子中原子的排列顺序或结合方式不同、性质不同。
(“异构”可以是象上述②与③是碳链异构,也可以是像⑥与⑦是官能团异构)
“同系物”的理解:(1)结构相似——— 一定是属于同一类物质;
(2)分子组成上相差一个或若干个CH2原子团—— 分子式不同
[学生自主学习,完成《自我检测1》]
《自我检测1》
下列五种有机物中, 互为同分异构体; 互为同一物质;
CH3-CH=C
︱
CH3
CH3︱
互为同系物。
CH3-CH-CH=CH2
︱
CH3
① ②
CH3︱
CH3-C=CH-CH3
③
④ CH2=CH-CH3 ⑤ CH2=CH-CH=CH2
[知识导航2]
(1)由①和②是同分异构体,得出“异构”还可以是位置异构;
(2)②和③互为同一物质,巩固烯烃的命名法;
(3)由①和④是同系物,但与⑤不算同系物,深化对“同系物”概念中“结构相似”的含义理解。(不仅要含官能团相同,且官能团的数目也要相同。)
(4)归纳有机物中同分异构体的类型;由此揭示出,有机物的同分异构现象产生的本质原因是什么?(同分异现象是由于组成有机化合物分子中的原子具有不同的结合顺序和结合方式产生的,这也是有机化合物数量庞大的原因之一。除此之外的其他同分异构现象,如顺反异构、对映异构将分别在后续章节中介绍。)
[板书]
二、同分异构体的类型和判断方法
1.同分异构体的类型:
a.碳链异构:指碳原子的连接次序不同引起的异构
b.官能团异构:官能团不同引起的异构
c.位置异构:官能团的位置不同引起的异构
[小组讨论]通过以上的学习,你觉得有哪些方法能够判断同分异构体?
[小结]抓“同分”——先写出其分子式(可先数碳原子数,看是否相同,若同,则再看其它原子的数目……)
看是否“异构”—— 能直接判断是碳链异构、官能团异构或位置异构则最好,若不能直接判断,那还可以通过给该有机物命名来判断。那么,如何判断“同系物”呢?(学生很容易就能类比得出)
[板书]
2.同分异构体的判断方法
[课堂练习投影]——巩固和反馈学生对同分异构体判断方法的掌握情况,并复习巩固“四同”的区别。
1)下列各组物质分别是什么关系?
①CH4与CH3CH3 ②正丁烷与异丁烷 ③金刚石与石墨 ④O2与O3 ⑤H 与 H
2)下列各组物质中,哪些属于同分异构体,是同分异构体的属于何种异构?
① CH3COOH和 HCOOCH3 ② CH3CH2CHO和 CH3COCH3
③ CH3CH2CH2OH 和 CH3CH2OCH3 ④ 1-丙醇和2-丙醇
CH3-CH-CH3
CH3
⑤ 和 CH3-CH2-CH2-CH3
[知识导航3] ——《投影戊烷的三种同分异构体》
启发学生从支链的多少,猜测该有机物反应的难易,从而猜测其沸点的高低。(然后老师投影戊烷的三种同分异构体实验测得的沸点。)
[板书]
三、同分异构体的性质差异
带有支链越多的同分异构体,沸点越低。
[学生自主学习,完成以下练习]
《自我检测3——课本P12 2、3、5题》
第三课时
[问题导入]
我们知道了有机物的同分异构现象,那么,请同学们想想,该如何书写已知分子式的有机物的同分异构体,才能不会出现重复或缺漏?如何检验同分异构体的书写是否重复?你能写出己烷(C6H14)的结构简式吗?(课本P10 《学与问》)
[学生活动]书写C6H14的同分异构。
[教师]评价学生书写同分异构的情况。
[板书]
四、如何书写同分异构体
1.书写规则——四句话:
主链由长到短;支链由整到散; 支链或官能团位置由中到边; 排布对、邻、间。
(注:①支链是甲基则不能放1号碳原子上;若支链是乙基则不能放1和2号碳原子上,依次类推。②可以画对称轴,对称点是相同的。)
2.几种常见烷烃的同分异构体数目:
丁烷:2种 ;戊烷:3种 ;己烷:5种 ;庚烷:9种
[堂上练习投影] 下列碳链中双键的位置可能有____种。
[知识拓展]
1.你能写出C3H6 的同分异构体吗?
2.提示学生同分异构体暂时学过有三种类型,你再试试写出丁醇的同分异构体?①按位置异构书写;②按碳链异构书写;)
3.若题目让你写出C4H10O的同分异构体,你能写出多少种?这跟上述第2题答案相同吗?
(提示:还需 ③按官能团异构书写。)
[知识导航5]
(1)大家已知道碳原子的成键特点,那么,利用你手中的球棍模型,把甲烷的结构拼凑出来。
二氯甲烷可表示为 它们是否属于同种物质?
(是,培养学生的空间想象能力)
(2)那,二氯乙烷有没有同分异构体?你再拼凑一下。
[板书]
注意:二氯甲烷没有同分异构体,它的结构只有1种。
[指导学生阅读课文P11的《科学史话》]
注:此处让学生初步了解形成甲烷分子的sp3杂化轨道
疑问:是否要求介绍何时为sp3杂化?
[知识导航6]
有机物的组成、结构表示方法有结构式、结构简式,还有“键线式”,简介“键线式”的含义。
[板书]
五、键线式的含义(课本P10《资料卡片》)
[自我检测3] 写出以下键线式所表示的有机物的结构式和结构简式以及分子式。
; ; ;
[小结本节课知识要点]
[自我检测4](投影)
1.烷烃C5H12的一种同分异构体只能生成一种一氯代物,试写出这种异构体的结构简式
。(课本P12、5 )
2.分子式为C6H14的烷烃在结构式中含有3个甲基的同分异构体有( )个
(A)2个 (B)3个 (C)4个 (D)5个
3.经测定,某有机物分子中含2个 —CH3 ,2个 —CH2— ;一个 —CH— ;一个 Cl 。试写出这种有机物的同分异构体的结构简式:
教学内容
教学环节
教学活动
设计意图
教师活动
学生活动
——
引入
有机物种类繁多,有很多有机物的分子组成相同,但性质却有很大差异,为什么?
结构决定性质,结构不同,性质不同。
明确研究有机物的思路:组成—结构—性质。
有机分子的结构是三维的
设置情景
多媒体播放化学史话:有机化合物的三维结构。思考:为什么范特霍夫和勒贝尔提出的立体化学理论能解决困扰19世纪化学家的难题?
思考、回答
激发学生兴趣,同时让学生认识到人们对事物的认识是逐渐深入的。
有机物中碳原子的成键特点
交流与讨论
指导学生搭建甲烷、乙烯、 乙炔、苯等有机物的球棍模型并进行交流与讨论。
讨论:碳原子最外层中子数是多少?怎样才能达到8电子稳定结构?碳原子的成键方式有哪些?碳原子的价键总数是多少?什么叫单键、双键、叁键?什么叫不饱和碳原子?
通过观察讨论,让学生在探究中认识有机物中碳原子的成键特点。
有机物中碳原子的成键特点
归纳板书
有机物中碳原子的成键特征:1、碳原子含有4个价电子,易跟多种原子形成共价键。
2、易形成单键、双键、叁键、碳链、碳环等多种复杂结构单元。
3、碳原子价键总数为4。
不饱和碳原子:是指连接双键、叁键或在苯环上的碳原子(所连原子的数目少于4)。
师生共同小结。
通过归纳,帮助学生理清思路。
简单有机分子的空间结构及
碳原子的成键方式与分子空间构型的关系
观察与思考
观察甲烷、乙烯、 乙炔、苯等有机物的球棍模型,思考碳原子的成键方式与分子的空间构型、键角有什么关系?
分别用一个甲基取代以上模型中的一个氢原子,甲基中的碳原子与原结构有什么关系?
分组、动手搭建球棍模型。填P19表2-1并思考:碳原子的成键方式与键角、分子的空间构型间有什么关系?
从二维到三维,切身体会有机分子的立体结构。归纳碳原子成键方式与空间构型的关系。
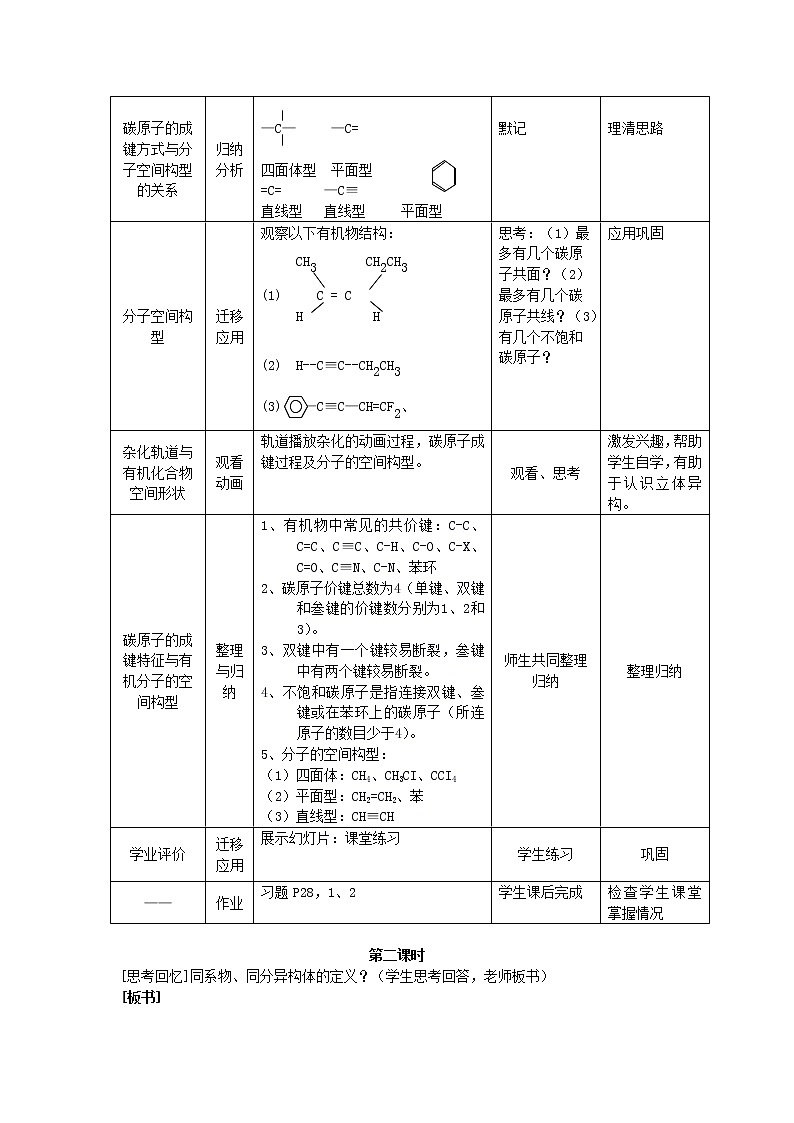
碳原子的成键方式与分子空间构型的关系
归纳分析
—C— —C=
四面体型 平面型
=C= —C≡
直线型 直线型 平面型
默记
理清思路
分子空间构型
迁移应用
观察以下有机物结构:
CH3 CH2CH3
(1) C = C
H H
(2) H--C≡C--CH2CH3
(3) —C≡C—CH=CF2、
思考:(1)最多有几个碳原子共面?(2)最多有几个碳原子共线?(3)有几个不饱和碳原子?
应用巩固
杂化轨道与有机化合物空间形状
观看动画
轨道播放杂化的动画过程,碳原子成键过程及分子的空间构型。
观看、思考
激发兴趣,帮助学生自学,有助于认识立体异构。
碳原子的成键特征与有机分子的空间构型
整理与归纳
1、有机物中常见的共价键:C-C、C=C、C≡C、C-H、C-O、C-X、C=O、C≡N、C-N、苯环
2、碳原子价键总数为4(单键、双键和叁键的价键数分别为1、2和3)。
3、双键中有一个键较易断裂,叁键中有两个键较易断裂。
4、不饱和碳原子是指连接双键、叁键或在苯环上的碳原子(所连原子的数目少于4)。
5、分子的空间构型:
(1)四面体:CH4、CH3CI、CCI4
(2)平面型:CH2=CH2、苯
(3)直线型:CH≡CH
师生共同整理归纳
整理归纳
学业评价
迁移应用
展示幻灯片:课堂练习
学生练习
巩固
——
作业
习题P28,1、2
学生课后完成
检查学生课堂掌握情况
化学选修5 有机化学基础第二节 醛教案及反思: 这是一份化学选修5 有机化学基础第二节 醛教案及反思,共5页。教案主要包含了教学目标,教学重点,教学过程,实验3-5,实验3-6,思考和交流等内容,欢迎下载使用。
人教版 (新课标)选修5 有机化学基础第一节 醇 酚教案设计: 这是一份人教版 (新课标)选修5 有机化学基础第一节 醇 酚教案设计,共9页。教案主要包含了教学重点,教学难点,教学过程,实验注意事项,问题交流项目,教学重、难点,教学方法,问题交流等内容,欢迎下载使用。
高中化学人教版 (新课标)选修5 有机化学基础第三节 卤代烃教案设计: 这是一份高中化学人教版 (新课标)选修5 有机化学基础第三节 卤代烃教案设计,共5页。













