

高考化学总复习 课时跟踪检测 一 物质的量 气体摩尔体积 Word版含答案
展开(时间:45分钟 满分:100分)
一、选择题(每小题5分,共60分)
1.(2017届保定市高阳中学月考)下列说法正确的是( )
A.摩尔是用来衡量微观粒子多少的一种物理量
B.在一定的温度和压强下,各种气体的摩尔体积相等
C.阿伏加德罗常数的数值是0.012 kg14C所含的原子个数
D.若气体摩尔体积为22.4 L·ml-1,则所处条件为标准状况
解析:摩尔是物质的量的单位,不是物理量,A项错误;气体的摩尔体积是指单位物质的量的气体所占的体积,气体摩尔体积与温度和压强有关,温度和压强一定的条件下,气体摩尔体积相同,B项正确;阿伏加德罗常数的数值是0.012 kg12C所含的原子个数,C项错误;气体体积与温度和压强有关,温度升高,气体体积增大,压强增大,气体体积减小,故不在标准状况下,气体摩尔体积也可能是22.4 L·ml-1,D项错误。
答案:B
2.(2016年海南卷)利用太阳能分解水制氢,若光解0.02 ml水,下列说法正确的是( )
A.可生成H2的质量为0.02 g
B.可生成氢的原子数为2.408×1023 个
C.可生成H2的体积为0.22 L(标准状况)
D.生成H2的量理论上等于0.04 ml Na与水反应产生H2的量
解析:根据反应方程式2H2O===2H2↑+O2↑,光解0.02 ml H2O,可生成0.02 ml H2和0.01 ml O2。可生成H2的质量为0.02 ml×2 g·ml-1=0.04 g,A项错误;可生成氢的原子数为0.02 ml×2×6.02×1023=2.408×1022 个,B项错误;在标准状况下,可生成H2的体积为0.02 ml×22.4 L/ml=0.448 L,C项错误;0.04 ml Na与水反应产生0.02 ml H2,D项正确。
答案:D
3.(2017届重庆一中月考)NA为阿伏加德罗常数,下列叙述正确的是( )
A.7.8 g Na2O2中含有的阴离子数等于0.2NA
B.0.1 ml 16OD-离子含有的电子、中子数均为1.0NA
C.常温常压下,42 g乙烯和丁烯混合气体中,极性键数为6NA
D.密闭容器中2 ml NO与1 ml O2充分反应,产物的分子数为2NA
解析:7.8 g Na2O2为0.1 ml,其中含有的阴离子数为0.1NA,A项错误;16OD-中含有10个电子、9个中子,故0.1 ml 16OD-离子含有的电子数为1.0NA,中子数为0.9NA,B项错误;乙烯、丁烯最简式相同,均为CH2,42 g乙烯、丁烯混合物中含有eq \f(42 g,14 g/ml)=3 ml CH2基团,故含有的极性键数为3 ml×2NA=6NA,C项正确;NO与O2在容器中发生反应2NO+O22NO2,2NO2N2O4,故2 ml NO与1 ml O2充分反应,产物的分子数小于2NA,D项错误。
答案:C
4.(2017届江西省赣中南五校联考)下列说法正确的是( )
A.32 g O2占有的体积约为22.4 L
B.22.4 L N2含有阿伏加德罗常数个氮气分子
C.在标准状况下,22.4 L水的质量约为18 g
D.22 g二氧化碳与标准状况下11.2 L HCl含有相同的分子数
解析:32 g O2为1 ml,标准状况下的体积约为22.4 L,A项错误;B项没有指明是标准状况,22.4 L N2不一定为1 ml,B项错误;在标准状况下,水为非气体,C项错误;22 g CO2为0.5 ml,标准状况下11.2 L HCl气体为0.5 ml,二者所含分子数相同,D项正确。
答案:D
5.(2017届河北省景县中学摸底)已知3.01×1023个X气体分子的质量为32 g,则X气体的摩尔质量是( )
A.16 gB.32
C.64 g/mlD.32 g/ml
解析:由公式n=eq \f(N,NA)=eq \f(m,M)得,eq \f(3.01×1023,6.02×1023)=eq \f(32,M),M=64 g/ml,C项正确。
答案:C
6.(2017届新疆伊犁州伊宁县第二中学摸底)用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.在标准状况下22.4 L H2O中含有氢原子的个数为2NA
B.2.7 g铝与足量的盐酸反应时失去的电子数为0.3NA
C.1 ml/L NaCl溶液中含有钠离子的个数为NA
D.常温常压下,11.2 L氧气含有的原子数目为NA
解析:标准状况下H2O为非气体,不能由标准状况下气体摩尔体积求出其物质的量,22.4 L H2O 不为1 ml,不能求出其中所含氢原子数,A项错误;2.7 g Al的物质的量为0.1 ml,与足量盐酸反应时,失去电子数为0.3NA,B项正确;不知溶液体积,不能求出溶液中含有Na+的个数,C项错误;标准状况(0 ℃,101 kPa)下,11.2 L O2为0.5 ml,而常温常压下,11.2 L O2的物质的量小于0.5 ml,其所含氧原子数小于NA,D项错误。
答案:B
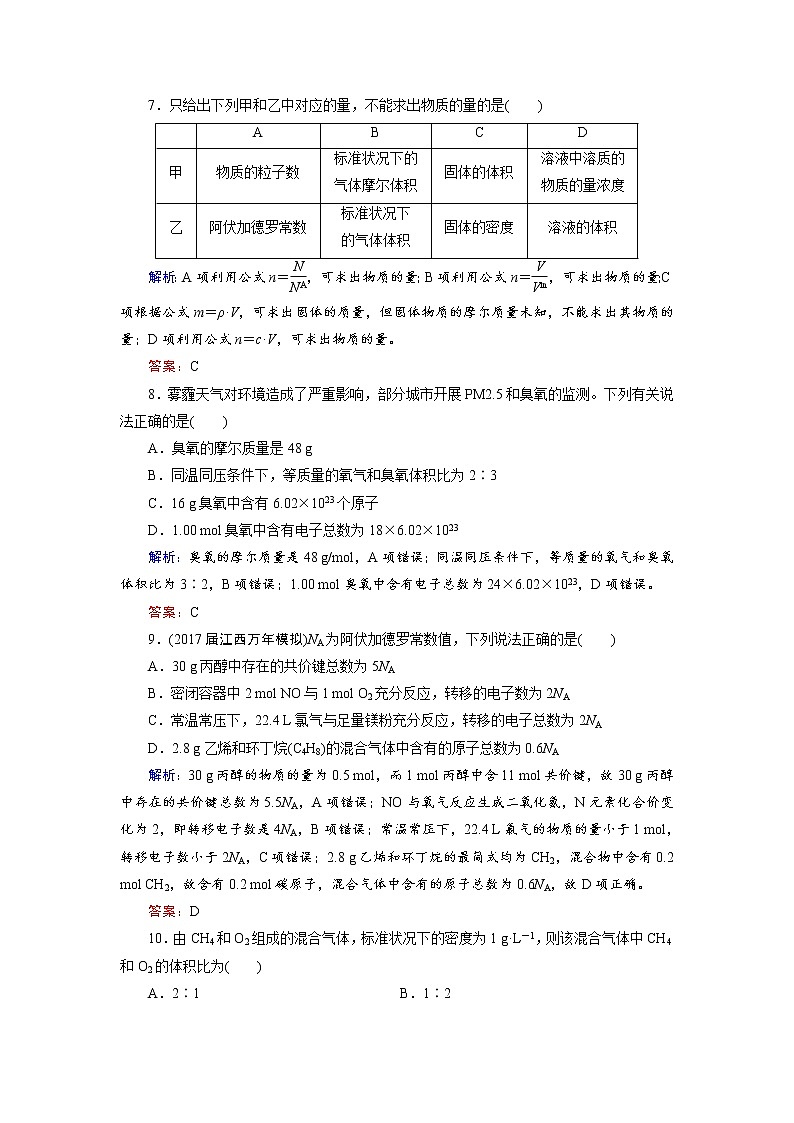
7.只给出下列甲和乙中对应的量,不能求出物质的量的是( )
解析:A项利用公式n=eq \f(N,NA),可求出物质的量;B项利用公式n=eq \f(V,Vm),可求出物质的量;C项根据公式m=ρ·V,可求出固体的质量,但固体物质的摩尔质量未知,不能求出其物质的量;D项利用公式n=c·V,可求出物质的量。
答案:C
8.雾霾天气对环境造成了严重影响,部分城市开展PM2.5和臭氧的监测。下列有关说法正确的是( )
A.臭氧的摩尔质量是48 g
B.同温同压条件下,等质量的氧气和臭氧体积比为2∶3
C.16 g臭氧中含有6.02×1023个原子
D.1.00 ml臭氧中含有电子总数为18×6.02×1023
解析:臭氧的摩尔质量是48 g/ml,A项错误;同温同压条件下,等质量的氧气和臭氧体积比为3∶2,B项错误;1.00 ml臭氧中含有电子总数为24×6.02×1023,D项错误。
答案:C
9.(2017届江西万年模拟)NA为阿伏加德罗常数值,下列说法正确的是( )
A.30 g丙醇中存在的共价键总数为5NA
B.密闭容器中2 ml NO与1 ml O2充分反应,转移的电子数为2NA
C.常温常压下,22.4 L氯气与足量镁粉充分反应,转移的电子总数为2NA
D.2.8 g乙烯和环丁烷(C4H8)的混合气体中含有的原子总数为0.6NA
解析:30 g丙醇的物质的量为0.5 ml,而1 ml丙醇中含11 ml共价键,故30 g丙醇中存在的共价键总数为5.5NA,A项错误;NO与氧气反应生成二氧化氮,N元素化合价变化为2,即转移电子数是4NA,B项错误;常温常压下,22.4 L氯气的物质的量小于1 ml,转移电子数小于2NA,C项错误;2.8 g乙烯和环丁烷的最简式均为CH2,混合物中含有0.2 ml CH2,故含有0.2 ml碳原子,混合气体中含有的原子总数为0.6NA,故D项正确。
答案:D
10.由CH4和O2组成的混合气体,标准状况下的密度为1 g·L-1,则该混合气体中CH4和O2的体积比为( )
A.2∶1B.1∶2
C.2∶3D.3∶2
解析:设混合气体中CH4和O2的体积分别为x、y。根据题意可得eq \f(x,22.4)×16+eq \f(y,22.4)×32=(x+y)×1 g·L-1,解得eq \f(x,y)=eq \f(3,2),故选D项。
答案:D
11.(2017届山西省怀仁县第一中学月考)如图表示1 g O2与1 g X气体在相同容积的密闭容器中压强(p)与温度(T)的关系,则X气体可能是( )
A.C2H4B.CH4
C.SO2D.NO
解析:本题考查阿伏加德罗定律的推论。在同温、同体积条件下,气体的压强与气体的物质的量成正比,由图知p(O2)>p(X),则n(O2)>n(X),二者质量相同,说明M(O2)
12.在一定条件下,某化合物X受热分解:2X△,A↑+2B↑+4C↑,测得反应后生成的混合气体对H2的相对密度为11.43,相同条件下,X的相对分子质量是( )
A.11.43B.22.85
C.80.01D.160.02
解析:由题知,反应后生成的混合气体的平均相对分子质量为11.43×2=22.86。由反应方程式可知每有2 ml 化合物X分解,生成7 ml气体,由质量守恒可得2×M(X)=7×22.86 g/ml,则M(X)=eq \f(7×22.86 g/ml,2)=80.01 g/ml,则X的相对分子质量为80.01,选C项。
答案:C
二、非选择题(共40分)
13.(12分)(1)标准状况下,1.32 g某气体的体积为672 mL,则此气体的相对分子质量为________。
(2)在25 ℃、101 kPa的条件下,同质量的CH4和A气体的体积之比是15∶8,则A的摩尔质量为________。
(3)18.6 g Na2X含有0.6 ml Na+,Na2X的摩尔质量为________,X的相对原子质量为________,该物质的化学式为________。
(4)若a g某气体中含有的分子数为b,则c g该气体在标准状况下的体积是(设NA为阿伏加德罗常数的值)________。
解析:(1)n(气)=eq \f(672×10-3 L,22.4 L·ml-1)=0.03 ml,M(气)=eq \f(1.32 g,0.03 ml)=44 g·ml-1,此气体的相对分子质量为44。(2)在相同温度、压强下,气体体积之比等于物质的量之比,15∶8=eq \f(m g,16 g·ml-1)∶eq \f(m g,MA),
M(A)=30 g·ml-1。
(3) Na2X ~ 2Na+ ~ X2-
[46+Mr(X)]g 2 ml
18.6 g 0.6 ml
则eq \f([46+MrX]g,18.6 g)=eq \f(2 ml,0.6 ml),解得Mr(X)=16,X为氧元素,该物质的化学式为Na2O。
(4)a g气体的物质的量为eq \f(b,NA)ml,其标准状况下的体积为eq \f(22.4b,NA) L,则c g气体的体积为eq \f(22.4b,NA) L×eq \f(c,a)=eq \f(22.4bc,aNA) L。
答案:(1)44 (2)30 g·ml-1 (3)62 g·ml-1 16 Na2O (4)eq \f(22.4bc,aNA) L
14.(12分)(2017届安溪校级月考)某液体化合物X2Y4常用作火箭燃料。16 g X2Y4在一定量的O2中恰好完全燃烧,反应方程式为X2Y4(l)+O2(g)===X2(g)+2Y2O(l)。冷却后标准状况下测得生成物的体积为11.2 L,其密度为1.25 g/L,则:
(1)反应前O2的体积V(O2)为________。
(2)X2的摩尔质量为____________,Y元素的名称是____________。
(3)若反应生成0.2 ml X2,则转移电子的物质的量为________ml。
解析:(1)由反应方程式可知,反应前后气体体积不发生变化,故V(O2)=V(X2)=11.2 L。(2)X2的摩尔质量m(X2)=ρ·Vm=22.4 L/ml×1.25 g/L=28 g/ml。标准状况下11.2 L X2的物质的量为eq \f(11.2 L,22.4 L/ml)=0.5 ml,则n(X2Y4)=n(X2)=0.5 ml,X2Y4的摩尔质量为eq \f(16 g,0.5 ml)=32 g/ml,则X2Y4的相对分子质量为32,则Y的相对原子质量为eq \f(32-28,4)=1,可知Y为氢元素。(3)反应中X化合价由-2价升高到0价,由反应方程式可知,生成1 ml X2转移4 ml电子,若生成0.2 ml X2,转移电子的物质的量为0.8 ml。
答案:(1)11.2 L (2)28 g/ml 氢 (3)0.8
15.(16分)某研究性学习小组欲测定室温下(25 ℃、101 kPa)的气体摩尔体积,请回答以下问题。该小组设计的简易实验装置如下图所示:
该实验的主要操作步骤如下:
①配制100 mL 1.0 ml·L-1的盐酸;
②用________(填仪器名称并注明规格)量取10.0 mL 1.0 ml·L-1的盐酸加入锥形瓶中;
③称取a g已除去表面氧化膜的镁条,并系于铜丝末端,为使HCl全部参加反应,a的数值至少为________;
④往广口瓶中装入足量水,按上图连接好装置,检查装置的气密性;
⑤反应结束后待体系温度恢复至室温,读取量筒中水的体积为V mL。
请将上述步骤补充完整并回答下列问题。
(1)用文字表述实验步骤④中检查装置气密性的方法:
________________________________________________________________________
________________________________________________________________________。
(2)实验步骤⑤中应选用________(填序号)的量筒。
A.100 mL B.200 mL C.500 mL
读数时除恢复到室温外,还要注意__________________________________________。
(3)若忽略水蒸气的影响,在实验条件下测得气体摩尔体积的计算公式为Vm=________,若未除去镁条表面的氧化膜,则测量结果________(填“偏大”“偏小”或“无影响”)。
解析:②量筒的精确度为0.1 mL,选取量筒时量筒的规格应与其所量体积相近,故选用10 mL量筒。③HCl的物质的量为0.01 L×1.0 ml·L-1=0.01 ml,Mg与盐酸发生反应Mg+2HCl===MgCl2+H2↑,0.01 ml HCl需消耗0.005 ml Mg,为保证HCl完全反应,镁的质量不少于0.005 ml×24 g/ml=0.12 g。
(2)实验中产生的气体在标准状况下的体积为0.005 ml×22.4 L/ml=0.112 L=112 mL,考虑到室温时气体体积应稍大些,考虑到所选仪器规格应比所测体积略大,且越接近所测数据,误差越小,故选B项。读数时注意量筒内的液面与广口瓶中液面相平,保证气压前后相等。
(3)Vm是气体的体积(排出水的体积)与气体的物质的量之比。若未除去镁条表面的氧化膜,氧化膜也消耗酸,使放出H2的体积变小,Vm偏小。
答案:②10 mL量筒 ③0.12
(1)两手掌紧贴锥形瓶外壁一会儿,如果观察到广口瓶中长导管内有一段水柱高出液面,表明装置气密性良好
(2)B 量筒内的液面与广口瓶内液面相平
(3)0.2V L·ml-1 偏小
A
B
C
D
甲
物质的粒子数
标准状况下的
气体摩尔体积
固体的体积
溶液中溶质的
物质的量浓度
乙
阿伏加德罗常数
标准状况下
的气体体积
固体的密度
溶液的体积
2024届高考化学一轮总复习课时跟踪练8物质的量与气体摩尔体积: 这是一份2024届高考化学一轮总复习课时跟踪练8物质的量与气体摩尔体积,共9页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
2024届高考化学一轮复习 课时跟踪检测(六) 物质的量 气体摩尔体积(含答案): 这是一份2024届高考化学一轮复习 课时跟踪检测(六) 物质的量 气体摩尔体积(含答案),共12页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
2024届高考化学一轮总复习课时跟踪练8物质的量与气体摩尔体积: 这是一份2024届高考化学一轮总复习课时跟踪练8物质的量与气体摩尔体积,共9页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。












