
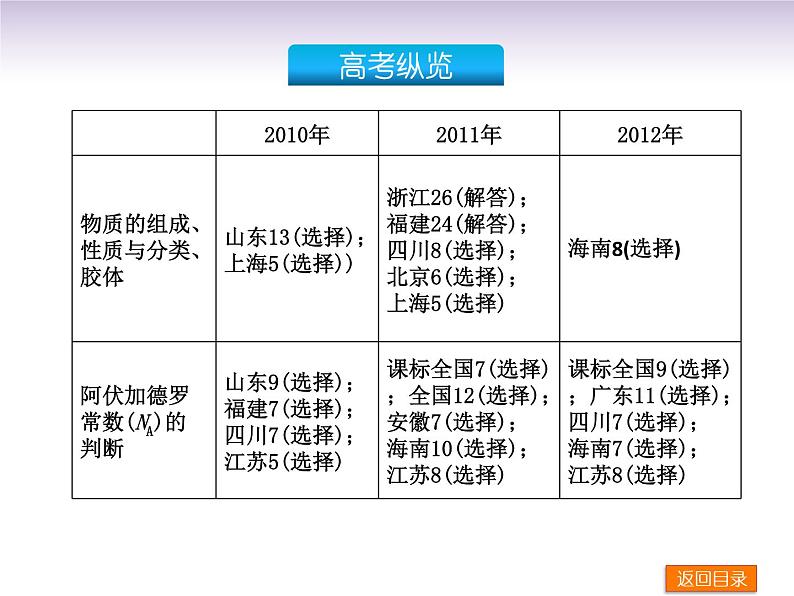






高考化学一轮复习方案_第1讲_物质的组成与分类课件
展开【教学建议】本专题的内容比较抽象,概念性和综合性强,易混淆知识点较多,物质的量、气体摩尔体积、物质的量浓度等是高考常考的知识点,通常以选择题、填空题或计算的形式出现,是历年高考命题的重点和热点。1.物质分类的方法有多种,依据不同的标准对物质有不同的分类,高考中往往会综合考查物质的分类。因此复习时要注意:溶液内容仍围绕 S、w、c 命题;胶体内容有考查胶体的基础知识与科技、生活、生产相结合的问题的趋势。
2.阿伏加德罗常数正误判断是物质的量的一个难点。这类题目是高考的热点,涉及氧化还原反应中的电子转移知识、电化学知识等。知识的综合性强,思考容量大。教学时要注意以物质的量为核心,一切知识都是从物质的量入手的。在教学过程中要善于运用归纳、小结的方法,引导学生从物质的量入手,明确阿伏加德罗常数的误区。阿伏加德罗常数渗透到整个高中化学知识中,综合性强,对思维的严密性和准确性要求比较高,是历年高考的必考内容之一。
3.阿伏加德罗定律及其应用。命题的热点是已知同温同压(或同温同容)下不同气体的某些条件,推断或比较某些物理量(如体积、质量或密度)的大小;或者根据反应原理,结合质量守恒定律、阿伏加德罗定律推断气体产物的化学式。由于推导出的结论和公式比较多,学生容易弄混,学习时感到困难。对于阿伏加德罗定律及其推论,引导学生自己推导,解题时注意所给条件,仔细审题。把握相关知识点的命题规律及主要题型的解题思路。通过课时作业加以强化巩固,紧扣相关理论的本质,提高学生认识、分析、解决化学问题的能力。
4.物质的量浓度的计算因涉及电解质的电离、溶液中溶质的质量分数、溶解度、气体摩尔体积等知识,又是教学中的一个重点和难点。教学时应准确把握概念、公式,在应用时还要注意溶质的质量守恒、物质的量守恒以及溶液的电荷守恒、质量守恒等。
【教学建议】本专题建议用6课时完成,其中3课时用于在课堂学习,2课时用于习题讲评,1课时用于测试分析。
第一单元 物质的组成与分类
1.了解分子、原子、离子等概念和含义。了解原子团的定义。2.理解物理变化与化学变化的区别与联系。3.理解混合物和纯净物、单质和化合物、金属和非金属的概念。4.理解酸、碱、盐、氧化物的概念及其相互联系。5.溶液 (1)了解溶液的含义。 (2)了解溶解度、饱和溶液的概念。
► 探究考向一 物质的组成、变化与简单分类—— 知 识 梳 理 —— 一、物质的组成 1.元素、物质及微粒间的关系 (1)宏观上物质是由元素组成的,微观上物质是由________、________或________构成的。 (2)元素:具有______________的一类原子的总称。 (3)元素与物质的关系 (4)元素在物质中的存在形态 ①游离态:元素以________形式存在的状态。
②化合态:元素以_________形式存在的状态。 (5)元素、物质及微粒间的关系如图2-3-1所示 2.混合物和纯净物 (1)纯净物:________________________________。 (2)混合物:_________________________________。
由同种单质或化合物组成的物质
由几种不同的单质或化合物组成的物质
二、物质的分类 1.简单分类法概述 (1)分类是学习和研究化学物质及其变化的一种常用科学方法。 (2)分类应依据事先设定的“________”进行,“________”不同,分类方法也不相同。
2.分类法 (1)交叉分类法:
(2)树状分类法
三、化学反应的分类
【触摸高考】 高考选项正误判断
—— 核心突破 —— 1.无机物的分类
2.物理变化和化学变化的判断根据是否有新物质生成辨析物理变化和化学变化。应注意:升华、萃取、分液、蒸馏(分馏)、吸附、盐析、金属导电、焰色反应、电离等都归为物理变化,脱水、蛋白质变性、水解、同素异形体互变、电解、熔融盐导电、电解质溶液导电等都归为化学变化。
提醒 ①化学变化中一定存在化学键的断裂和形成,但存在化学键断裂或形成的变化不一定是化学变化,如金属熔化、NaCl溶于水、NaCl晶体从溶液中析出、从浓盐酸中挥发出HCl气体等中虽有化学键断裂或形成,但仍属于物理变化。 ②化学变化与物理变化的联系:化学变化的过程中一定伴随着物理变化,而物理变化的过程中一定不发生化学变化。 ③化学变化研究的前提是原子核不变。核裂变虽有新物质生成,但不属于化学变化。
—— 典例精析 ——
► 探究考向二 分散系 胶体—— 知 识 梳 理 —— 1.分散系 (1)概念:分散系是指一种(或多种)物质分散在另一种(或多种)物质中所得到的体系。被分散的物质称为_________,起分散作用的物质称为__________。 (2)分类:
2.胶体(2)胶体的性质——丁达尔效应①定义:光束通过胶体时,形成__________________的现象。②解释或应用:胶体分散质的粒子比溶液中溶质的粒子大,使光波发生________。
3.Fe(OH)3胶体的制备 向沸水中逐滴加入________________,继续煮沸至液体呈________,停止加热,即制得Fe(OH)3胶体,离子方程式为________________________ __。 提醒 胶体与其他分散系的本质区别:胶体粒子的直径在1~100 nm之间,这是胶体的本质特征,也是胶体区别于其他分散系的依据,同时也决定了胶体的性质。
—— 核心突破 —— 1.胶体、溶液、浊液三类分散系的比较
提醒 由于胶体粒子较大,不能通过半透膜,而离子、分子较小,可以透过半透膜,故可用渗析法提纯胶体。
2.胶体性质的应用(1)丁达尔效应:鉴别溶液和胶体。(2)渗析:蛋白质的提纯。(3)吸附性:自来水净水。
► 易错1 物质分类的误区
[试答] ________[警示] 盐酸是HCl的水溶液,是混合物而非化合物。 提升解答这类试题误区:(1)概念辨析不清,易将混合物和纯净物混淆,如盐酸。(2)某些大分子溶液其分散质直径在1~100 nm之间,而不是真正的溶液,其实为胶体。(3)某些俗称与物质类别不对应,如纯碱是盐类物质,硅藻土却是二氧化硅等。
【备选理由】 巩固常见物质的分类。 1.下列有关物质的分类正确的组合是( )
3.[2012•豫南九校联考] 分类是化学研究中常用的方法。下列分类方法中,不正确的是( ) ①根据元素原子最外层电子数的多少将元素分为金属和非金属 ②根据电解质在水溶液中能否完全电离将电解质分为强电解质和弱电解质 ③依据组成元素的种类,将纯净物分为单质和化合物 ④根据酸分子中含有的氢原子个数,将酸分为一元酸、二元酸等 ⑤根据氧化物中是否含有金属元素,将氧化物分为碱性氧化物、酸性氧化物
新高考化学一轮复习课件 第1章 第1讲 物质的组成、性质和分类: 这是一份新高考化学一轮复习课件 第1章 第1讲 物质的组成、性质和分类,共60页。PPT课件主要包含了高考化学一轮复习策略,物质的组成与分类,归纳整合,专项突破,物质的性质与变化,分散系胶体,真题演练明确考向,课时精练等内容,欢迎下载使用。
高考化学一轮复习课件第2章第1讲 物质的组成、性质与分类(含解析): 这是一份高考化学一轮复习课件第2章第1讲 物质的组成、性质与分类(含解析),共53页。PPT课件主要包含了知识点1,知识点2,知识点3,训练四等内容,欢迎下载使用。
(新高考)高考化学大一轮复习课件第1章第1讲物质的组成、性质和分类(含解析): 这是一份(新高考)高考化学大一轮复习课件第1章第1讲物质的组成、性质和分类(含解析),共60页。PPT课件主要包含了复习目标,物质的组成与分类,物质的组成1,不同种单质,金属氧化物,碱性氧化物,两性氧化物,非金属氧化物,酸性氧化物,不成盐氧化物等内容,欢迎下载使用。












