






高考化学总复习重点精品课件:_焓变-0反应热
展开(1)从化学键的变化角度分析,化学反应的本质是反应物分子内化学键的 和生成物分子内化学键的 。 (2)一个确定的化学反应是吸收能量还是放出能量,决定于反应物的总能量与生成物的总能量的 。
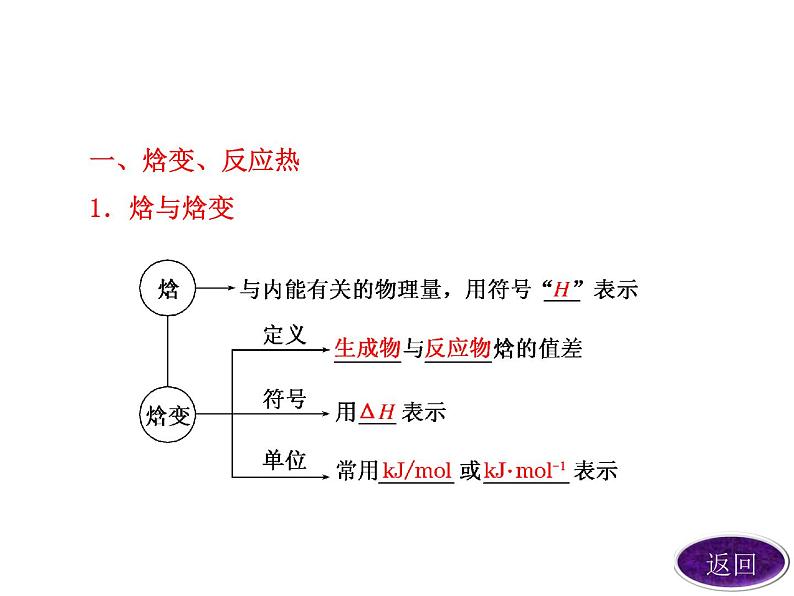
一、焓变、反应热1.焓与焓变
2.焓变与反应热的关系 等压条件下(反应热在不做其他功的情况下),化学反应的焓变 化学反应的反应热。
二、吸热反应与放热反应1.化学键与化学反应中能量变化的关系
若E1>E2,反应 能量,ΔH 0,为 反应;若E1
1.判断正误(正确打“√”号,错误打“×”号)。(1)化学变化过程是原子的重新组合过程。( )(2)化学反应可分为吸热反应和放热反应。( )(3)化学反应中的能量变化都是以热能形式表现出来的。( )(4)吸热反应过程是化学能转变为热能的过程。( )(5)生成物总能量高于反应物总能量的反应是吸热反应。( )答案:(1)√ (2)√ (3)× (4)× (5)√
2.下列说法正确的是( )A.反应热就是反应中放出的热量B.当反应放热时ΔH>0,反应吸热时ΔH<0C.一个化学反应中,当反应物的总能量大于生成物的总能量时,反应放热,ΔH为“-”D.一个化学反应中,生成物总键能大于反应物的总键能时,反应吸热,ΔH为“+”
分析:反应热也指反应中吸收的热量,A错;在反应中生成物比反应物所具有的总能量减少,反应就放热,反之就吸热,C对;化学反应的实质是旧化学键的断裂,新化学键的形成,断键时吸收能量即反应物键能,成键时放出能量即生成物键能,后者大,则反应为放热反应,ΔH为“-”,D错。答案:C
3.下图所表示的反应是吸热反应的是( )
分析:当生成物的总能量大于反应物总能量时,该反应为吸热反应。答案:A
(1)从该图中你能获得什么信息?(2)你能计算出该反应过程中能量变化为多少吗?
分析:(1)由图可知断裂1 ml H—H键要吸收436 kJ的能量,断裂 1 ml Cl—Cl 键要吸收243 kJ的能量,H原子与Cl 原子结合生成1 ml HCl 时放热431 kJ的能量。(2)生成2 ml HCl放出的能量为:431 kJ×2-436 kJ-243 kJ=183 kJ。答案:(1)发生化学反应,反应物断裂化学键需吸收能量,生成物形成化学键需放出能量 (2)放出183 kJ的能量
1.从物质所具有的能量角度 如果反应物所具有的总能量高于生成物的总能量,发生化学反应时,有一部分能量就会以热能的形式释放出来,是放热反应;反之则是吸热反应。即E总(反应物)>E总(生成物),为放热反应;E总(反应物)
A.氢气和氯气反应生成2 ml氯化氢气体,反应的ΔH=+183 kJ/mlB.氢气和氯气反应生成2 ml 氯化氢气体,反应的ΔH=-183 kJ/mlC.氢气和氯气反应生成 1 ml 氯化氢气体,反应的ΔH=-183 kJ/mlD.1 ml H2和1 ml Cl2的总能量比 2 ml HCl的总能量低183 kJ
[解析] 因为ΔH=反应物中化学键断裂吸收的能量之和-生成物中化学键生成释放的能量之和。根据反应方程式:H2+Cl2===2HCl,可知,该反应的ΔH=(436+243-431×2)kJ/ml=-183 kJ/ml,故B正确;该反应为放热反应,反应物的总能量高,D错误。[答案] B
化学反应遵守能量守恒定律,用E表示物质本身的能量,Q表示从外界吸收或放出的能量,则有E(反应物)+Q吸=E(生成物)+Q放(Q吸也可理解为反应物中化学键断裂吸收的能量,Q放为生成物中化学键形成放出的能量)。那么ΔH=E(生成物)-E(反应物)=Q吸-Q放。
1.判断化学反应放热或吸热的方法 (1)根据ΔH的“+”和“-”判断。 ΔH为“+”为吸热反应,ΔH为“-”为放热反应。 (2)根据反应物和生成物的总能量差判断。 若E(反应物)>E(生成物),为放热反应;若E(生成物)>E(反应物),则为吸热反应。
(3)根据反应物和生成物的键能差判断。 若反应物的总键能大于生成物的总键能,则为吸热反应;若生成物的总键能大于反应物的总键能,则为放热反应。 (4)根据反应类型或具体的化学反应判断。
2.常见的吸热反应和放热反应(1)常见的放热反应有:①活泼金属与H2O或酸的反应,如2Al+6HCl===2AlCl3+3H2↑;②酸碱中和反应,如2KOH+H2SO4===K2SO4+2H2O;
[注意] (1)需要加热才能进行的反应不一定都是吸热反应,如木炭的燃烧。 (2)常温下就能进行的反应不一定都是放热反应,如氢氧化钡晶体和氯化铵固体的反应。 (3)任何化学反应都伴随着能量变化,但能量变化不一定都表现为热量变化,还可能以声、光、电等形式表现出来。
[例2] 下列图示变化为吸热反应的是( )
[解析] A项中的图像表示生成物的能量比反应物的能量高,故为吸热反应;B项中的图像表示反应物比生成物的能量高,故为放热反应;浓硫酸溶解于水放热,但因不是化学变化,故不是放热反应;锌与盐酸反应是放热反应。 [答案] A
物质变化过程中放出热量(或吸收热量)不一定是放热反应(或吸热反应),如浓H2SO4、NaOH固体溶于水放热,NH4NO3溶于水吸热,它们不是放热反应或吸热反应,而是物理变化过程。
点击下图进入“课堂10分钟练习”
(1)反应在恒压条件下进行时,反应热又称焓变,符号为ΔH,单位:kJ/ml。ΔH=H(生成物)-H(反应物)。 (2)ΔH为“-”或ΔH<0,为放热反应;ΔH为“+”或ΔH>0,为吸热反应。 (3)反应物的总能量大于生成物的总能量时,该反应为放热反应,反之,该反应为吸热反应;反应物的键能总和小于生成物的键能总和时,该反应为吸热反应,反之,放热反应。
高中化学人教版 (2019)选择性必修1第一节 反应热精品ppt课件: 这是一份高中化学人教版 (2019)选择性必修1第一节 反应热精品ppt课件,共28页。PPT课件主要包含了Qcm△t,随堂小练等内容,欢迎下载使用。
人教版 (2019)选择性必修1第一节 反应热精品课件ppt: 这是一份人教版 (2019)选择性必修1第一节 反应热精品课件ppt,共29页。PPT课件主要包含了能力提升等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修1第一节 反应热完美版课件ppt: 这是一份高中化学人教版 (2019)选择性必修1第一节 反应热完美版课件ppt,共51页。PPT课件主要包含了第一节反应热,知识梳理,正误判断,问题导学,核心突破,试题调研,完成课时作业一,课后作业等内容,欢迎下载使用。












