



【辽宁新高考】2021年高三化学全真模拟卷07
展开2021年辽宁省普通高等学校招生考试全真模拟卷
化学试卷07
本卷满分100分,考试时间75分钟。
一、选择题:本题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.化学与生产和生活密切相关。下列有关说法正确的是
A.古代记载文字的器物“甲骨”与“丝帛”成分相同
B.苏打可用于制作发酵粉,在医疗上也可以用作治疗胃酸过多
C.酿酒过程中葡萄糖在酒化酶的作用下发生水解反应生成乙醇
D.用于制作N95型口罩的“熔喷布”主要原料是聚丙烯,聚丙烯是有机高分子化合物
2.下列有关化学用语表示正确的是
A.乙酸乙酯和葡萄糖的实验式都为CH2O
B.甲烷二氟代物CH2F2的电子式为
C.中子数为6和8的碳原子的结构示意图都为
D.纯碱溶液呈碱性的原因:
3.W、X、Y、Z是同周期主族元素,Y的最外层电子数是X次外层电子数的3倍,四种元素与锂组成的盐是一种新型锂离子电池的电解质,结构如图。下列说法错误的是
A.第一电离能由大到小为W>Y>Z>X
B.W元素的非金属性比Y强
C.Y的单质都是非极性分子
D.r(Li+)<r(W−)
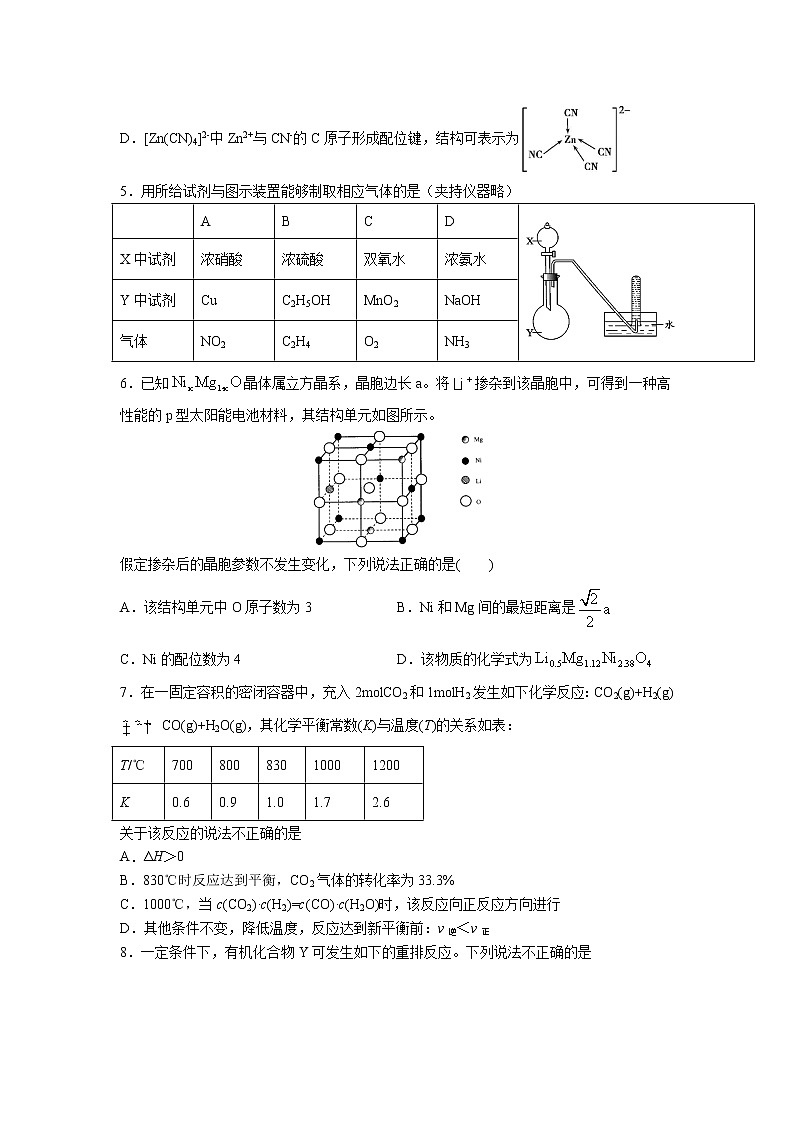
4.[Zn(CN)4]2-在水溶液中可与HCHO发生反应生成[Zn(H2O)4]2+和HOCH2CN,下列说法错误的是
A.Zn2+基态核外电子排布式为[Ar]3d10
B.1mol HCHO分子中含有σ键的数目为1.806×1024
C.HOCH2CN分子中碳原子轨道的杂化类型是sp3
D.[Zn(CN)4]2-中Zn2+与CN-的C原子形成配位键,结构可表示为
5.用所给试剂与图示装置能够制取相应气体的是(夹持仪器略)
| A | B | C | D | |
X中试剂 | 浓硝酸 | 浓硫酸 | 双氧水 | 浓氨水 | |
Y中试剂 | Cu | C2H5OH | MnO2 | NaOH | |
气体 | NO2 | C2H4 | O2 | NH3 |
6.已知晶体属立方晶系,晶胞边长a。将掺杂到该晶胞中,可得到一种高性能的p型太阳能电池材料,其结构单元如图所示。
假定掺杂后的晶胞参数不发生变化,下列说法正确的是( )
A.该结构单元中O原子数为3 B.Ni和Mg间的最短距离是
C.Ni的配位数为4 D.该物质的化学式为
7.在一固定容积的密闭容器中,充入2molCO2和1molH2发生如下化学反应:CO2(g)+H2(g)CO(g)+H2O(g),其化学平衡常数(K)与温度(T)的关系如表:
T/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
关于该反应的说法不正确的是
A.ΔH>0
B.830℃时反应达到平衡,CO2气体的转化率为33.3%
C.1000℃,当c(CO2)·c(H2)=c(CO)·c(H2O)时,该反应向正反应方向进行
D.其他条件不变,降低温度,反应达到新平衡前:v逆<v正
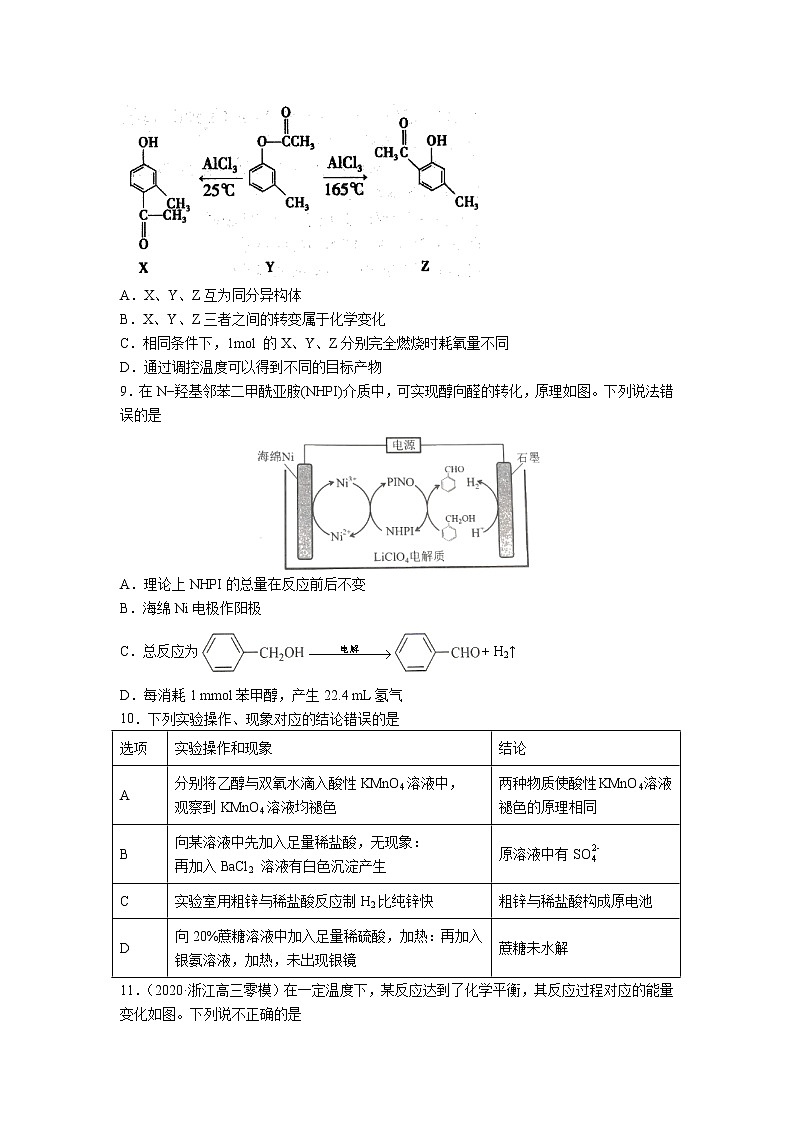
8.一定条件下,有机化合物Y可发生如下的重排反应。下列说法不正确的是
A.X、Y、Z互为同分异构体
B.X、Y、Z三者之间的转变属于化学变化
C.相同条件下,1mol 的X、Y、Z分别完全燃烧时耗氧量不同
D.通过调控温度可以得到不同的目标产物
9.在N−羟基邻苯二甲酰亚胺(NHPI)介质中,可实现醇向醛的转化,原理如图。下列说法错误的是
A.理论上NHPI的总量在反应前后不变
B.海绵Ni电极作阳极
C.总反应为+ H2↑
D.每消耗1 mmol苯甲醇,产生22.4 mL氢气
10.下列实验操作、现象对应的结论错误的是
选项 | 实验操作和现象 | 结论 |
A | 分别将乙醇与双氧水滴入酸性KMnO4溶液中, 观察到KMnO4溶液均褪色 | 两种物质使酸性KMnO4溶液褪色的原理相同 |
B | 向某溶液中先加入足量稀盐酸,无现象: 再加入BaCl2 溶液有白色沉淀产生 | 原溶液中有SO |
C | 实验室用粗锌与稀盐酸反应制H2比纯锌快 | 粗锌与稀盐酸构成原电池 |
D | 向20%蔗糖溶液中加入足量稀硫酸,加热:再加入银氨溶液,加热,未出现银镜 | 蔗糖未水解 |
11.(2020·浙江高三零模)在一定温度下,某反应达到了化学平衡,其反应过程对应的能量变化如图。下列说不正确的是
A.Ea为催化剂存在下该反应的活化能,Ea′为无催化剂时该反应的活化能
B.该反应为放热反应,△H=Ea-Ea′
C.活化分子是能最较高、有可能发生有效碰撞的分子
D.催化剂是通过降低反应所需的活化能来同等程度的增大正逆反应速率,使平衡不移动
12.混合物M中可能含有A12O3、Fe2O3、Al、Cu,为确定其组成,某同学设计如图所示分析方案。下列分析正确的是
A.已知m1>m2,则混合物M中一定含有Al2O3
B.生成蓝绿色溶液的离子方程式为Cu+Fe3+=Cu2++Fe2+
C.固体P既可能是纯净物,又可能是混合物
D.要确定混合物M中是否含有Al,可取M加入过量NaOH溶液
13.2020年3月29日,全球新能源汽车领导者比亚迪宣布正式推出“刀片电池”。“刀片电池”是将传统磷酸铁锂电池电芯加长,使单个电芯形状扁平、窄小,再通过多个“刀片”捆扎形成模组,通过少数几个大模组的组合成电池。“刀片电池”放电时结构如下,正极反应为:Li1-xFePO4+xe-+xLi+=LiFePO4,下列说法错误的是( )
A.“刀片电池”和三元锂电池(镣钻锭酸锂电池)相比几乎没有污染
B.放电时,负极反应为LiC6-xe-=xLi++Li1-xC6
C.充电时,锂离子在阴极脱嵌;放电时,锂离子在正极脱嵌
D.该电池维持电流强度4.825A,工作10分钟,理论上正极增加重量0.21g(已知F=96500C/mol)
14.室温下,下列有关结论正确的是( )
A.向稀醋酸中加水稀释使电离程度增大,溶液pH减小
B.将CH3COONa溶液从20℃升温至30℃,溶液中增大
C.向0.1mol·L-1的NaHSO3溶液中加入氨水至中性,则c(Na+)+c(NH)=2c(SO)+c(HSO)
D.为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH。若pH<7,则H2A是强酸
15.草酸钙具有优异光学性能.在水中的沉淀溶解平衡曲线如图所示(T1>T2).已知T1时Ksp(CaC2O4)=6.7×10−4。下列说法错误的是
A.图中a的数量级为10−2
B.升高温度,m点的饱和溶液的组成由m沿mq线向q方向移动
C.恒温条件下,向m点的溶液加入少量Na2C2O4固体,溶液组成由m沿曲线向p方向移动
D.T1时,将浓度均为0.03mol/L的草酸钠和氯化钙溶液等体积混合,不能观察到沉淀
二、非选择题:本题共4小题,共55分。
16.(14分)
用硼镁矿(主要成分为,含、、铁和铝的氧化物等杂质)生产硼酸并回收硫酸镁的工艺流程如图:
回答下列问题:
(1)60 g中含有_______NA个σ键。
为避免“酸浸”产生大量气泡使物料溢出,应采取的措施为_______。
(2)“除杂”时向滤液中加入H2O2和试剂a,H2O2的作用为_______(用离子方程式表示).试剂a为_______。
(3)硫酸镁的溶解度随温度变化曲线如图所示,得到的温度范围为_______,为从“母液”中充分回收,应保持“母液”在_______℃以上蒸发浓缩、_______,再用乙醇洗涤后干燥。
(4)加热硫酸镁晶体,得到硫酸镁固体,则硫酸镁晶体的结晶水含量x=_______。
17.(14分)碘是人体必需的微量元素,也可用于工业、医药等领域。大量的碘富集于海藻灰〔主要成分是)中,因此从海藻灰中提取碘,可有效利用海洋资源。
(1)某兴趣小组以海藻灰为原料进行的制备实验。具体步骤如下:将海藻灰加热浸泡后,得到了溶液,将适量固体溶于溶液,再将饱和溶液滴入上述溶液中,生成白色沉淀,该反应的离子方程式为______。
(2)待沉淀完全后,过滤,将沉淀物置于小烧杯中,在搅拌下逐滴加入适量浓,观察到______(颜色)气体放出,______(颜色)晶体析出。出于安全和环保考虑,该实验操作需在______(条件)下进行。该反应的化学方程式为______。
(3)用倾析法弃去上清液,固体物质用少量水洗涤后得到粗,进一步精制时,选择必需的仪器搭建装置,并按次序排列:______(夹持装置略)。
A. B. C. D. E. F.
(4)将精制得到的配成浓度为的标准溶液,用来测定某样品中维生素C(相对分子质量为M的含量。具体操作如下:准确称量ag样品,溶于新煮沸过并冷却至室温的蒸馏水中,煮沸蒸馏水的目的是______。用容量瓶定容,使用______(仪器)量取样品溶液于锥形瓶中,再加入1∶1醋酸溶液和适量的______指示剂,立即用标准溶液滴定,溶液显稳定的______(颜色)即为滴定终点,消耗标准溶液,则样品中维生素C的质量分数是______(写出表达式)。已知滴定反应方程式:
17.(13分)研究碳、氮、硫等元素化合物的性质或转化对建设生态文明、美丽中国具有重要意义。
(1)海水中无机碳的存在形式及分布如图所示,用离子方程式表示海水呈弱碱性的主要原因_______。已知春季海水pH=8.1,冬季海水碱性会减弱,理由是_______。
(2)工业上以CO和H2为原料合成甲醇的反应:CO(g)+2H2(g)=CH3OH(g) ΔH<0,在容积为1L的恒容容器中,分别在T1、T2、T3三种温度下合成甲醇。如图是上述三种温度下不同H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。下列说法正确的是_______(填字母)。
A.a、b、c三点H2转化率:c>a>b
B.上述三种温度之间关系为T1>T2>T3
C.c点状态下再通入1molCO和4molH2,新平衡中H2的体积分数增大
D.a点状态下再通入0.5molCO和0.5molCH3OH,平衡不移动
(3)NO加速臭氧层被破坏,其反应过程如下图所示:
①NO的作用是_______。
②已知:O3(g)+O(g)=2O2(g) ΔH=-143kJ·mol-1
反应1:O3(g)+NO(g)=NO2(g)+O2(g) ΔH1=-200.2kJ·mol-1。
反应2:热化学方程式为_______。
(4)若将CO和NO按不同比例投入一密闭容器中发生反应:2CO(g)+2NO(g)=N2(g)+2CO2(g) ΔH=-759.8kJ·mol-1,反应达到平衡时,N2的体积分数随n(CO)/n(NO)的变化曲线如下图。
①b点时,平衡体系中C、N原子个数之比接近_______。
②b、c、d三点的平衡常数从大到小的顺序为_______,对你的排序进行解释: _______。
③若n(CO)/n(NO)=0.8,反应达平衡时,N2的体积分数为20%,则NO的转化率为_______。
(19.(14分)
天然产物I具有抗肿瘤、镇痉等生物活性,可通过以下路线合成。
已知:+(Z=—COOR,—COOH等)
回答下列问题:
(1)A所含官能团的名称为________,F→G的反应类型为________。
(2)上述反应中B→C所需的试剂与条件是________,化合物X的结构简式为________。
(3)写出满足以下条件的D的一种同分异构体的结构简式_____。
①链状结构;②能发生银镜反应;③含有三种不同化学环境的氢原子。
(4)关于G、H的说法正确的是_____________(填序号)。
a.两者都能和溴水发生加成反应b.两者都能和氢氧化钠溶液发生反应
c.两者都能使酸性高锰酸钾褪色d.两者互为同系物
(5)以和为原料,合成,写出合成路线(无机试剂和不超过2个碳的有机试剂任选)。________(合成路线常用的表示方式)。
【辽宁新高考】2021年高三化学全真模拟卷01: 这是一份【辽宁新高考】2021年高三化学全真模拟卷01,文件包含辽宁新高考2021年高三化学全真模拟卷01原卷版docx、辽宁新高考2021年高三化学全真模拟卷01解析版docx等2份试卷配套教学资源,其中试卷共29页, 欢迎下载使用。
【辽宁新高考】2021年高三化学全真模拟卷04: 这是一份【辽宁新高考】2021年高三化学全真模拟卷04,文件包含辽宁新高考2021年高三化学全真模拟卷04原卷版docx、辽宁新高考2021年高三化学全真模拟卷04解析版docx等2份试卷配套教学资源,其中试卷共27页, 欢迎下载使用。
【辽宁新高考】2021年高三化学全真模拟卷06: 这是一份【辽宁新高考】2021年高三化学全真模拟卷06,文件包含辽宁新高考2021年高三化学全真模拟卷06原卷版docx、辽宁新高考2021年高三化学全真模拟卷06解析版docx等2份试卷配套教学资源,其中试卷共27页, 欢迎下载使用。












