所属成套资源:人教版 (新课标)化学必修1:教案
高中化学第二节 化学计量在实验中的应用教案
展开
这是一份高中化学第二节 化学计量在实验中的应用教案,共5页。教案主要包含了气体摩尔体积等内容,欢迎下载使用。
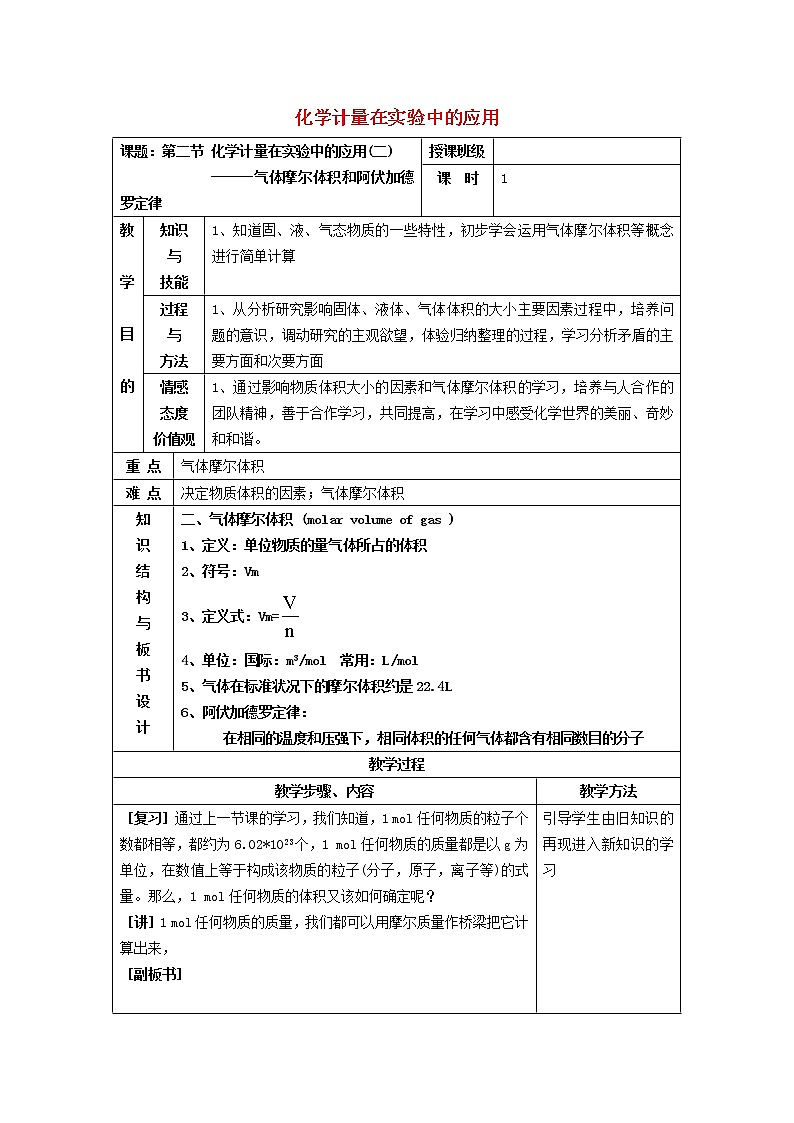
课题:第二节 化学计量在实验中的应用(二)
------气体摩尔体积和阿伏加德罗定律
授课班级
课 时
1
教
学
目
的
知识
与
技能
1、知道固、液、气态物质的一些特性,初步学会运用气体摩尔体积等概念进行简单计算
过程
与
方法
1、从分析研究影响固体、液体、气体体积的大小主要因素过程中,培养问题的意识,调动研究的主观欲望,体验归纳整理的过程,学习分析矛盾的主要方面和次要方面
情感
态度
价值观
1、通过影响物质体积大小的因素和气体摩尔体积的学习,培养与人合作的团队精神,善于合作学习,共同提高,在学习中感受化学世界的美丽、奇妙和和谐。
重 点
气体摩尔体积
难 点
决定物质体积的因素;气体摩尔体积
知
识
结
构
与
板
书
设
计
二、气体摩尔体积 (mlar vlume f gas )
1、定义:单位物质的量气体所占的体积
2、符号:Vm
3、定义式:Vm=
4、单位:国际:m3/ml 常用:L/ml
5、气体在标准状况下的摩尔体积约是22.4L
6、阿伏加德罗定律:
在相同的温度和压强下,相同体积的任何气体都含有相同数目的分子
教学过程
教学步骤、内容
教学方法
[复习]通过上一节课的学习,我们知道,1 ml任何物质的粒子个数都相等,都约为6.02*1023个,1 ml任何物质的质量都是以g为单位,在数值上等于构成该物质的粒子(分子,原子,离子等)的式量。那么,1 ml任何物质的体积又该如何确定呢?
[讲]1 ml任何物质的质量,我们都可以用摩尔质量作桥梁把它计算出来,
[副板书]
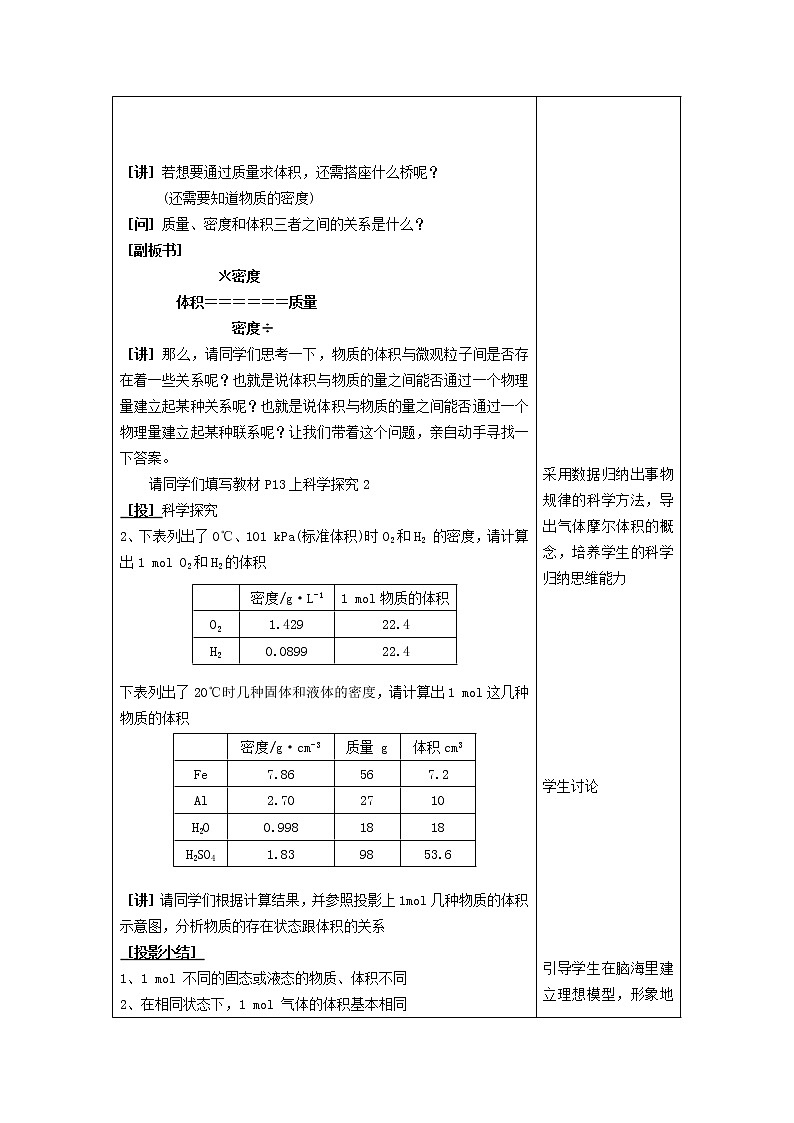
[讲]若想要通过质量求体积,还需搭座什么桥呢?
(还需要知道物质的密度)
[问]质量、密度和体积三者之间的关系是什么?
[副板书]
*密度
体积======质量
密度÷
[讲]那么,请同学们思考一下,物质的体积与微观粒子间是否存在着一些关系呢?也就是说体积与物质的量之间能否通过一个物理量建立起某种关系呢?也就是说体积与物质的量之间能否通过一个物理量建立起某种联系呢?让我们带着这个问题,亲自动手寻找一下答案。
请同学们填写教材P13上科学探究2
[投]科学探究
密度/g·L-1
1 ml物质的体积
O2
1.429
22.4
H2
0.0899
22.4
2、下表列出了0℃、101 kPa(标准体积)时O2和H2 的密度,请计算出1 ml O2和H2的体积
密度/g·cm-3
质量 g
体积cm3
Fe
7.86
56
7.2
Al
2.70
27
10
H2O
0.998
18
18
H2SO4
1.83
98
53.6
下表列出了20℃时几种固体和液体的密度,请计算出1 ml这几种物质的体积
[讲]请同学们根据计算结果,并参照投影上1ml几种物质的体积示意图,分析物质的存在状态跟体积的关系
[投影小结]
1、1 ml 不同的固态或液态的物质、体积不同
2、在相同状态下,1 ml 气体的体积基本相同
3、同样是1 ml 物质,气体和固体的体积相差很大。(1 ml H2O在液态时是18 mL,在100 ℃气态时约为3.06*104 mL ,相差约1700倍
[问]一堆排球、一堆篮球,都紧密堆积,哪一堆球所占体积更大?
如果球的数目都为一百个呢?
如果球和球之间都间隔1米,在操场上均匀地分布,哪一堆球所占总的体积更大?
[投影]液态水变成水蒸气的图的动画模拟。
[投影]固体Fe、液体H2O、气体CO2粒子间距示意图
[投影小结]
决定物质体积大小有三个因素:
①物质所含结构微粒数多少;
②微粒间的距离(固态、液态距离小,排列紧密,气态分子间排列疏松)
③微粒本身的大小(液态时小,气态时大)
[讲]在我们计算中,物质的粒子数是相同的,都是1 ml,那么后两个因素对体积大小有什么影响呢?
[小结]对于固体和液体来说,粒子间距离非常小,主要取决于粒子本身的大小,对于气态来说,粒子间大小相差无几,主要取决于粒子间的距离。
[讲]现在我们清楚了固、液、气态体积的决定因素。再进一步考虑,为什么相同外界条件下,1 ml固态、液态物质所具有的体积不同,而1 ml 气体物质所具有的体积却基本相同?
[小结]在固态和液态中,粒子本身的大小不同决定了其体积不同,而不同的气体在一定的外界条件下,分子间的距离可看作近似相同,
同时,由我们所学的物理知识可知,粒子间距离主要受环境也就是温度和压强的影响,因此,在谈到气体体积时必须注明外界条件。
[过]事实上,在我们学习生活乃至科研领域,用得更多的气体的体积,而不是质量。无数实验事实证明,外界条件相同时,物质的量相同的任何气体都含有相同的体积。这给我们研究气体提供了很大的方便,为些,我们专门引出了气体摩尔体积的概念,这也是我们这节课所要学习的内容
[板书]二、气体摩尔体积 (mlar vlume f gas )
1、定义:单位物质的量气体所占的体积
[讲]气体摩尔体积即气体的体积与气体的物质的量之比
[板书]
2、符号:Vm
3、定义式:Vm=
4、单位:国际:m3/ml 常用:L/ml
[讲]我们为了研究方便,通常将温度为O℃,压强101 kPa时的状况称为标准状态,根据大量实验事实证明,在标准状况下,1 ml任何气体的体积都约是22.4L
[板书]5、气体在标准状况下的摩尔体积约是22.4L
[投影]注意:
1.为了研究的方便,科学上把温度为0°C、压强为101 kPa规定为标准状态,用S·T·P表示。
2.气体摩尔体积仅仅是针对气体而言。
3.同温同压下,气体的体积只与气体的分子数目有关,而与气体分子的种类无关。
[点击试题]
判断正误
1.标况下,1 ml任何物质的体积都约为22.4 L。
2.1 ml气体的体积约为22.4 L。
3.标况下,1 ml O2和N2混合气(任意比)的体积约为22.4 L。
4.22.4 L气体所含分子数一定大于11.2 L气体所含的分子数。
5.任何条件下,气体的摩尔体积都是22.4 L。
6.只有在标况下,气体的摩尔体积才能是22.4 L。
[思考]同温同压下,如果气体的体积相同则气体的物质的量是否也相同呢?所含的分子数呢?
[总结]因为气体分子间的平均距离随着温度、压强的变化而改变,各种气体在一定的温度和压强下,分子间的平均距离是相等的。所以,同温同压下,相同体积气体的物质的量相等。所含的分子个数也相等。这一结论最早是由意大利科学家阿伏加德罗发现的,并被许多的科学实验所证实,成为定律,叫阿伏加德罗定律。
[板书]6、阿伏加德罗定律:
在相同的温度和压强下,相同体积的任何气体都含有相同数目的分子。
[讲]对这一定律的理解一定要明确,适用范围为气体。
在定律中有四同:“同温”、“同压”、“同体积”、“同分子数目”,三同就可定为一同。
[投影小结]
1、同温、同压下,同体积的两种气体必含有相同数目的分子
2、同T、P下,同分子数目的两种气体体积必然相同
3、同温下,两种气体体积相同,分子数也相同,则压强必然相等。
[总结]我们首先研究了影响物质的体积的因素有多种,对于气体,相同条件下,物质的量相同的气体含有相同的体积,为此,引入气体摩尔体积的概念。标准状况下,气体摩尔体积的数值约为22.4L/ ml。只要同学们掌握气体摩尔体积的概念和阿伏加德罗定律的涵义,很容易做气体的物质的量和体积之间的相关计算。
引导学生由旧知识的再现进入新知识的学习
采用数据归纳出事物规律的科学方法,导出气体摩尔体积的概念,培养学生的科学归纳思维能力
学生讨论
引导学生在脑海里建立理想模型,形象地分析物质体积决定因素,对学生进行空间想像能力和逻辑推理能力的训练。
学生积极思考,相互讨论,和老师一起共同归纳出决定物质所占体积大小的三个因素
温度越大,距离越大,导致热胀冷缩
压强越大,排列越紧,距离越大
(×,物质应是气体)
(×,未指明条件标况)
(√,气体体积与分子种类无关)
(×未指明气体体积是否在相同条件下测定)
(×,只在标况下)
(×,不一定)
学生思考并回答,由气体摩尔体积概念逐渐过渡到阿伏加德罗定律,易于学生理解和接受。
引导学生推导出阿伏加德罗定律的简单应用
相关教案
这是一份人教版 (新课标)选修5 有机化学基础第二节 有机化合物的结构特点教案设计,共9页。教案主要包含了物质的量的单位——摩尔,气体摩尔体积等内容,欢迎下载使用。
这是一份人教版 (新课标)必修1第一章 从实验学化学第二节 化学计量在实验中的应用教案,共5页。
这是一份化学人教版 (新课标)第二节 化学计量在实验中的应用教学设计及反思,共6页。