
福建省泉州市2021届高中毕业班4月质量检测(四)化学试题(word版 含答案)
展开
这是一份福建省泉州市2021届高中毕业班4月质量检测(四)化学试题(word版 含答案),共20页。试卷主要包含了单选题,工业流程题,原理综合题,实验题,结构与性质,有机推断题等内容,欢迎下载使用。
福建省泉州市2021届高中毕业班4月质量检测(四)化学试题学校:___________姓名:___________班级:___________考号:___________ 一、单选题1.化学与生产生活密切相关。下列说法错误的是A.浸泡高锰酸钾溶液的硅藻土可保鲜水果 B.用热苏打水清除炊具上残留的油污C.还原铁粉可作为糕点包装中的抗氧化剂 D.草木灰与氯化铵混合施用肥效更高2.下列说法正确的是A.蛋白质水解时中的C-N键断裂 B.糖类、油脂都是高分子化合物C.石油分馏、煤的干馏都是物理变化 D.聚乙烯和苯分子中均含有碳碳双键3.下列实验与离子方程式相对应且正确的是A.往溶液中滴加溶液:B.往中加入饱和溶液:C.往溶液中滴加盐酸:D.往溶液中滴加少量溶液:4.为阿伏加德罗常数的值。下列说法正确的是A.的中含有的化学键数目为B.与在光照下反应生成的分子数为C.溶液中阴离子数为D.与铁粉完全反应,转移电子数为5.兴趣小姐从某工业废液(含、、,少量的、、)中提取及液溴,流程如下图。
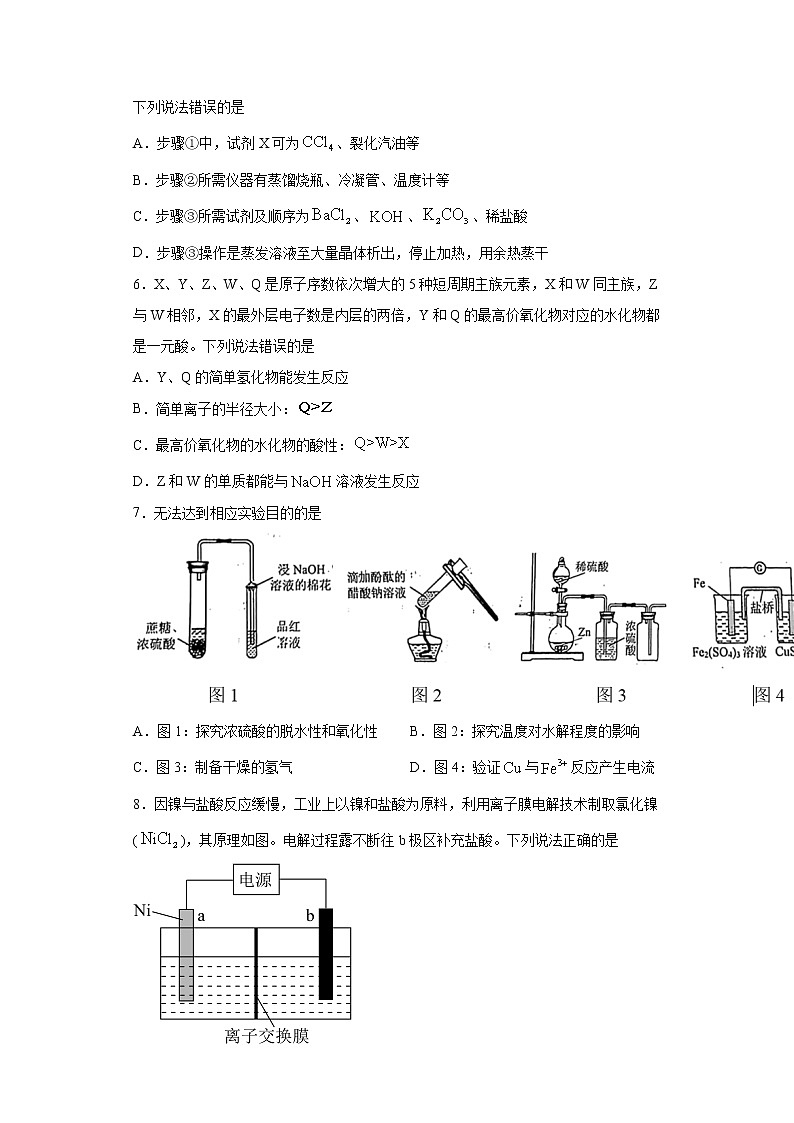
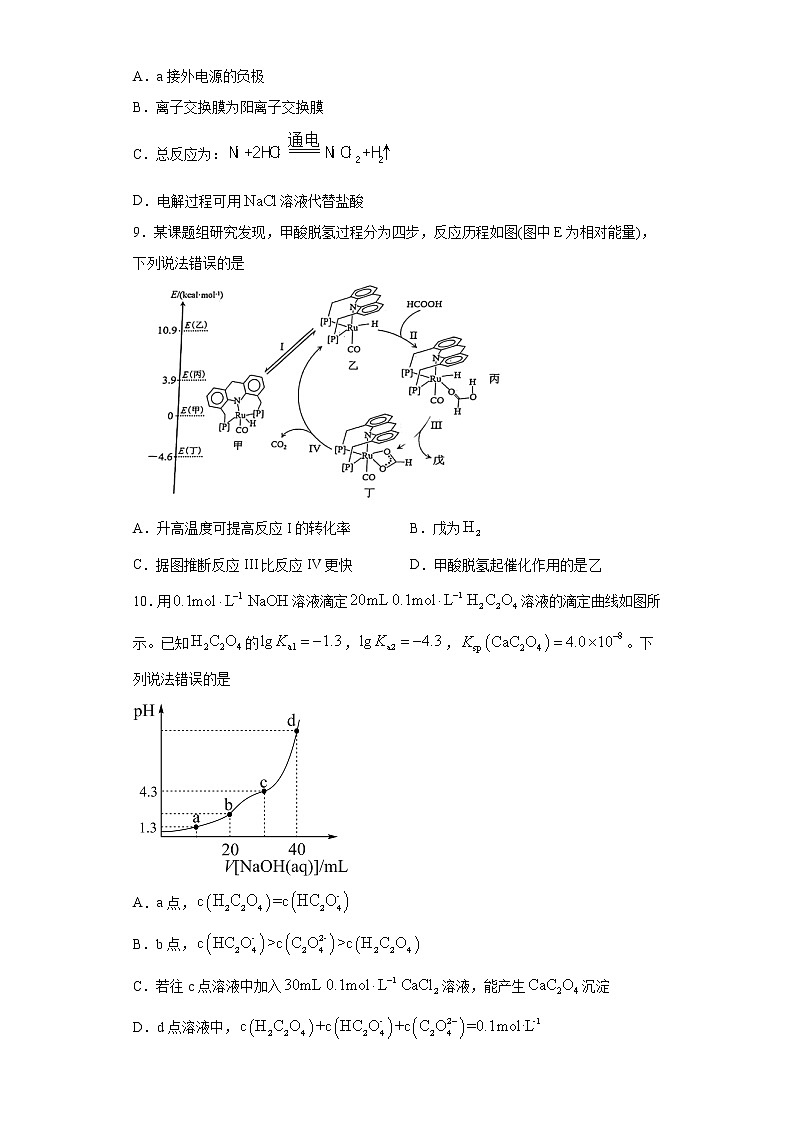
下列说法错误的是A.步骤①中,试剂X可为、裂化汽油等B.步骤②所需仪器有蒸馏烧瓶、冷凝管、温度计等C.步骤③所需试剂及顺序为、、、稀盐酸D.步骤③操作是蒸发溶液至大量晶体析出,停止加热,用余热蒸干6.X、Y、Z、W、Q是原子序数依次增大的5种短周期主族元素,X和W同主族,Z与W相邻,X的最外层电子数是内层的两倍,Y和Q的最高价氧化物对应的水化物都是一元酸。下列说法错误的是A.Y、Q的简单氢化物能发生反应B.简单离子的半径大小:C.最高价氧化物的水化物的酸性:D.Z和W的单质都能与溶液发生反应7.无法达到相应实验目的的是A.图1:探究浓硫酸的脱水性和氧化性 B.图2:探究温度对水解程度的影响C.图3:制备干燥的氢气 D.图4:验证与反应产生电流8.因镍与盐酸反应缓慢,工业上以镍和盐酸为原料,利用离子膜电解技术制取氯化镍(),其原理如图。电解过程露不断往b极区补充盐酸。下列说法正确的是A.a接外电源的负极B.离子交换膜为阳离子交换膜C.总反应为:D.电解过程可用溶液代替盐酸9.某课题组研究发现,甲酸脱氢过程分为四步,反应历程如图(图中E为相对能量),下列说法错误的是A.升高温度可提高反应I的转化率 B.戊为C.据图推断反应III比反应IV更快 D.甲酸脱氢起催化作用的是乙10.用溶液滴定溶液的滴定曲线如图所示。已知的,,。下列说法错误的是A.a点,B.b点,C.若往c点溶液中加入溶液,能产生沉淀D.d点溶液中, 二、工业流程题11.用锑砷烟灰(主要成分为、,含、、等元素)制取和(),不仅治理了砷害污染,还可综合回收其它有价金属。工艺流程如图:已知:①硫浸后,锑砷以、存在;②易溶于热水,难溶于冷水,不溶于乙醇。回答下列问题:(1)“硫浸”过程,加快硫浸的措施有_______(任写一项)。(2)“硫浸”时,溶解的离子方程式为_______。(3)经“硫浸”“氧化”后,转化为。用和浸取锑砷烟灰也可得到,其缺陷是_______。(4)“氧化”时,反应温度不宜太高的原因是_______。(5)“中和”时,生成的化学方程式为_______,中和液的主要溶质为_______(填化学式)。(6)操作X为_______、过滤、洗涤、干燥。(7)研究发现,电解硫浸液中的溶液,可得到单质。则阴极的电极反应式为____。 三、原理综合题12.工业合成尿素以NH3和CO2作为原料,在合成塔中存在如下转化:
回答下列问题:(1)液相中,合成尿素总反应的热化学方程式为:∆H=_______(2)在不同温度下,反应中CO2的转化率与时间的关系如图1。①温度T1_______T2(填“>”、“<”或“=”),原因是_______。②保持容器体积不变,在反应初期,可以提高单位时间内CO2转化率措施有_______。a.增大氨气的浓度b.通入惰性气体c.升高温度d.增大水的分压(分压=总压×物质的量分数)(3)在液相中,CO2的平衡转化率与温度、初始氨碳比、初始水碳比关系如图2。①曲线A、B,W较大的曲线是_______(填“A”或“B”)。②其它条件不变时,随着温度的升高,平衡转化率下降的原因是_______。③对于液相反应常用某组分M达到平衡时的物质的量分数x(M)表示平衡常数(记作Kx),195℃时,则该反应中N点的平衡常数Kx=_______。 四、实验题13.某化学兴趣小组设计如下实验探究硫代硫酸钠()的化学性质。资料:①溶液在酸性条件下分解:②回答下列问题:I.实验一 溶液的酸碱性(1)可用_______试纸测定该溶液的酸碱性。II.实验二 溶液的还原性取溴水于试管中,滴加溶液至溴水褪色。(2)该反应的离子方程式为_______。III.实验三 探究的热分解产物设计如图所示装置进行实验,实验过程中观察到试管内固体熔化、沸腾。反应后,试管中观察到白色物质夹杂着较多淡黄色固体。(3)实验开始时,应先点燃_______处的酒精灯,目的是_______。(4)兴趣小组对分解产物的组成提出四种观点:甲观点:、S乙观点:、、S丙观点:、S丁观点:、、S①为了证明丙观点是错误的,需检验产物中有,实验方案是_______。②取少量固体加入稀硫酸,将生成的气体通入品红溶液,观察到品红溶液褪色。该实验不能证明产物中一定有,理由是_______。③甲和乙观点是错误的,说明理由_______(任选一种观点回答)。④经实验证实,丁观点是正确的。写出分解反应的化学方程式:_______。 五、结构与性质14.N、P、、(锑)、(铋)属于氮族元素。(1)位于第五周期,基态原子的价层电子排布式为_______。(2)为离子型晶体,晶体中含有和。晶体中电负性最大的元素为___,的空间构型为___。(3)与气体相遇发生反应生成晶体①晶体中,B原子的杂化轨道类型为_______。②晶体中不存在的作用力有_______。a.键 b.键c.离子键 d.配位键 e.范德华力(4)已知物质沸点/62.8130.2900.0解释表中物质之间沸点差异的原因_______。(5)铋化锂的晶体结构如下:①铋化锂的化学式为_______。②相对铋原子,晶体中锂原子有两种位置,都以铋原子为中心,锂原子围绕铋原子。锂原子构成的空间结构分别为四面体和__体。 六、有机推断题15.E-苯酮是合成原药烯酰吗啉的重要中间体。合成E-苯酮的某工艺流程如图:
回答下列问题:(1)有关A、D、E-苯酮的下列说法正确的是_______。a.三者可用酸性KMnO4溶液鉴别b.一定条件下,三者均能与NaOH溶液反应c.一定条件下,1molE-苯酮最多与7molH2反应d.E-苯酮分子中所有碳原子一定在同一平面上(2)A的名称为_______。(3)B的结构简式为_______。(4)步骤IV反应的化学方程式为_______,含有的官能团名称为_______。(5)步骤V的反应类型为_______。(6)写出符合下列条件的C的同分异构体的结构简式_______。①能发生银镜反应;②核磁共振氢谱有3组峰;③含有苯环
参考答案1.D【详解】A.高锰酸钾具有强氧化性,能与水果产生的乙烯气体反应,使催熟时间延迟,能保鲜水果,故A正确;B.苏打是Na2CO3,其水溶液由于碳酸根水解而呈碱性,加热促进水解,碱性增强,能除油污,故B正确;C.铁粉可吸收空气中的氧气和水蒸气,能做为食品的抗氧化剂,故C正确;D.草木灰具有碱性,能与氯化铵反应生成氨气,降低肥效,故D错误;故选:D。2.A【详解】A.蛋白质水解时,中的C-N键断裂,A项正确;B.单糖和双糖及油脂都不是高分子化合物,B项错误;C.石油的分馏是物理变化,煤的干馏是化学变化,C项错误;D.聚乙烯中没有碳碳双键,苯分子中含有介于碳碳双键和碳碳单键之间的独特的键,D项错误;答案选A。3.B【详解】A.NaHS是酸式盐能与碱反应,离子方程式为:OH-+HS-=S2-+H2O,故A错误;B.饱和溶液中碳酸根的浓度较高,可实现沉淀的转化,离子方程式为:,故B正确;C.两者不能发生氧化还原反应,故C错误;D.少量的KOH,氢氧根先与铝离子反应,离子方程式为:Al3++3OH-=Al(OH)3↓,故D错误;故选:B。4.A【详解】A.34gH2O2物质的量为,含有的化学键数目为3NA,故A正确;B.甲烷与氯气发生取代反应为连锁反应,同时得到四种氯代产物,所以0.1mol CH4与Cl2在光照下反应生成的CH3Cl分子数小于0.1NA,故B错误;C.碳酸根离子为弱酸根离子,水溶液中部分水解生成碳酸氢根离子和氢氧根离子,所以1L 10mol•L-1的Na2CO3溶液中,阴离子数大于1NA,故C错误;D.气体状况未知,无法计算氯气物质的量和转移电子数,故D错误;
故选:A。5.A【详解】A.裂化汽油中含有烯烃,芳香烃,二烯烃等,含有碳碳双键,可以和溴发生加成反应,而步骤①的目的是用Cl2与溴离子发生反应生成溴单质,Br2溶解在有机物中与氯离子分离通过步骤②得到单质溴,故A中试剂可以是四氯化碳,但不能是裂化汽油,A项错误;B.步骤②是通过蒸馏的方法分离溴单质和有机相,涉及仪器有蒸馏烧瓶、冷凝管、温度计等,B项正确;C.步骤③属于氯化钾的提纯,加氯化钡除硫酸根离子,氢氧化钾除钙离子,过滤后再向滤液中加入过量的HCl和多余的KOH和碳酸钾,C项正确;D.蒸发结晶操作时,就是待出现大量晶体析出时停止加热,用余热蒸干,D项正确;答案选A。6.C【分析】X、Y、Z、W、Q是原子序数依次增大的5种短周期主族元素,X的最外层电子数是内层的两倍,则X为C,X和W同主族,则W为Si,Z与W相邻且原子序数小于W,则Z为Al,Y和Q的最高价氧化物对应的水化物都是一元酸,且Q原子序数更大,则Y为N,Q为Cl。【详解】A.氨气与氯化氢能反应生成氯化铵,A正确;B.氯离子有三个电子层,铝离子有两个电子层,所以氯离子半径更大,B正确;C.非金属性:Cl>C>Si,则最高价氧化物的水化物的酸性:,C错误;D.Al和Si的单质都能与溶液发生反应,D正确;答案选C7.D【详解】A.图1:通过观察蔗糖是否碳化以及品红是否褪色来探究浓硫酸的脱水性和氧化性,A正确;B.图2:通过观察温度不同时溶液颜色变化来判断溶液碱性变化从而探究温度对水解程度的影响,B正确;C.图3:用硫酸与锌反应制取氢气,用硫酸干燥,然后用向下排空气法(短进长出)收集干燥的氨气,C正确;D.还原性强的铁与氧化性强的硫酸铁溶液直接反应,没有形成原电池,不会产生电流,D错误;答案选D8.C【详解】A.a是电解池的阳极,接外电源的正极,A错误;B.a电极失电子产生Ni2+,溶液中的氯离子在左池与Ni2+结合生成,所以氯离子要能由右池进入左池,则离子交换膜为阴离子交换膜,B错误;C.a电极失电子产生Ni2+,b为阴极,氢离子得电子生成氢气,所以总反应为:,C正确;D.电解过程若用溶液代替盐酸则右池水中氢离子放电,产生氢氧根,氢氧根进入左池,使Ni2+沉淀,降低产率,D错误;所以答案为C9.A【详解】A.由图可知,Ⅰ是乙甲的反应,为放热反应,故升高温度反应的转化率降低,A项错误; B.根据图中丙丁的原子减少可知戊为,B项正确;C.反应Ⅲ为放热反应,反应Ⅳ为吸热反应,放热反应更容易进行,故据图推断反应III比反应IV更快,C项正确;D.催化剂在化学反应中能改变其他物质的化学反应速率,而本身的质量和化学性质不变,由图可知,该循环过程从消耗乙结束,又以生成乙开始,且甲乙并无小分子物质生成,故乙为催化剂,D项正确;答案选A。10.D【详解】A.a点,pH=1.3,,,所以,则,A正确;B.b点,加入了20ml,此时溶液中的溶质为,根据分析可知的水解平衡常数,电离常数,所以电离大于水解,即,又因为电离和水解都很微弱,所以三者中浓度最大的为,所以,B正确;C.c点,pH=4.3,,,所以,则,若c点加入氢氧化钠为30ml,则溶质为相同量的和,溶液呈酸性,则电离大于的水解,从而导致若,若要,则加入的氢氧化钠溶液要小于30ml。往c点溶液中加入溶液,加入的一瞬间,总体积约为80ml,此时,,,大于,能产生沉淀,C正确;D.d点溶液中,溶液总体积约为60ml,根据物料守恒可知未发生改变,但是总体积增大,则减小,所以,D错误;答案选D。11.适当升温、增大反应物浓度、搅拌反应物等 有污染气体NO、等产生 温度过高,易分解 蒸发浓缩、冷却结晶 【分析】由已知信息①可知‘硫浸’发生反应的离子方程式为:、,‘氧化时’发生反应的离子方程式为:、,‘酸浸’中和稀盐酸反应氧化还原反应生成HSbO3,‘中和’中发生反应:。【详解】(1) 加快硫浸的措施有:适当升温、增大反应物浓度、搅拌反应物等;(2)由信息①硫浸后,转化成,不发生化合价变化,离子方程式为:;(3) 若用和浸取,在氧化时会产生污染性气体NO、NO2等;(4)‘氧化’中H2O2做氧化剂,若反应温度过高,H2O2会受热分解,影响氧化效果;(5) “中和”时,酸性的HSbO3和碱性的NaOH发生中和反应生成,化学方程式为:,在‘酸浸’一步中加入稀盐酸,则NaOH与HCl反应生成NaCl,故中和液的主要溶质为NaCl;(6)从Na3AsO4溶液中得到晶体,操作X为蒸发浓缩、冷却结晶、过滤、洗涤、干燥;(7) 阴极发生还原反应,是Sb元素的化合价从+3价降至0价,电极反应式为:。12.-93.7 > 图中T1的曲线斜率较大,反应速率较快,因此温度较高等 ac B 是放热反应,温度升高,平衡向逆方向移动 3.25 【详解】(1)液相中,发生反应和,两式相加得到合成尿素总反应的化学方程式:则∆H=,所以答案为:-93.7。(2)①由图可知,在T1时,二氧化碳转化率变化更快,即反应速率更快,所以T1对应的温度更高,温度T1>T2,原因是图中T1的曲线斜率较大,反应速率较快,因此温度较高。②反应,保持容器体积不变,在反应初期,反应未到达平衡,加快正反应速率可以提高单位时间内CO2转化率。a.增大氨气的浓度,正反应速率加快,a正确;b.通入惰性气体,反应物浓度不变,正反应速率未发生改变,b错误;c.升高温度,正反应速率加快,c正确;d.增大水的分压(分压=总压×物质的量分数),正反应速率未加快,d错误;答案选ac(3)①,当初始氨碳比相同时,初始水碳比越大,二氧化碳转化率越低,根据图像可知二氧化碳曲线A、B中B的二氧化碳转化率越低,所以W较大的曲线是B。②该反应为放热反应,其它条件不变时,随着温度的升高,平衡向逆方向移动,平衡转化率下降。③N点初始氨碳比为3,初始水碳比为0,二氧化碳转化率为75%,设初始的氨气物质的量为3amol,,则初始的二氧化碳物质的量为amol,消耗的二氧化碳物质的量为0.75amol,列出三段式:,平衡时物质的总量为3.25amol,则平衡常数Kx=,所以答案为3.25。13.pH A 排除装置中的空气(或氧气),防止等被氧化 取少量分解产物于试管中,加入足量稀盐酸,静置,取上层清液滴加溶液,若观察到有白色沉淀生成,则证明产物中含有,反之则没有。 若加热后的固体中有未分解的,加入硫酸也能产生 甲观点,反应前后原子无法守恒或乙观点,电子转移和原子守恒不能同时遵循 【分析】在实验一中可以用pH试纸来测量溶液的酸碱性。在实验二中,因为溶液具有还原性,故可与强氧化性的溴水发生反应生成和溴化钠。在实验三中,和反应生成氮气,用氮气排除装置中的空气,防止等被氧化,然后检验的分解产物。【详解】(1) 溶液不具有强氧化性漂白的能力,所以可以用pH试纸来测定该溶液的酸碱性。(2) 因为溶液具有还原性,故可与强氧化性的溴水发生反应生成和溴化钠,根据得失电子守恒和原子守恒,可以得出该反应的离子方程式为:。(3)为防止等被氧化,实验开始时,应先点燃A处的酒精灯,使和反应生成氮气,目的是用氮气排除装置中的空气,防止等被氧化。(4)①要检验产物有,需要检验是否含有硫酸根,操作是取少量分解产物于试管中,加入足量稀盐酸,静置,取上层清液滴加溶液,观察是否有白色沉淀生成,所以答案为:取少量分解产物于试管中,加入足量稀盐酸,静置,取上层清液滴加溶液,若观察到有白色沉淀生成,则证明产物中含有,反之则没有。②能使品红溶液褪色,除了与稀硫酸反应可以生成之外,若加热后的固体中有未分解的,加入硫酸也能产生。③甲观点认为反应产物为、S,该观点中Na与O的个数比不可能是1:2,即反应前后原子无法守恒;乙观点认为产物是、、S,该观点中电子转移和原子守恒不能同时遵循。④丁观点是正确的,即分解生成、、S,根据得失电子守恒和原子守恒,得出反应的化学方程式:。14. Cl或氯 正四面体 杂化 bc 是离子晶体沸点较高,和是分子晶体沸点较低,的相对分子质量大于的相对分子质量,分子间作用强,沸点高 正八面体 【详解】(1)Sb属于氮族元素,位于第五周期,价层电子排布式为:;(2)Al、P、Cl原子位于同一周期,则非金属性:Cl>P>Al,而Cl>H,非金属性越强,电负性越大,则晶体中电负性最大的元素为:Cl;中Al的价层电子数为4,没有孤电子对,空间构型为:正四面体;(3) ①晶体中B连接4个原子,电子对数为4,没有孤电子对,杂化轨道类型为:杂化; ②晶体中存在B—F键、N—H键,B提供空轨道,N提供孤对电子形成配位键,则该晶体中存在σ键、配位键和范德华力,不存在离子键和π键,故选:bc;(4) 表中物质之间沸点差异的原因:是离子晶体沸点较高,和是分子晶体沸点较低,的相对分子质量大于的相对分子质量,分子间作用强,沸点高;(5) ①铋化锂的晶体结构包含内层和外层,内层中有4个Bi原子、4个Li原子,外层根据均摊法可得Li原子有,则Li与Bi的个数比为(8+4):4=3:1,化学式为:;②根据图形知,正中心Li的上下左右前后6个方向都连着Li原子,所以空间结构分别为四面体和正八面体。15.bc 对氯甲苯或4-氯甲苯 +→+CO2↑+H2O 酯基 取代反应 和 【分析】和Cl2反应生成B,B和H2O、FeCl3反应生成,B的分子式为C7H4Cl4,由此推测B为;和H反应生成,和反应生成H,则H为。【详解】(1)a.A中苯环上含有-CH3,能和酸性高锰酸钾溶液反应生成,D中含有酚羟基,能被酸性高锰酸钾溶液氧化,E-苯酮不能和酸性高锰酸钾溶液反应,所以A、D均能使酸性高锰酸钾溶液褪色,故不能用酸性KMnO4溶液鉴别A、D、E-苯酮,a项错误;b.A中含有-Cl,可以和NaOH溶液发生取代反应,D为苯酚,可以和NaOH溶液发生酸碱中和反应,E-苯酮中含有-Cl,可以和NaOH溶液发生取代反应,b项正确;c.E-苯酮分子中含有2个苯环,可和6分子H2发生加成反应,E-苯酮分子中含有1个羰基,可与1分子H2反应,因此一定条件下,1molE-苯酮最多与7molH2反应,c项正确;d.醚键可以自由旋转,故E-苯酮分子中所有碳原子不一定在同一平面上,d项错误;答案选bc;(2)A的结构简式为,名称是对氯甲苯或4-氯甲苯;(3)和Cl2反应生成B,B和H2O、FeCl3反应生成,B的分子式为C7H4Cl4,由此推测B为;(4)和反应生成,化学方程式为:+→+CO2↑+H2O;含有的官能团为酯基;(5)和反应生成,该反应为取代反应;(6)①能发生银镜反应,说明含有-CHO;②核磁共振氢谱有3组峰,说明分子中含有3种不同环境的H原子;③含有苯环;符合条件的同分异构体为:、。
相关试卷
这是一份2024届福建省泉州市高中高考毕业班质量监测(一)化学试题及答案,文件包含泉州市2024届高中毕业班质量检测一试卷pdf、2024泉州一检化学试题评分细则pdf等2份试卷配套教学资源,其中试卷共7页, 欢迎下载使用。
这是一份福建省泉州市普通高中毕业班2024届高三质量检测(一)(8月)化学试题,共11页。试卷主要包含了08,5毫米黑色字迹的签字笔书写,5 Ag 108等内容,欢迎下载使用。
这是一份福建省福州市2023年4月普通高中毕业班质量检测化学试题(Word版含答案),共12页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。









