

所属成套资源:2021高考化学专题讲解
2021高考化学专题讲解 专题七 化学反应速率和化学平衡(试题部分)
展开
这是一份2021高考化学专题讲解 专题七 化学反应速率和化学平衡(试题部分),共37页。
专题七 化学反应速率和化学平衡
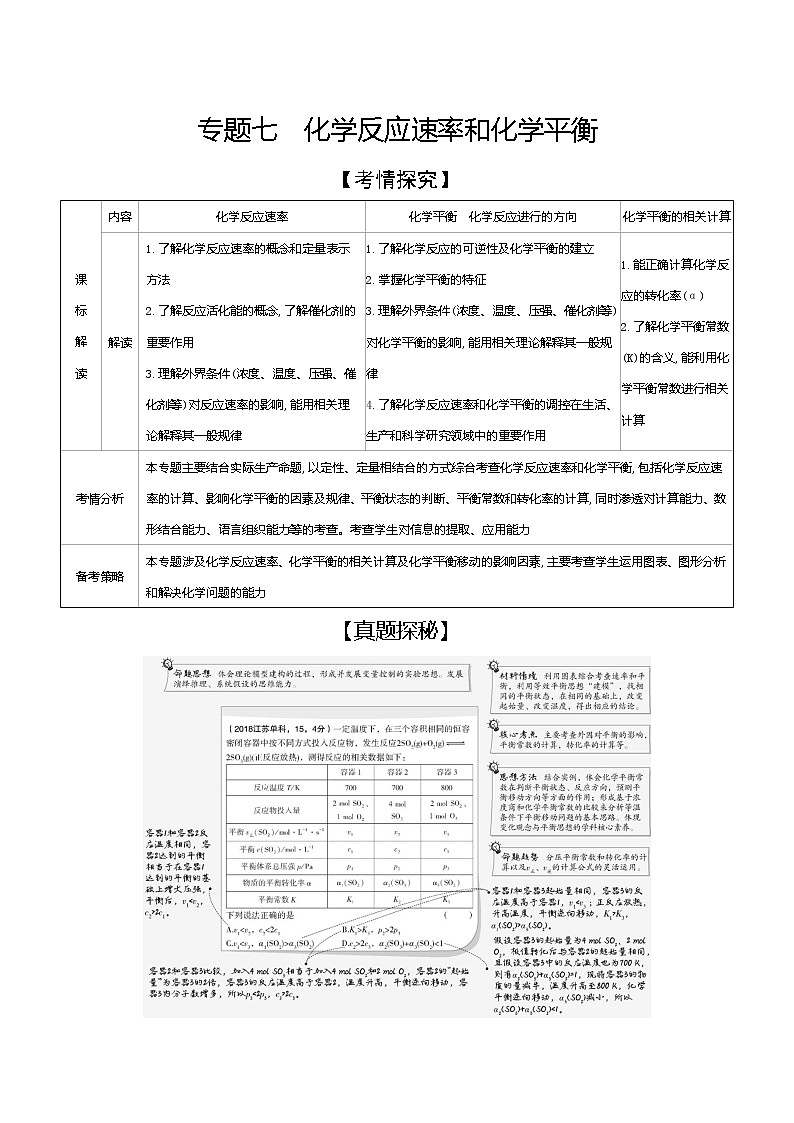
【考情探究】
课
标
解
读
内容
化学反应速率
化学平衡 化学反应进行的方向
化学平衡的相关计算
解读
1.了解化学反应速率的概念和定量表示方法
2.了解反应活化能的概念,了解催化剂的重要作用
3.理解外界条件(浓度、温度、压强、催化剂等)对反应速率的影响,能用相关理论解释其一般规律
1.了解化学反应的可逆性及化学平衡的建立
2.掌握化学平衡的特征
3.理解外界条件(浓度、温度、压强、催化剂等)对化学平衡的影响,能用相关理论解释其一般规律
4.了解化学反应速率和化学平衡的调控在生活、生产和科学研究领域中的重要作用
1.能正确计算化学反应的转化率(α)
2.了解化学平衡常数(K)的含义,能利用化学平衡常数进行相关计算
考情分析
本专题主要结合实际生产命题,以定性、定量相结合的方式综合考查化学反应速率和化学平衡,包括化学反应速率的计算、影响化学平衡的因素及规律、平衡状态的判断、平衡常数和转化率的计算,同时渗透对计算能力、数形结合能力、语言组织能力等的考查。考查学生对信息的提取、应用能力
备考策略
本专题涉及化学反应速率、化学平衡的相关计算及化学平衡移动的影响因素,主要考查学生运用图表、图形分析和解决化学问题的能力
【真题探秘】
【基础集训】
考点一 化学反应速率
1.可逆反应mA(g)+nB(g)pC(g)+qD(g)的v-t图像如图1所示,若其他条件不变,只是在反应前加入合适的催化剂,则其v-t图像如图2所示。以下说法中正确的是( )
①a1>a2 ②a1b2 ④b1t2 ⑥t1=t2 ⑦两图中阴影部分面积相等 ⑧图2中阴影部分面积更大
A.②③⑤⑧ B.①④⑥⑧ C.②④⑤⑦ D.①③⑥⑦
答案 C
2.工业上利用Ga与NH3在高温条件下合成固态半导体材料氮化镓(GaN)的同时有氢气生成。反应中,每生成3 mol H2放出30.8 kJ的热量。在恒温恒容密闭体系内进行上述反应,下列有关表达正确的是( )
A.Ⅰ图像中如果纵轴为正反应速率,则t时刻改变的条件可以为升温或加压
B.Ⅱ图像中纵轴可以为镓的转化率
C.Ⅲ图像中纵轴可以为化学反应速率
D.Ⅳ图像中纵轴可以为体系内混合气体的平均相对分子质量
答案 A
3.2SO2(g)+O2(g) 2SO3(g) ΔH=-198 kJ·mol-1,在V2O5存在时,该反应的机理为V2O5+SO2 2VO2+SO3(快),4VO2+O2 2V2O5(慢)。
下列说法中正确的是( )
A.反应速率主要取决于V2O5的质量
B.VO2是该反应的催化剂
C.逆反应的活化能大于198 kJ·mol-1
D.增大SO2的浓度可显著提高反应速率
答案 C
4.已知反应A2(g)+2B2(g) 2AB2(g) ΔH0,T温度下的部分实验数据为:
t(s)
0
50
100
150
c(X2O5)(mol/L)
4.00
2.50
2.00
2.00
下列说法不正确的是( )
A.T温度下的平衡常数K=64,100 s时X2O5的转化率为50%
B.50 s内X2O5的分解速率为0.03 mol/(L·s)
C.T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1>K2
D.若只将恒容改变为恒压,其他条件都不变,则平衡时X2O5的转化率和平衡常数都不变
答案 D
7.某温度下,对于反应N2(g)+3H2(g)2NH3(g) ΔH=-92.4 kJ/mol,N2的平衡转化率(α)与体系总压强(p)的关系如图所示。下列说法正确的是( )
A.将1 mol氮气、3 mol氢气置于1 L密闭容器中发生反应,放出的热量为92.4 kJ
B.平衡状态由A变到B时,平衡常数K(A)”“p1
C.X 点对应的平衡常数为 0.1
D.X、Y、Z 三点对应的初始反应速率的关系为Z>Y>X
答案 C
3.(2019湖南永州月考,14)80 ℃时,NO2(g)+SO2(g) SO3(g)+NO(g)。该温度下,在甲、乙、丙三个体积相等且恒容的密闭容器中,投入NO2和SO2,起始浓度如下表所示,其中甲经 2 min达平衡时,NO2的转化率为50%。下列说法正确的是( )
起始浓度
甲
乙
丙
c(NO2)/(mol·L-1)
0.10
0.20
0.20
c(SO2)/(mol·L-1)
0.10
0.10
0.20
A.容器甲中的反应在前2 min的平均速率v(SO2)=0.10 mol·L-1·min-1
B.达到平衡时,容器丙中正反应速率与容器甲相等
C.温度升至90 ℃,上述反应平衡常数为1.56,则反应的ΔH>0
D.容器乙中若起始时改充0.10 mol·L-1NO2和0.20 mol·L-1SO2,达到平衡时c(NO)与原平衡不相同
答案 C
4.(2018湖北黄冈调研,12)已知反应:CH2CHCH3(g)+Cl2(g) CH2CHCH2Cl(g)+HCl(g)。在一定压强下,按ω=向密闭容器中充入氯气与丙烯。图甲表示平衡时,丙烯的体积分数(φ)与温度(T)、ω的关系,图乙表示逆反应的平衡常数与温度的关系。则下列说法中错误的是( )
A.图甲中,ω2>1
B.图乙中,A线表示逆反应的平衡常数
C.温度为T1、ω=2时,Cl2的转化率为50%
D.若在恒容绝热装置中进行上述反应,达到平衡时,装置内的气体压强将增大
答案 C
5.(2018福建厦门质检,28节选)甲醇是重要的化工原料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,可能发生的反应如下:
ⅰ.CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1
ⅱ.CO2(g)+H2(g) CO(g)+H2O(g) ΔH2
ⅲ.CH3OH(g) CO(g)+2H2(g) ΔH3
回答下列问题:
(1)已知反应ⅱ中相关化学键键能数据如下:
化学键
H—H
CO
H—O
E/(kJ·mol-1)
436
803
1 076
465
由此计算ΔH2= kJ·mol-1。已知ΔH3=+99 kJ·mol-1,则ΔH1= kJ·mol-1。
(2)一定比例的合成气在装有催化剂的反应器中反应12小时。体系中甲醇的产率和催化剂的催化活性与温度的关系如下图所示。
温度为470 K时,图中P点 (填“是”或“不是”)处于平衡状态。在490 K之前,甲醇产率随着温度升高而增大的原因是 ;490 K之后,甲醇产率下降的原因是 。
答案 (1)+36 -63
(2)不是 温度越高化学反应速率越快 升高温度,反应ⅰ逆向移动,催化剂活性降低
【应用集训】
1.(2018湖北武汉调研,11)一定温度下,密闭容器中进行反应:2SO2(g)+O2(g) 2SO3(g) ΔHv(第二步反应)
B.反应的中间产物只有NO3
C.第二步中NO2与NO3的碰撞仅部分有效
D.第三步反应活化能较高
答案 (1)O2 (2)①53.1 ②30.0 6.0×10-2 ③大于 温度提高,体积不变,总压强提高;NO2二聚为放热反应,温度提高,平衡左移,体系物质的量增加,总压强提高 ④13.4
(3)AC
教师专用题组
考点一 化学反应速率
1.(2015福建理综,12,6分)在不同浓度(c)、温度(T)条件下,蔗糖水解的瞬时速率(v)如下表。下列判断不正确的是( )
c/mol·L-1 v/mmol·L-1·min-1T/K
0.600
0.500
0.400
0.300
318.2
3.60
3.00
2.40
1.80
328.2
9.00
7.50
a
4.50
b
2.16
1.80
1.44
1.08
A.a=6.00
B.同时改变反应温度和蔗糖的浓度,v可能不变
C.bK3 bd 调节溶液的pH
(4)18~20
8.(2015浙江理综,28,15分)乙苯催化脱氢制苯乙烯反应:
(1)已知:
化学键
C—H
C—C
C C
H—H
键能/kJ·mol-1
412
348
612
436
计算上述反应的ΔH= kJ·mol-1。
(2)维持体系总压p恒定,在温度T时,物质的量为n、体积为V的乙苯蒸气发生催化脱氢反应。已知乙苯的平衡转化率为α,则在该温度下反应的平衡常数K= (用α等符号表示)。
(3)工业上,通常在乙苯蒸气中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比为1∶9),控制反应温度600 ℃,并保持体系总压为常压的条件下进行反应。在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图如下:
①掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实 。
②控制反应温度为600 ℃的理由是 。
(4)某研究机构用CO2代替水蒸气开发了绿色化学合成工艺——乙苯-二氧化碳耦合催化脱氢制苯乙烯。保持常压和原料气比例不变,与掺水蒸气工艺相比,在相同的生产效率下,可降低操作温度;该工艺中还能够发生反应:CO2+H2 CO+H2O,CO2+C 2CO。新工艺的特点有 (填编号)。
①CO2与H2反应,使乙苯脱氢反应的化学平衡右移
②不用高温水蒸气,可降低能量消耗
③有利于减少积炭
④有利于CO2资源利用
答案 (1)124 (2)α2(1-α2)p或nα2(1-α2)V
(3)①正反应方向气体分子数增加,加入水蒸气稀释,相当于起减压的效果
②600 ℃,乙苯的转化率和苯乙烯的选择性均较高。温度过低,反应速率慢,转化率低;温度过高,选择性下降。高温还可能使催化剂失活,且能耗大
(4)①②③④
【三年模拟】
时间:45分钟 分值:100分
一、选择题(每题6分,共42分,每小题只有一个选项正确)
1.(2019上海黄浦调研,17)下图是合成氨反应的正、逆反应速率随反应时间变化的示意图,有关叙述错误的是( )
A.状态Ⅰ和状态Ⅱ时,反应均处于平衡状态
B.状态Ⅰ变化为状态Ⅱ的过程,称为化学平衡移动
C.t1时刻平衡向正反应方向移动,平衡常数增大
D.同一种反应物在状态Ⅰ和状态Ⅱ时,浓度不相等
答案 C
2.(2019山西太原期末,19)以反应5H2C2O4+2MnO4-+6H+ 10CO2↑+2Mn2++8H2O为例探究“外界条件对化学反应速率的影响”。实验时,分别量取H2C2O4溶液和酸性KMnO4溶液,迅速混合并开始计时,通过测定溶液褪色所需时间来判断反应的快慢。
编号
H2C2O4溶液
酸性KMnO4溶液
温度/℃
浓度/mol·L-1
体积/mL
浓度/mol·L-l
体积/mL
①
0.10
2.0
0.010
4.0
25
②
0.20
2.0
0.010
4.0
25
③
0.20
2.0
0.010
4.0
50
下列说法不正确的是( )
A.实验①、②、③所加的H2C2O4溶液均要过量
B.实验①测得KMnO4溶液的褪色时间为40 s,则这段时间内v(KMnO4)=2.5×10-4 mol·L-1·s-1
C.实验①和②是探究浓度对化学反应速率的影响,实验②和③是探究温度对化学反应速率的影响
D.实验①和②起初反应均很慢,过了一会儿速率突然增大,可能是生成的Mn2+对反应起催化作用
答案 B
3.(2019安徽定远期末,6)在2 L恒容密闭容器中加入0.100 mol NO和2.030 mol固体活性炭,发生反应:2NO(g)+C(s) N2(g)+CO2(g)。在不同温度下测得平衡体系中各物质的物质的量如下表,下列说法正确的是( )
温度/℃
C(s)/mol
NO/mol
N2/mol
CO2/mol
200
2.000
0.040 0
0.030 0
0.030 0
335
2.005
0.050 0
0.025 0
0.025 0
A.该反应的正反应为吸热反应
B.反应体系在335 ℃时的平衡常数为0.25
C.335 ℃与200 ℃时相比,活化分子个数、活化分子百分数及焓变均大
D.200 ℃时,平衡后向恒容容器中再充入0.10 mol NO,再次平衡时,NO的百分含量将增大
答案 B
4.(2019河北邢台期末,21)有Ⅰ、Ⅱ、Ⅲ3个体积均为0.5 L的恒容密闭容器,在Ⅰ、Ⅱ、Ⅲ中按不同投料比(Z)充入HCl 和O2(如下表),加入催化剂发生反应:4HCl(g)+O2 (g) 2Cl2 (g)+2H2O(g) ΔH。HCl的平衡转化率与Z和T的关系如图所示。下列说法不正确的是( )
容器
起始时
T/℃
n(HCl)/mol
Z
Ⅰ
300
0.25
a
Ⅱ
300
0.25
b
Ⅲ
300
0.25
4
A.ΔH0。测得c(H2O)随反应时间(t)的变化如图所示。下列判断正确的是( )
A.0~5 min内,v(CO)=0.10 mol·L-1·min-1
B.10 min时,改变的外界条件可能是减小压强
C.5 min时该反应的v正大于11 min时的v逆
D.5 min时该反应的K值一定小于12 min时的K值
答案 AD
10.(2020届山东历城二中质检,15)CO2和CH4的反应为CH4(g)+CO2(g) 2H2(g)+2CO(g) ΔH。向V L恒容密闭容器中通入2 mol CH4和4 mol CO2,测得CO2的物质的量浓度随温度、时间的变化关系如图所示。下列说法不正确的是( )
A.ΔH>0,V=2
B.T1 ℃时,容器在b点时的压强与起始压强之比为7∶6
C.T2 ℃时,反应10 min后到达a点,0~10 min内用CO表示的平均反应速率v(CO)=0.3 mol·L-1·min-1
D.T2 ℃时反应达到平衡后,向该平衡体系中再充入0.5 mol CH4、0.5 mol CO2、1 mol H2和1 mol CO,平衡正向移动
答案 CD
三、非选择题(共40分)
11.(2019河北邯郸重点高中开学检测,29)(12分)甲醇是重要的化工原料和清洁燃料,工业上可利用CO或CO2来生产甲醇。已知制备甲醇的有关化学反应以及在不同温度下的化学平衡常数如下表所示:
化学反应
平衡常数
平衡常数的值
500 ℃
800 ℃
①2H2(g)+CO(g)CH3OH(g)
K1
2.5
0.15
②H2(g)+CO2(g)H2O(g)+CO(g)
K2
1.0
2.50
③3H2(g)+CO2(g)CH3OH(g)+H2O(g)
K3
(1)在恒容密闭容器中发生反应②,达到平衡后升高温度,下列说法正确的是 。
a.平衡正向移动
b.混合气体的平均相对分子质量增大
c.CO2的转化率增大
(2)K1、K2、K3的关系是K3= 。
(3)500 ℃时测得反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度分别为0.2 mol/L、0.1 mol/L、0.01 mol/L、0.2 mol/L,则此时v正 v逆(填“>”“=”或“”“=”或“
相关试卷
这是一份2021高考化学专题讲解 专题十九 物质的检验、分离与提纯(试题部分),共18页。
这是一份2021高考化学专题讲解 专题十九 物质的检验、分离与提纯(讲解部分)课件,共38页。
这是一份2021高考化学专题讲解 专题十一 物质结构与性质(试题部分),共33页。








