
高中化学第二节 原子结构与元素的性质教学演示课件ppt
展开1、三原子分子的空间结构
2、四原子分子的空间结构
3、五原子分子的空间结构
二、价层电子对互斥(VSEPR)理论
( Valence Shell Electrn Pair Repulsin )
共价分子中,中心原子周围电子对排布的几何构型主要取决于中心原子的价层电子对的数目。价层电子对各自占据的位置倾向于彼此分离得尽可能的远,此时电子对之间的斥力最小,整个分子最稳定。
价层电子对包括成键的σ电子对和孤电子对
不包括成键的π电子对 !
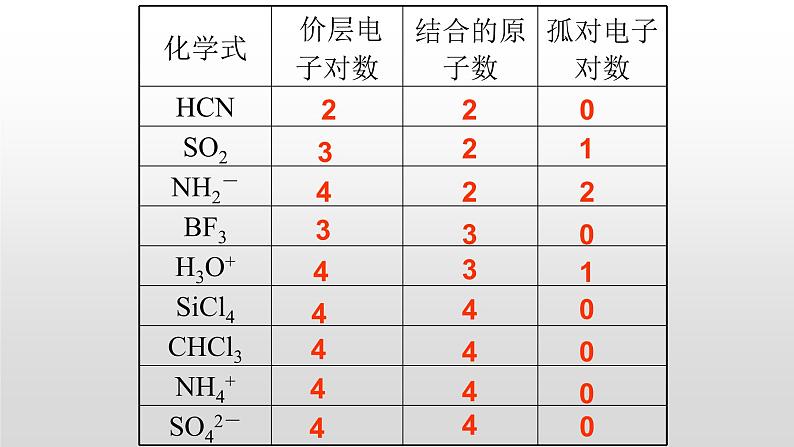
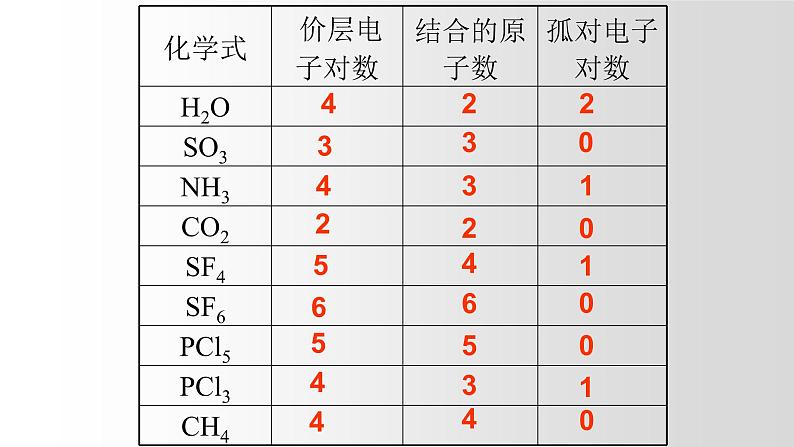
2、价层电子对数计算
①确定中心原子价层电子对数目
价电子数出现奇数时,单电子当作电子对看待
=(中心原子价电子数+结合原子数)/2
=配位原子数+孤电子对数
=σ键电子对数+孤电子对数
O、S为结合原子时,按“0 ”计算
N为结合原子时,按“- 1 ”计算
离子计算价电子对数目时,阴离子加上所带电荷数,阳离子减去所带电荷数
孤电子对数=价层电子对数 — 结合原子数
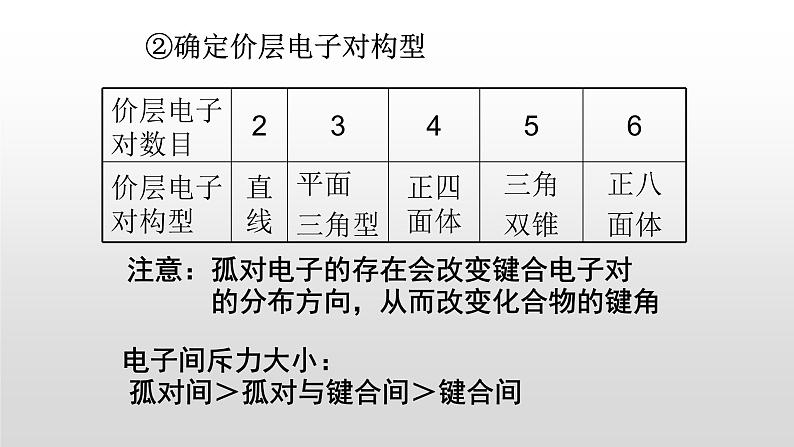
②确定价层电子对构型
注意:孤对电子的存在会改变键合电子对 的分布方向,从而改变化合物的键角
电子间斥力大小: 孤对间>孤对与键合间>键合间
在价层电子对构型的基础上,去掉孤电子对由真实原子形成的构型
1.下列物质中分子立体结构与水分子相似的是 A.CO2 B.H2S C.PCl3 D.SiCl42.下列分子立体结构其中属于直线型分子的是 A.H2O B.CO2 C.C2H2 D.P43.下列分子立体结构其中属正八面体型分子的 A.H3O + B.CO32— C.PCl5 D.SF6
会利用VSEPR理论得出孤电子对数价层电子对构型分子构型
① 同一原子中能量相近的不同种原子轨道 在成键过程中重新组合,形成一系列能量相等的新轨道的过程叫杂化。形成的新轨道叫杂化轨道,用于形成σ键或容纳孤对电子
② 杂化轨道数目等于各参与杂化的原子轨道 数目之和
③ 杂化轨道成键能力强,有利于成键
④ 杂化轨道成键时,满足化学键间最小排斥原理,不同的杂化方式,键角大小不同
⑤ 杂化轨道又分为等性和不等性杂化两种
1个s轨道和3个p轨道杂化形成4个sp3杂化轨道
构型 109°28′ 正四面体型
4个sp3杂化轨可形成4个σ键
价层电子对数为4的中心原子采用sp3杂化方式
1个s轨道和2个p轨道杂化形成3个sp2杂化轨道
构型 120° 正三角型
剩下的一个未参与杂化的p轨道用于形成π键
3个sp2杂化轨道可形成3个σ键
价层电子对数为3的中心原子采用sp2杂化方式
1个s轨道和1个p轨道杂化形成2个sp杂化轨道
构型 180° 直线型
剩下的两个未参与杂化的p轨道用于形成π键
2个sp杂化轨道可形成2个σ键
价层电子对数为2的中心原子采用sp杂化方式
除C原子外,N、O原子均有以上杂化
当发生sp2杂化时,孤对电子优先参与杂化单电子所在轨道优先不杂化,以利于形成π键
N、O原子杂化时,因为有孤对电子的存在称为不等性杂化
dsp2杂化、sp3d杂化、sp3d2杂化、d2sp3杂化、 sp3d2杂化
例如:sp3d2杂化:SF6
构型:四棱双锥 正八面体
此类杂化一般是金属作为中心原子用于形成配位化合物
①定义:共用电子对由一个原子单方向 提供给另一个原子共用所形成| 的共价键称配位键。
一个原子有孤对电子,另一个原子有空轨道。
[Cu(NH3) 4 ] SO4•H2O
加乙醇 并静置
继续滴 加氨水
Cu(OH)2 + 4NH3 = [Cu(NH3)4]2+ + 2OH—
Cu2++ 2NH3·H2O = Cu(OH)2↓+ 2NH4+
1Cu与4O形成的结构为平面正方形
1Cu与4N形成的结构为平面正方形
[Ag(NH3)2] OH
[Ag(NH3)2]+
(有时可能 是中心原子)
配位数:配位原子的个数
常见配位原子:N、O、F、Cl、C、S
Fe3+ + 3SCN— = Fe(SCN)3
Fe3+ + nSCN— = [Fe(SCN)n ]3-n (n=1-6)
高中化学人教版 (新课标)选修3 物质结构与性质第二节 分子的立体构型教课课件ppt: 这是一份高中化学人教版 (新课标)选修3 物质结构与性质第二节 分子的立体构型教课课件ppt,共60页。
高中化学人教版 (新课标)选修3 物质结构与性质第二节 分子的立体构型课文内容课件ppt: 这是一份高中化学人教版 (新课标)选修3 物质结构与性质第二节 分子的立体构型课文内容课件ppt,共19页。
高中化学人教版 (新课标)选修3 物质结构与性质第二节 分子的立体构型多媒体教学ppt课件: 这是一份高中化学人教版 (新课标)选修3 物质结构与性质第二节 分子的立体构型多媒体教学ppt课件,共17页。