

化学选修3 物质结构与性质第二节 分子晶体与原子晶体示范课课件ppt
展开分子内原子间以共价键结合相邻分子间靠分子间作用力(范德华力、氢键)相互吸引
⑤绝大多数有机物的晶体
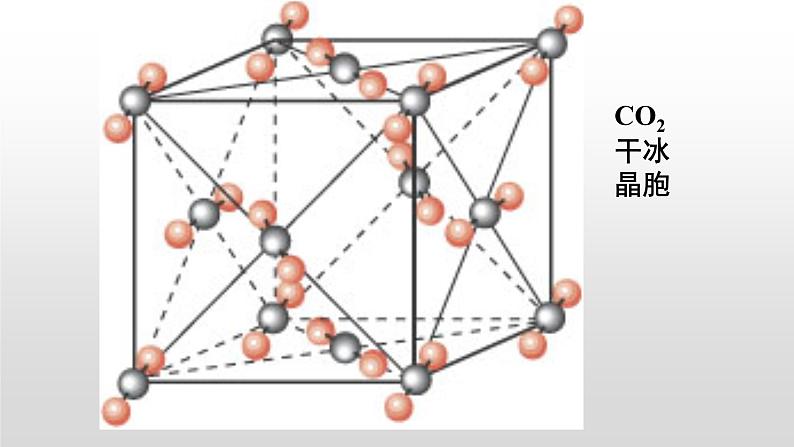
①若分子间只有范德华力时
以1个分子为中心,周围有12个紧邻分子,即分子密堆积结构
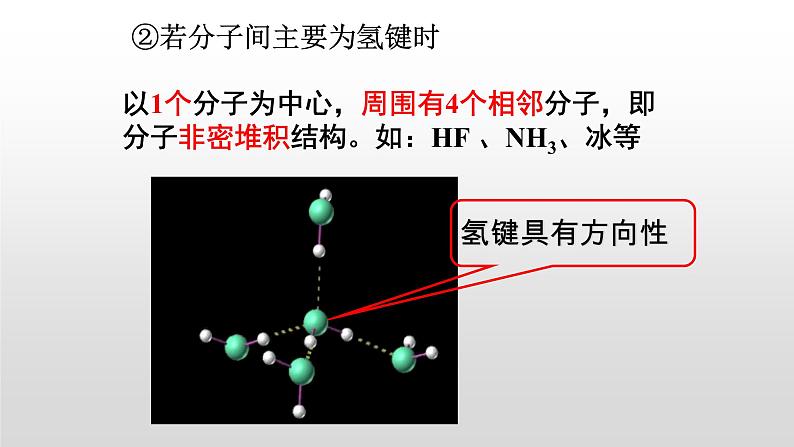
②若分子间主要为氢键时
以1个分子为中心,周围有4个相邻分子,即分子非密堆积结构。如:HF 、NH3、冰等
固态和熔融状态时都不导电只有酸的水溶液中有的导电
1.下列性质适合于分子晶体的是( ) A.熔点1070℃,易溶于水,水溶液导电 B.熔点10.31 ℃,液态不导电、水溶液能导电 C.易溶于CS2、熔点112.8 ℃,沸点444.6℃ D.熔点97.81℃,质软、导电、密度0.97g/cm3
2.共价键、离子键和范德华力是构成物质粒子间的不同作用方式,下列物质中,只含有上述一种作用的是 ( )A.干冰 B.氯化钠 C.氢氧化钠 D.碘
3.下列分子晶体:①H2O ②HCl ③ HBr ④HI ⑤CO ⑥N2 ⑦H2熔沸点由高到低的顺序是( ) A.①②③④⑤⑥⑦ B.④③②①⑤⑥⑦ C.①④③②⑤⑥⑦ D.⑦⑥⑤④③②①
5.下列过程中,共价键被破坏的是( ) A.碘升华 B.溴蒸气被木炭吸附 C.酒精溶于水 D.HCl气体溶于水
4.当S03晶体熔化或气化时,下述各项中发生变化的是( ) A.分子内化学键 B.分子间距离 C.分子构型 D.分子间作用力
6.下列有关共价化合物的说法:①具有较低的熔、沸点 ②不是电解质 ③固态时是分子晶体 ④都是由分子构成 ⑤液态时不导电,其中一定正确的是( ) A.①③④ B.②⑤ C.①②③④⑤ D.⑤
7.已知氯化铝的熔点为190℃(2.202×lO5Pa),但它在180℃即开始升华。 (1)氯化铝是____________。(填“离子化合物”“共价化合物”) (2)无水氯化铝在空气中强烈的“发烟”,其原因是__________________________________________________________________________________________。 (3)设计一个可靠的实验,判断氧化铝是离子化合物还是共价化合物。你设计的实验是______________________________________________。 (4)在500K和1.01×105Pa时,它的蒸气密度(换算为标准状况时)为11.92g·L-1,试确定氯化铝在蒸气状态时的化学式为____________。
氯化铝与空气中的水蒸气发生水解反应产生HCl气体,HCl在空气中形成酸雾而“发烟”。
在其熔融状态下,试验其是否导电;若不导电是共价化合物。
1、下列物质属于分子晶体的化合物是( )A、石英 B、硫磺 C、干冰 D、食盐
2、干冰气化时,下列所述内容发生变化的是A、分子内共价键 B、分子间作用力C、分子键距离 D、分子间的氢键
3、冰醋酸固体中不存在的作用力是( )A、离子键 B、极性键 C、非极性键 D、范德华力
4、水分子间存在着氢键的作用,使水分子彼此结合而成(H2O)n。在冰中每个水分子被4个水分子包围形成变形的正四面体,通过“氢键”相互连接成庞大的分子晶体,其结构如图:试分析:①1ml 冰中有 ml氢键?②H2O的熔沸点比H2S高还是低?为什么?
原子间以共价键相结合而形成空间网状结构的晶体 ,又称共价晶体
无分子式化学式表示原子最简整数比
硼(B)、硅(Si)锗(Ge)、金刚石(C)等
SiC、BN、SiO2、Al2O3等
晶体中只存在共价键,无单个分子存在;晶体为空间网状结构。
4、原子晶体的物理性质
高中化学人教版 (新课标)选修3 物质结构与性质第三章 晶体结构与性质第二节 分子晶体与原子晶体授课ppt课件: 这是一份高中化学人教版 (新课标)选修3 物质结构与性质第三章 晶体结构与性质第二节 分子晶体与原子晶体授课ppt课件,共20页。PPT课件主要包含了知识点1,知识点2,知识点3等内容,欢迎下载使用。
人教版 (新课标)选修3 物质结构与性质第二节 分子晶体与原子晶体示范课课件ppt: 这是一份人教版 (新课标)选修3 物质结构与性质第二节 分子晶体与原子晶体示范课课件ppt,共21页。PPT课件主要包含了思考与交流,共价键,原子晶体,原子晶体的性质,典型的原子晶体,1金刚石,2二氧化硅,交流与研讨,资料莫氏硬度,知识拓展-石墨等内容,欢迎下载使用。
人教版 (新课标)选修3 物质结构与性质第三章 晶体结构与性质第二节 分子晶体与原子晶体课堂教学ppt课件: 这是一份人教版 (新课标)选修3 物质结构与性质第三章 晶体结构与性质第二节 分子晶体与原子晶体课堂教学ppt课件,共32页。