




高中化学人教版 (新课标)选修4 化学反应原理第二章 化学反应速率和化学平衡第三节 化学平衡多媒体教学课件ppt
展开习题:下列反应不属于可逆反应的是( ) A. Cl2溶于水 B. NH3溶于水 C. 可充电电池的反应,如H2O+Zn+Ag2O Zn(OH)2+2Ag D. 电解水生产氢气和氧气,点燃氢气 和氧气的混合物生成水
一、化学平衡的研究对象——可逆反应
定义:在同一条件下,既能向正反应方向进 行,同时又能向逆反应方向进行的反应。
3.可逆反应总是不能完全进行到底,得到的总是反应物与生成物的混合物。
在密闭容器中充入SO 2和 18O原子组成的氧气,在一定条件下开始反应,在达到平衡后, 18O存在于( ) A. 只存在O2 中 B. 只存在于SO2 中 C. 只存在于SO2 和SO3 中 D. SO2 、 SO3 、 O2 中都有可能存在
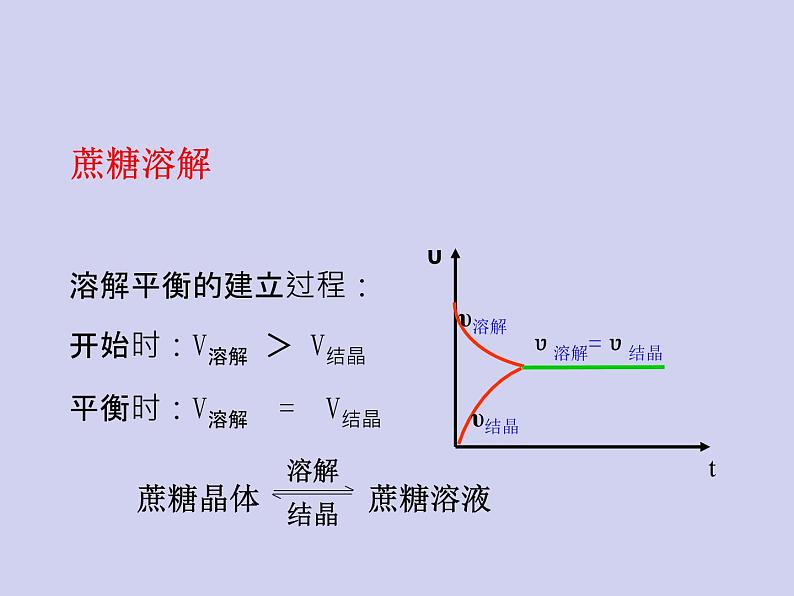
溶解平衡的建立过程:开始时:V溶解 > V结晶 平衡时:V溶解 = V结晶
蔗糖晶体 蔗糖溶液
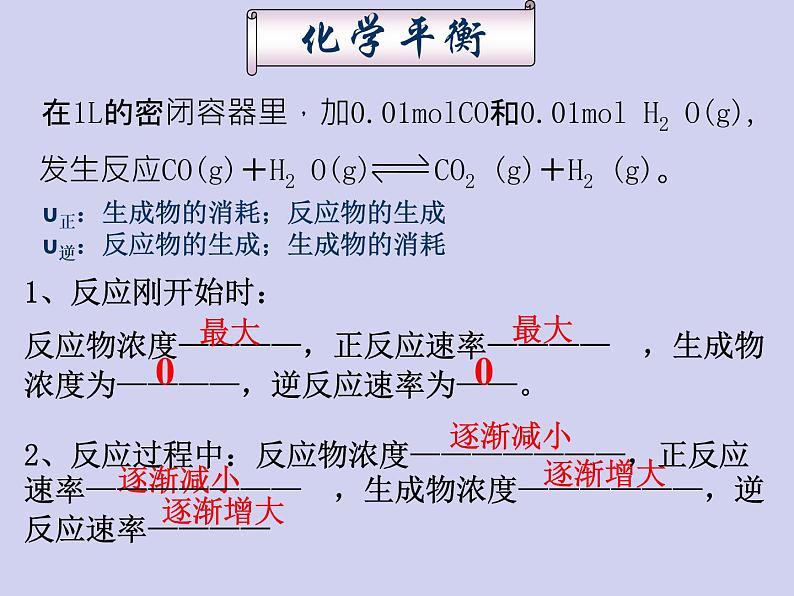
在1L的密闭容器里,加0.01mlCO和0.01ml H2 O(g), 发生反应CO(g)+H2 O(g) CO2 (g)+H2 (g)。
υ正:生成物的消耗;反应物的生成υ逆:反应物的生成;生成物的消耗
1、反应刚开始时: 反应物浓度————,正反应速率———— ,生成物浓度为————,逆反应速率为——。
2、反应过程中:反应物浓度———————,正反应速率——————— ,生成物浓度——————,逆反应速率————
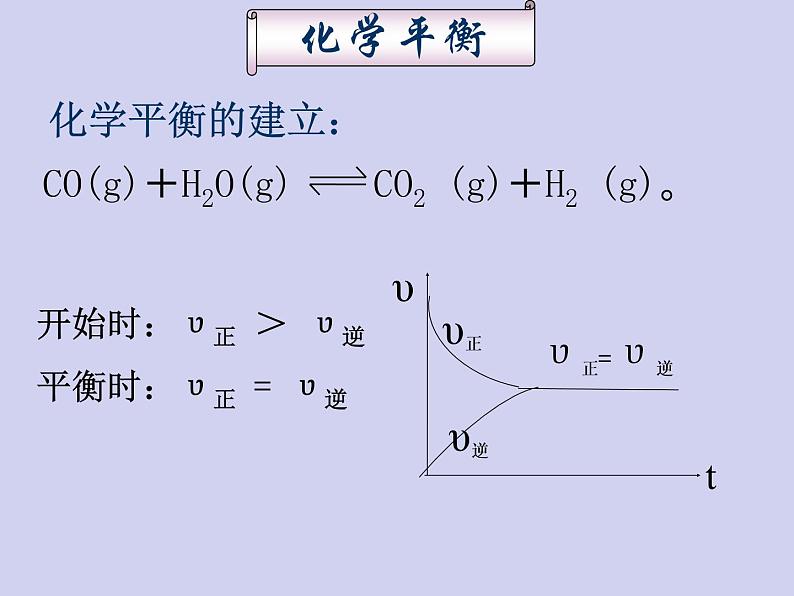
CO(g)+H2O(g) CO2 (g)+H2 (g)。
开始时:υ正 > υ逆
平衡时:υ正 = υ逆
1. 定义:在一定条件下的可逆反应里,正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态。
2、对象:一切的可逆反应
3、实质:正反应速率 = 逆反应速率 ≠ 0
4、标志:反应混合物中各组分的浓度保持不变
2.化学平衡状态的特征:
②等:正反应速率=逆反应速率
③动:动态平衡( υ正 = υ逆 ≠0 )
④定:反应混合物中各组分的浓度保持不变,各组 分的含量保持一定
⑤变:条件改变,原平衡被破坏,在新的条件下建 立新的平衡
3.判断化学平衡状态的标志:
(1)υ正 = υ逆(本质标志)
①同一种物质:该物质的生成速率等于它的消耗速率
②不同的物质:速率之比等于方程式中各物质的计量 数之比,但必须是不同方向的速率 (将不同物质转化为同一种物质进行考虑)
(2)反应混合物中各组成成分的含量保持不变
1.在500℃、钒触媒的作用下,某密闭容器中反应 2SO2 + O2 2SO3 达到化学平衡状态时的标志是( ) A. SO2 的消耗速率等于SO3 的生成速率 B. SO2 的生成速率等于SO3 的生成速率 C. SO2 的消耗速率等于O2 消耗速率的2倍 D. SO3 的生成速率等于O2 生成速率的2倍
2.下列说法可以证明反应N2 + 3H2 2NH3 已达平衡状态的是( ) A.1个N≡N键断裂的同时,有3个H-H键形成 B.1个N≡N键断裂的同时,有3个H-H键断裂 C.1个N≡N键断裂的同时,有6个N-H键断裂 D.1个N≡N键断裂的同时,有6个N-H键形成
3.在一定条件下,将1ml N2和3ml H2的密闭容器中,发生反应:N2 + 3H2 2NH3 ,下列哪些量不再变化时,不能说明已达平衡状态的是( ) A.混合气体的密度 B.混合气体的总物质的量 C.混合气体的压强 D.混合气体的平均相对分子质量
4.下列各项中,可以说明2HI(g) H2(g)+I2(g)已经达到平衡状态的是 ( )(1)单位时间内,生成nmlH2的同时生成nmlHI。(2)一个H—H键断裂的同时,有2个H—I键断裂。(3)温度和体积一定时,某一生成物浓度不再变化。(4)温度和体积一定时,容器内压强不再变化。(5)条件一定,混合气体的平均相对分子质量不再变化。(6)温度和体积一定时,混合气体的颜色不再变化。
1)对于反应前后的气体物质的分子总数不相等的可逆反应(如2SO2+O2 2SO3)来说,可利用混合气体的总压(体积一定条件下)、总物质的量是否随着时间的改变而改变来判断是否达到平衡。2)对于反应前后气体物质的分子数相等的可逆反应(如H2(g)+I2(g) 2HI(g)),不能用此标志判断平衡是否到达,因为在此反应过程中,气体的总压(体积一定条件下)、总物质的量都不随时间的改变而改变。
习题:在一定温度下的定容密闭容器中,当物质的下列物理量不再变化时,表明反应A(s)+2B(g) C(g)+ D(g)达到平衡。( )A.混合气体的压强B.混合其他的密度C. B的物质的量浓度D.气体的总物质的量
对于不同类型的可逆反应,某一物理量不变是否可作为平衡已到达的标志,取决于该物理量在反应过程中是否发生变化。——
能变化的物理量保持不变则达到平衡
高中化学人教版 (新课标)选修4 化学反应原理第三节 化学平衡课文内容ppt课件: 这是一份高中化学人教版 (新课标)选修4 化学反应原理第三节 化学平衡课文内容ppt课件,共28页。PPT课件主要包含了探究一,探究二等内容,欢迎下载使用。
2021学年第三节 化学平衡教学ppt课件: 这是一份2021学年第三节 化学平衡教学ppt课件,共20页。PPT课件主要包含了化学平衡的移动,可逆反应,条件一定,发生变化,新的平衡,平衡向正反应方向移动,平衡向逆反应方向移动,不移动,逆反应,实验2-7等内容,欢迎下载使用。
高中人教版 (新课标)第二章 化学反应速率和化学平衡第三节 化学平衡教学ppt课件: 这是一份高中人教版 (新课标)第二章 化学反应速率和化学平衡第三节 化学平衡教学ppt课件,共60页。PPT课件主要包含了过程分析,逐渐减小,逐渐增大,化学平衡,⑴反应条件,化学平衡的性质,条件不变是基础,⑵研究对象,可逆反应是前提,⑶本质等内容,欢迎下载使用。













