




所属成套资源:人教版 (新课标) 高中化学 选修4配套课件+学案
2021学年第二节 水的电离和溶液的酸碱性课文ppt课件
展开
这是一份2021学年第二节 水的电离和溶液的酸碱性课文ppt课件,共60页。PPT课件主要包含了复习巩固,思考与交流,水是极弱的电解质,加入酸,平衡逆向移动,但Kw保持不变,CH+,COH-,加入碱,升高温度等内容,欢迎下载使用。
1、溶液导电性强弱是由 ________________________决定的。
溶液中自由移动离子浓度
2、水是不是电解质?
研究电解质溶液时往往涉及溶液的酸碱性,而酸碱性与水的电离有密切的关系。那么水是如何电离的呢?
实验测定:25℃ C(H+)=C(OH-)=1×10-7ml/L 100℃ C(H+) = C(OH-) = 1×10-6ml/L
既然一定温度下纯水中C(H+)和C(OH-)浓度是定值,那么乘积呢?
Kw =C(H+)·C(OH-)
说明:1.常温(25℃ )Kw = 1× 10-14 2.稀溶液 3.温度升高, Kw变大
2、水的离子积(常数):
定义:在一定温度下,水(稀溶液)中H+与OH-浓度的乘积,用Kw表示。
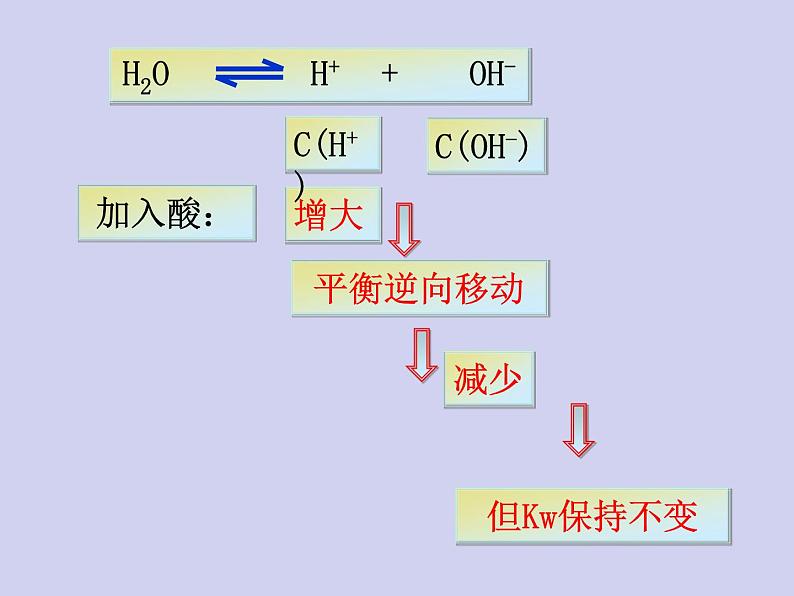
1、在水中加入强酸(HCl)后,水的离子积是否发生改变?
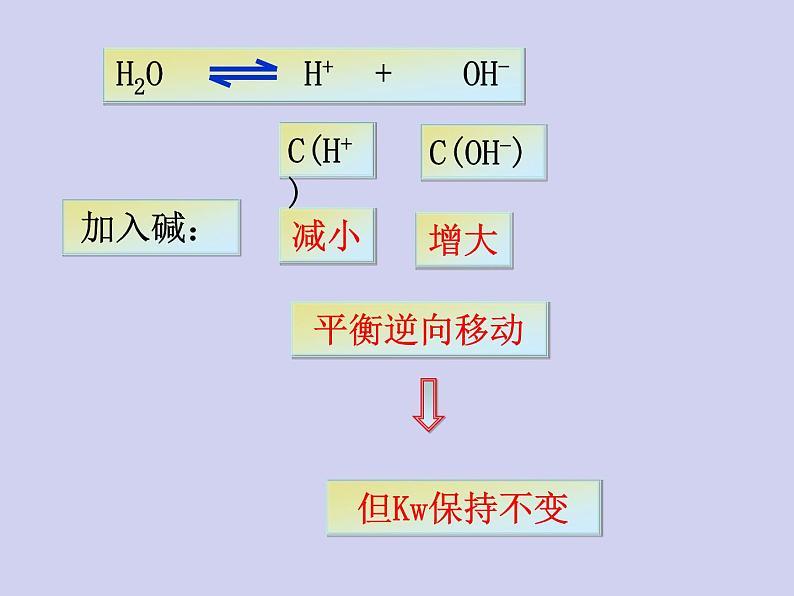
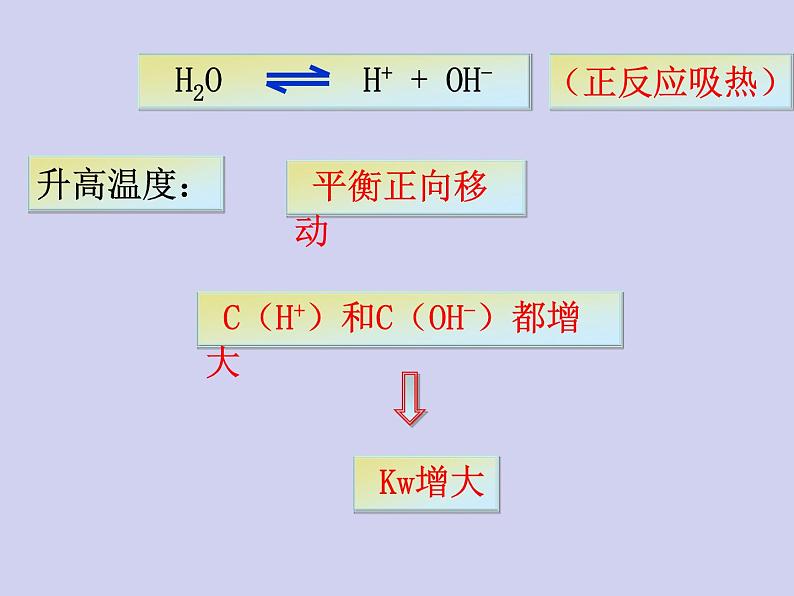
2、在水中加入强碱(NaOH)后,水的离子积是否发生改变?升温呢?
3、在酸碱溶液中,水电离出来的C(H+)和C(OH-)是否相等?
4、100℃时,水的离子积为10-12,求C(H+)为多少?
5、在酸溶液中水电离出来的C(H+)和酸电离出来的C(H+)什么关系?
C(H+)和C(OH-)都增大
二、影响水的电离平衡的因素
抑制水的电离,Kw保持不变
升高温度促进水的电离,Kw增大
注意:Kw是一个温度函数,只随温度的升高而增大.
三、溶液的酸、碱性跟C(H+)、C(OH-)的关系
在一定温度时,稀电解质溶液里C(H+)与C(OH-)的乘积是一个常数。
C(稀) ≤1ml/L
例:25℃时,Kw=1×10-14 100℃时,Kw=1×10-12
①水溶液中H+与OH-始终共存
②酸性溶液:C(H+)>C(OH-) ;C(H+)越大酸性越强
③碱性溶液:C(H+)C(OH-) C(H+)>1×10-7ml/L
C(H+)
相关课件
这是一份高中化学第二节 水的电离和溶液的酸碱性示范课课件ppt,共25页。PPT课件主要包含了复习巩固,思考与交流,正反应吸热,水的电离,问题与讨论,加入酸,平衡逆向移动,但Kw保持不变,CH+,COH-等内容,欢迎下载使用。
这是一份高中化学人教版 (新课标)选修4 化学反应原理第二节 水的电离和溶液的酸碱性课文配套课件ppt,共23页。PPT课件主要包含了酸碱中和滴定,H++OH-H2O,进行完全,已知浓度的溶液,未知浓度的溶液,⑶指示剂,指示剂的变色,用于配制标准液,放置滴定管,酸式滴定管等内容,欢迎下载使用。
这是一份人教版 (新课标)选修4 化学反应原理第二节 水的电离和溶液的酸碱性示范课ppt课件,共24页。PPT课件主要包含了酸碱中和滴定,学习目标,滴定管的构造,1mL,教师演示,误差分析,读数偏大,读数偏小等内容,欢迎下载使用。










