





2021学年第五章 化工生产中的重要非金属元素第一节 硫及其化合物教学演示课件ppt
展开1.在反应Zn+H2SO4 === ZnSO4+H2↑中,失电子的是Zn,得电子的是H+,稀硫酸表现的性质是酸性和弱氧化性。2.浓硫酸具有吸水性,通常用作干燥剂。浓硫酸溶于水会放出大量的热,故稀释浓硫酸时,应将浓硫酸缓缓注入水中并不断地用 玻璃棒进行搅拌。
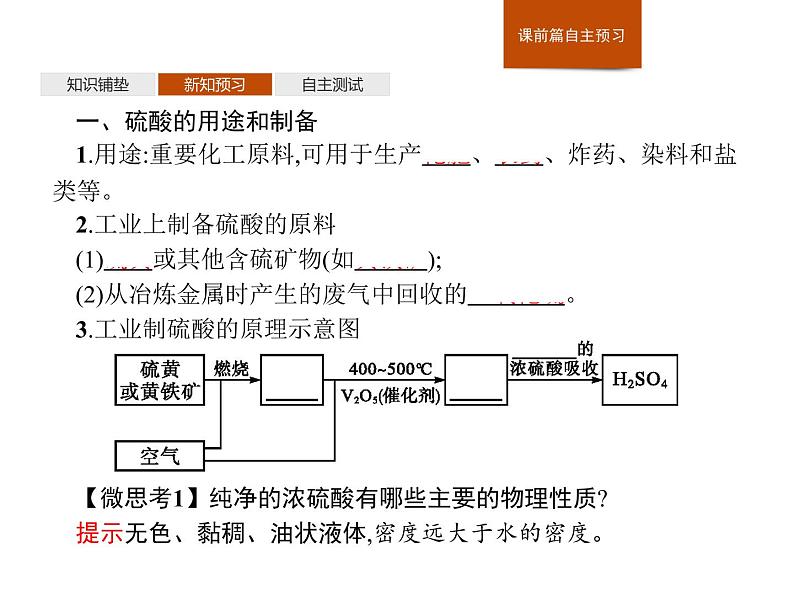
一、硫酸的用途和制备1.用途:重要化工原料,可用于生产化肥、农药、炸药、染料和盐类等。2.工业上制备硫酸的原料(1)硫黄或其他含硫矿物(如黄铁矿);(2)从冶炼金属时产生的废气中回收的二氧化硫。3.工业制硫酸的原理示意图【微思考1】纯净的浓硫酸有哪些主要的物理性质?提示无色、黏稠、油状液体,密度远大于水的密度。
二、稀硫酸的化学性质具有酸的通性,溶于水完全电离,电离方程式:
三、浓硫酸的特性1.吸水性:浓硫酸能吸收存在于周围环境中的水分,故常用作 干燥剂。2.脱水性:浓硫酸能将蔗糖、纸张、棉布和木材等有机物中的氢元素和氧元素按水的组成比脱去。如向蔗糖中加入浓硫酸时,蔗糖逐渐变黑,体积膨胀,形成疏松多孔的海绵状固体,并放出有刺激性气味的气体。
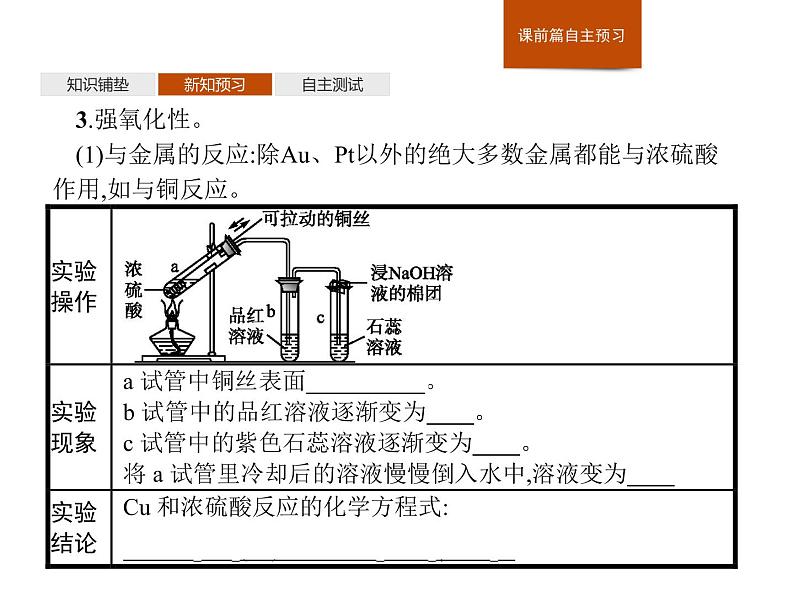
3.强氧化性。(1)与金属的反应:除Au、Pt以外的绝大多数金属都能与浓硫酸作用,如与铜反应。
【微思考2】在教材【实验5-3】中将铜丝下端卷成螺旋状的目的是什么?提示增大铜丝与浓硫酸的接触面积,以增大反应速率。
(2)与非金属反应。加热时与木炭反应的化学方程式为【微思考3】实验室用金属与酸反应制取氢气时,往往用稀硫酸,而不用浓硫酸,这是为什么?提示(活泼)金属与稀硫酸反应时可生成氢气,而金属与浓硫酸反应时往往得不到氢气,一般会生成二氧化硫气体。
三、硫酸盐1.硫酸钙(1)性质(2)用途①制作各种模型和医疗用的石膏绷带。②工业上,可用来调节水泥的硬化速率。
2.硫酸钡(1)存在:以重晶石(BaSO4)形式存在。(2)性质:白色固体,不溶于水和酸,且不容易被X射线透过。(3)用途:医疗上可被用作消化系统X射线检查的内服药物,俗称“钡餐”。【微思考4】已知Ba2+有毒,那么不溶于水的碳酸钡能否代替硫酸钡用作“钡餐”?提示不能。因BaCO3可溶于胃酸(盐酸),生成可溶于水的BaCl2,使人中毒。
3.硫酸铜(1)性质白色粉末,结合水后会变成蓝色晶体,化学方程式为CuSO4+5H2O === CuSO4·5H2O,CuSO4·5H2O俗称胆矾或蓝矾。(2)用途①硫酸铜可用来检验酒精中是否含有少量水。②胆矾可与石灰乳混合制成一种常用农药——波尔多液。
1.判断正误(正确的打“√”,错误的打“×”)(1)浓硫酸具有强氧化性,稀硫酸不具有氧化性。( )(2)将浓硫酸滴到蔗糖表面,固体变黑膨胀并有刺激性气味的气体生成,说明浓硫酸有脱水性和强氧化性。( )(3)浓硫酸具有强氧化性,SO2具有还原性,所以浓硫酸不能干燥SO2。( )(4)浓硫酸具有吸水性,所以浓硫酸可以干燥H2、CO、NH3、H2S、HI、HBr等气体。( )(5)铜不能置换出稀硫酸中的氢,但在加热条件下可置换出浓硫酸中的氢。( )(6)Ba2+、Cu2+都属于重金属离子,可使人中毒。( )答案:(1)× (2)√ (3)× (4)× (5)× (6)√
2.在下列生成二氧化硫的反应中,反应物中的含硫物质被氧化的是( )A.硫在空气中燃烧B.铜片与浓硫酸共热C.红热的木炭与浓硫酸反应D.亚硫酸钠与浓硫酸反应答案:A解析:硫在空气中燃烧生成SO2,硫被氧化;铜片与浓硫酸共热,浓硫酸被还原生成SO2;红热的木炭与浓硫酸反应,浓硫酸被还原生成SO2;亚硫酸钠与浓硫酸反应,没有元素化合价的变化,不属于氧化还原反应。
浓硫酸的吸水性和脱水性问题探究1.将一瓶浓硫酸敞口放置在空气中,其质量的变化是增大,变化的原因是浓硫酸能吸收空气中的水蒸气,该变化体现了浓硫酸的吸水性。据此性质可知,浓硫酸可作干燥剂,常用盛有浓硫酸的洗气瓶干燥某些气体(如右图所示)。2.浓硫酸不能用来干燥哪些气体?提示浓硫酸不能干燥碱性气体(如NH3等)和强还原性的气体(如H2S等)。但CO、H2等还原性气体不与浓硫酸反应,可以用浓硫酸干燥。
3.向蔗糖中加入浓硫酸并快速搅拌,可观察到的现象有哪些?提示蔗糖变黑,体积膨胀,变成疏松多孔海绵状固体,并放出刺激性气味的气体。4.什么是“吸水性”和“脱水性”?二者有什么区别?提示如果与浓硫酸接触的物质中确实存在水分子,则体现浓硫酸的吸水性,如浓硫酸能使CuSO4·5H2O由蓝变白;如果与浓硫酸接触的物质中根本不存在水分子,仅含氢元素和氧元素,则体现浓硫酸的脱水性,如浓硫酸可使蔗糖(C12H22O11)变黑。
知识拓展1.浓硫酸吸水性、脱水性的区别吸水性→浓硫酸吸取物质中本身存在的水或结晶水的性质|脱水性→浓硫酸将组成有机物的H、O元素按原子个数比2∶1以“H2O”的形式脱去的性质由此看出:二者的根本区别在于物质本身是否存在水分子。
2.浓硫酸与稀硫酸的鉴别方法(1)取少量蒸馏水,向其中加入少量试样,能够放出大量热的为浓硫酸,反之为稀硫酸。(2)观察状态:呈黏稠状的是浓硫酸,而黏稠度较小的是稀硫酸。(3)取体积相等的两液体,用手掂掂,质量较大的是浓硫酸。(4)取少量试样,向其中加入铁片,若能够产生大量气泡的则为稀硫酸(Fe+H2SO4 === FeSO4+H2↑);若无明显现象(钝化)的则为浓硫酸。(5)用玻璃棒分别蘸取试样在纸上写字,字迹立即变黑(浓硫酸的脱水性)的为浓硫酸,另一种为稀硫酸。
素能应用典例1如图所示,在一个白色的点滴板的孔穴中分别放入小纸片、少量CuSO4·5H2O。然后分别滴入几滴浓硫酸或稀硫酸,观察现象。回答下列问题:(1)浓硫酸滴于小纸片上,小纸片变 (填实验现象),说明浓硫酸具有 性。 (2)稀硫酸滴入CuSO4·5H2O中,CuSO4·5H2O (填实验现象);浓硫酸滴入CuSO4·5H2O中,CuSO4·5H2O (填实验现象),说明浓硫酸具有 性。 答案:(1)黑 脱水(2)溶解,溶液呈蓝色 由蓝色变成白色 吸水解析:浓硫酸具有吸水性、脱水性,但稀硫酸不具有这些性质。
变式训练1在下图所示的实验装置中,从实验开始到过一段时间后,对观察到的现象叙述不正确的是 ( )A.①中苹果块会干瘪B.②中胆矾晶体表面有“白斑”C.③中小试管内有晶体析出D.④中pH试纸变红答案:D解析:浓硫酸具有吸水性、脱水性和强氧化性。苹果块的水分被浓硫酸吸收变干瘪;胆矾晶体中的结晶水被浓硫酸吸收,表面出现“白斑”;饱和硝酸钾溶液中的部分溶剂被浓硫酸吸收,溶液中有晶体析出;由于浓硫酸具有脱水性,会使pH试纸变黑。
浓硫酸的强氧化性问题探究1.浓硫酸与稀硫酸的氧化性区别在哪里?提示浓硫酸的氧化性是+6价的硫元素体现的,而稀硫酸的氧化性是H+体现的。2.C、Cu分别与浓硫酸反应时,浓硫酸各表现出什么性质?提示与碳反应时,体现了浓硫酸的强氧化性;与铜反应时,体现了浓硫酸的酸性和强氧化性。3.浓硫酸与过量的Zn充分反应,发生的反应有哪些?写出化学方程式。提示Zn+2H2SO4(浓) === ZnSO4+SO2↑+2H2O,Zn+H2SO4(稀) === ZnSO4+H2↑。
知识拓展浓硫酸的强氧化性1.本质:浓硫酸具有强氧化性,是因为H2SO4分子中+6价的硫元素具有很强的得电子能力。2.反应规律:(1)Fe、Al在浓硫酸中钝化。常温下,当Fe、Al遇到浓硫酸时,会与浓硫酸发生反应,表面生成一层致密的氧化物薄膜而出现“钝化”现象。(2)常温下,浓硫酸与活泼金属反应(铁、铝除外)表现强氧化性和酸性,生成硫酸盐、H2O和SO2;浓硫酸变稀后,只表现酸性,与活泼金属反应生成的气体为H2。
(3)浓硫酸与不活泼金属和非金属反应的规律。①反应需要加热,否则不反应。②还原产物一般是SO2,金属一般被氧化为高价态金属的硫酸盐,非金属一般被氧化为高价态氧化物或含氧酸。③浓硫酸与金属反应时,既表现酸性又表现强氧化性;而与非金属反应时,只表现强氧化性。④随着反应的进行,浓硫酸浓度变小,一旦变为稀硫酸,反应即停止。(4)浓硫酸可与某些具有还原性的化合物反应,如与H2S、HI、HBr、FeCl2等物质反应。
典例2(双选)下列叙述正确的是( )A.浓硫酸是一种干燥剂,能够干燥氢气、氧气、氨气等气体,但不能干燥有较强还原性的HI、H2S等气体B.浓硫酸与单质硫反应的化学方程式为S+2H2SO4(浓) 3SO2↑+2H2O,在此反应中,浓硫酸既表现了强氧化性又表现了酸性C.把足量铜粉投入只含2 ml H2SO4的浓硫酸中,充分加热后得到气体体积(标准状况下)不足22.4 LD.常温下能够用铁、铝等容器盛放浓硫酸,是因为浓硫酸的强氧化性使其钝化
答案:CD解析:A项,浓硫酸具有吸水性,但由于其具有强氧化性和酸性,故不能用来干燥某些具有还原性的气体和碱性气体(NH3);B项,浓硫酸与S、C等非金属单质作用时,由于没有盐生成,故只表现其强氧化性;C项,Cu与浓硫酸反应时,浓硫酸浓度逐渐减小,当成为稀硫酸时,反应停止,故产生的SO2在标准状况下不足22.4 L。答案为CD两项。
变式训练2关于浓硫酸与Cu反应的叙述正确的是( )A.在反应中,浓硫酸只表现出氧化性B.该反应中还原剂与氧化剂物质的量之比为1∶2C.在反应中,浓硫酸既表现氧化性,又表现酸性D.每1 ml Cu参加反应就有2 ml H2SO4被还原,同时生成2 ml SO2答案:C解析:该反应的化学方程式为Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O,分析反应前后元素化合价的变化可知:浓硫酸既表现氧化性,又表现酸性;该反应为氧化还原反应,在该反应中,每2 ml H2SO4参加反应只有1 ml H2SO4被还原,因此还原剂与氧化剂的物质的量之比为1∶1。
1.下列对浓硫酸的叙述正确的是( )A.常温下,浓硫酸与铁、铝不反应,所以铁制、铝制容器能盛放浓硫酸B.浓硫酸具有吸水性,故能使蔗糖炭化C.浓硫酸和铜片在加热条件下反应,既表现出浓硫酸的酸性,又表现出它的强氧化性D.浓硫酸可用作H2、O2等气体的干燥剂,表现其脱水性答案:C解析:A项,常温下,铁、铝遇浓硫酸发生钝化,生成了致密氧化膜,并不是不发生反应;B项,浓硫酸使蔗糖炭化,表现了浓硫酸的脱水性;C项,加热条件下,Cu与浓硫酸反应生成CuSO4、H2O和SO2,既表现浓硫酸的酸性,又表现出它的强氧化性;D项,浓硫酸用作干燥剂表现了其吸水性。
2.浓硫酸和2 ml·L-1的稀硫酸在实验室中敞口放置。它们的质量和放置天数的关系如图所示。分析a、b曲线变化的原因是( )A.a升华、b冷凝B.a挥发、b吸水C.a蒸发、b潮解D.a冷凝、b吸水答案:B解析:浓硫酸具有吸水性,溶液质量增加;而2 ml·L-1稀硫酸因水分挥发,溶液质量减小。
3.下列说法正确的是( )A.无水硫酸铜为蓝色固体,遇水变为白色B.BaCO3和BaSO4都不溶于水,都可用作“钡餐”C.熟石膏化学式为CaSO4·2H2O,可制成模型D.波尔多液可由胆矾与石灰乳混合制成答案:D
4.用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应。下列实验不合理的是( )A.上下抽拉①中铜丝可控制SO2的生成量B.②中选用品红溶液验证SO2的生成C.③中选用NaOH溶液吸收多余的SO2D.为确认CuSO4生成,向①中加水,观察颜色答案:D解析:抽拉铜丝,可控制铜丝与浓硫酸的接触,即可控制SO2的生成量,故A项合理;SO2能使品红溶液褪色,故B项合理;SO2有毒,且属于酸性氧化物,故C项合理;浓硫酸过量,试管中剩余浓硫酸,应将反应后的混合液慢慢加入到大量水中,否则易出现液体喷出试管而发生危险,故D项不合理。
5.在化学课上,围绕浓硫酸的化学性质进行了如下实验探究:将适量的蔗糖放入烧杯中,然后加入适量浓硫酸,迅速搅拌,放出大量的热,同时观察到蔗糖逐渐变黑,体积膨胀,并放出有刺激性气味的气体。
请回答:(1)生成的黑色(单质)物质是 (填化学式)。 (2)这种黑色物质继续与浓硫酸作用会产生两种气体,其中一种气体有刺激性气味,是大气的主要污染物之一,这种有刺激性气味的气体成分是 (填名称),实验室经常用 溶液进行吸收,这两个反应的化学方程式分别为 。 (3)根据蔗糖与浓硫酸反应的实验现象,说明浓硫酸具有 (填编号)。 A.酸性B.吸水性 C.脱水性 D.强氧化性(4)将实验(2)产生的有刺激性气味气体通入品红溶液,可以看到品红溶液 ,加热后 。 (5)能否用澄清石灰水鉴别这两种气体? (填“能”或“不能”),若不能,填写两种能鉴别二者的试剂: 。
人教版 (2019)必修 第二册第一节 硫及其化合物集体备课ppt课件: 这是一份人教版 (2019)必修 第二册<a href="/hx/tb_c4000033_t3/?tag_id=26" target="_blank">第一节 硫及其化合物集体备课ppt课件</a>,共1页。
高中化学人教版 (2019)必修 第二册第一节 硫及其化合物评课ppt课件: 这是一份高中化学人教版 (2019)必修 第二册<a href="/hx/tb_c4000033_t3/?tag_id=26" target="_blank">第一节 硫及其化合物评课ppt课件</a>,共17页。PPT课件主要包含了工业制硫酸,浓硫酸的特性,①浓硫酸的吸水性,用途可以作干燥剂,②浓硫酸的脱水性,③浓硫酸的强氧化性,与金属的反应,实验5-3,实验现象,实验结论等内容,欢迎下载使用。
人教版 (2019)必修 第二册第五章 化工生产中的重要非金属元素第一节 硫及其化合物课前预习课件ppt: 这是一份人教版 (2019)必修 第二册第五章 化工生产中的重要非金属元素第一节 硫及其化合物课前预习课件ppt,共59页。













