




人教版 (新课标)必修2第三节 化学键评课课件ppt
展开
这是一份人教版 (新课标)必修2第三节 化学键评课课件ppt,共18页。PPT课件主要包含了种元素,万种物质,元素组成,原子分子构成,化学键,Cl-,Na1Cl1,Na+Cl,Na2S1,Na+S等内容,欢迎下载使用。
1.了解离子键的概念。2.掌握离子键的形成过程和形成条件。3.能熟练地用电子式表示离子化合物的形成过程。
本课首先从元素周期表中出发,让学生回忆目前的元素种类,并指明目前的化合物种类,引导学生分析元素形成化合物时需要一种作用,进而引入“化学键”的概念;然后从Na与Cl2的实验入手,分析Na元素与Cl元素的形成过程,最终确定活泼金属与活泼非金属之间形成的化学键——“离子键”,并归纳形成“离子键”的微粒、条件及其存在。 在讲“电子式”时,注意从原子的“电子式”入手,结合稳定结构分析原子的得失电子情况,从而过渡到阴、阳离子的“电子式”,再根据“离子化合物”的构成微粒,确定“离子化合物”的“电子式”,注重对相同离子的处理。最后用“电子式”表示出“离子化合物”的形成过程。
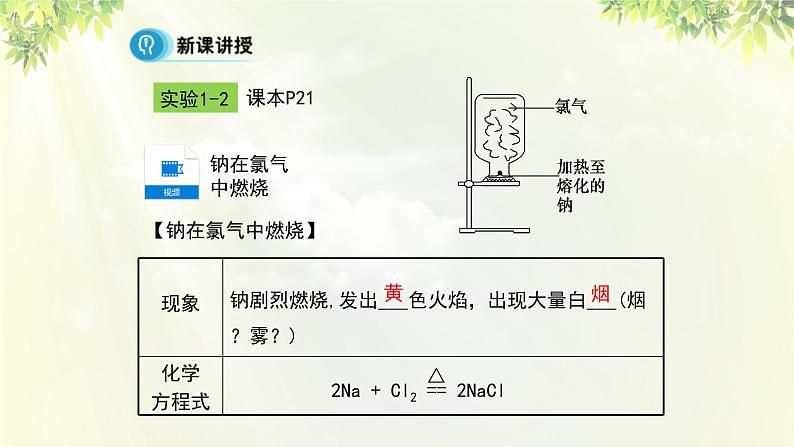
钠剧烈燃烧,发出___色火焰,出现大量白___(烟?雾?)
更稳定
能量低
静电引力(异性相吸如正负电荷相吸)
静电斥力(同性相斥如电子与电子,原子核与原子核)
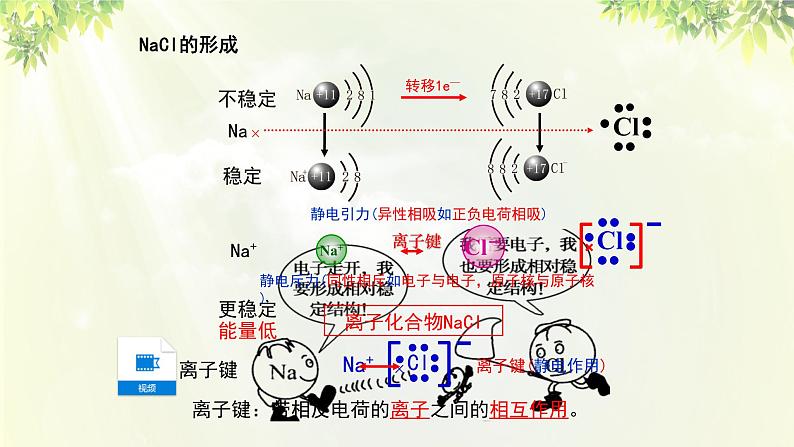
离子键:带相反电荷的离子之间的相互作用。
在氯化钠晶体中,Na+和Cl- 之间存在哪些作用力?
1.Na+离子和Cl-离子间的静电相互吸引作用。
3.因阴阳离子接近到某一定距离时,吸引和排斥作用达到平衡,阴阳离子间形成稳定的化学键。
2.阴阳离子间电子与电子、原子核与原子核间的相互排斥作用。
带相反电荷的(阴阳)离子之间的相互作用称为离子键
活泼金属 + 活泼非金属
包括:正价原子团如:NH4+
包括:负价原子团如:OH-
注意:并非所有金属元素和非金属元素组成的都是离子键,如AlCl3等。
由离子键构成的化合物叫做离子化合物。
下列哪些物质中存在离子键?Na2O MgCl2 SO2 HClNa2O2 NaOH KNO3 NH4Cl
1.概念:在元素符号周围用·或×表示原子的____________的式子。
3.阳离子的电子式
(1)简单阳离子电子式就是离子符号
H+ Na+
(尽可能对称,电子尽可能分布在元素符号的上、下、左、右4个位置,每个位置不超过2个电子)
H Na Mg Al C N O F
5.离子化合物的电子式
把阴、阳离子的电子式写出并遵偱阴、阳离子交替的原则排布。
举例:NaCl MgCl2
练习:CaS Na2O
4.简单阴离子的电子式
在元素符号周围标出最外层电子,用“[ ]”括起来,并在右上角注明所带电荷数。
举例:Cl- O2-
6.用电子式表示离子化合物形成过程
二、用电子式表示下列物质形成过程
一、写出下列物质的电子式1.NaBr 2.CaF2 3. CaO
1.下列说法正确的是( )A.离子键就是阴阳离子间的静电引力 B.所有金属元素与所有非金属元素间都能形成离子键 C.钠原子与氯原子结合成氯化钠后体系能量降低 D.离子化合物CaCl2中,两个氯离子间也存在离子键
3.下列性质中,可以证明某化合物内一定存在离子键的是( )A.溶于水B.熔点较高 C.水溶液能导电 D.熔融状态能导电
2.下列不是离子化合物的是( ) A.H2OB.Na2S C.KOHD.NH4NO3
相关课件
这是一份人教版 (新课标)必修2第二节 元素周期律示范课ppt课件,共14页。PPT课件主要包含了了解两性元素,结构决定位置,原子得失电子的能力,位置决定性质,氧化性增强,非金属性逐渐增强,金属性逐渐增强,原子半径逐渐增大,还原性逐渐增强,原子半径逐渐减小等内容,欢迎下载使用。
这是一份必修2第三节 化学键图片ppt课件,共24页。PPT课件主要包含了共价键,HCl的形成,CH4,MgCl2,H2O,H2O2,Na2O2,个例AlCl3,H2O1,确定原子的个数等内容,欢迎下载使用。
这是一份高中化学人教版 (新课标)必修2第二节 元素周期律教学ppt课件,共27页。PPT课件主要包含了核外电子的排布规律,最外层电子数1→2,最外层电子数1→8,原子半径大→小,∴镁的金属性比钠弱,钠比镁与水反应剧烈,∴镁的金属性比铝强,MgOH2,中强碱,元素周期律等内容,欢迎下载使用。










