

江苏省连云港市2020-2021学年高二上学期期末调研考试化学试题
展开可能用到的相对原子质量:H 1 C 12 N 14 O 16
选择题(共40分)
单项选择题:本题包括10小题,每小题2分,共计20分,每小题只有一个选项符合题意。
1. 油脂是人体重要的供能物质,软脂酸甘油酯分子中不含的元素是( )
A. 氢B. 碳C. 氮D. 氧
【答案】C
2. 中国古代科学专著《天工开物》收录了井盐的生产过程,其中“汲水而上,入于釜中煎炼,顷刻结盐,色成至白”的描述,涉及的物质分离操作为( )
A. 蒸发结晶B. 萃取分液C. 趁热过滤D. 常压蒸馏
【答案】A
3. 下列表示相关微粒的化学用语正确的是( )
A. 硝基苯的结构简式:B. 的电子式:
C. 乙醇结构式:D. 的球棍模型:
【答案】B
4. 铝是大自然赐予人类的宝物,硅是带来人类文明的重要元素之一,它们的单质及化合物在生产、生活中有着广泛的应用。晶体硅是重要的半导体材料,可用氢气在高温下还原四氯化硅制得。下列有关物质的性质与用途具有对应关系的是( )
A. 易与酸反应,可用于治疗胃酸过多
B. 的硬度比较大,可用于制光导纤维
C. 的金属活泼性强,可用于制作铝金属制品
D. 熔点高,可用作电解冶炼铝的原料
【答案】A
5. 铝是大自然赐予人类的宝物,硅是带来人类文明的重要元素之一,它们的单质及化合物在生产、生活中有着广泛的应用。晶体硅是重要的半导体材料,可用氢气在高温下还原四氯化硅制得。下列指定反应的离子方程式正确的是( )
A. 向溶液中滴加稀盐酸:
B. 向NaAlO2溶液中通入过量CO2:
C. 向AlCl3溶液中加入过量氨水:
D. 向NaOH溶液中加入Al粉:
【答案】D
6. 铝是大自然赐予人类的宝物,硅是带来人类文明的重要元素之一,它们的单质及化合物在生产、生活中有着广泛的应用。晶体硅是重要的半导体材料,可用氢气在高温下还原四氯化硅制得。反应可用于纯硅的制备。下列有关该反应的说法正确的是( )
A. SiH4的热稳定性比的强B. 1ml晶体硅中含键
C. 该反应的平衡常数D. 高温下反应每生成需消耗
【答案】B
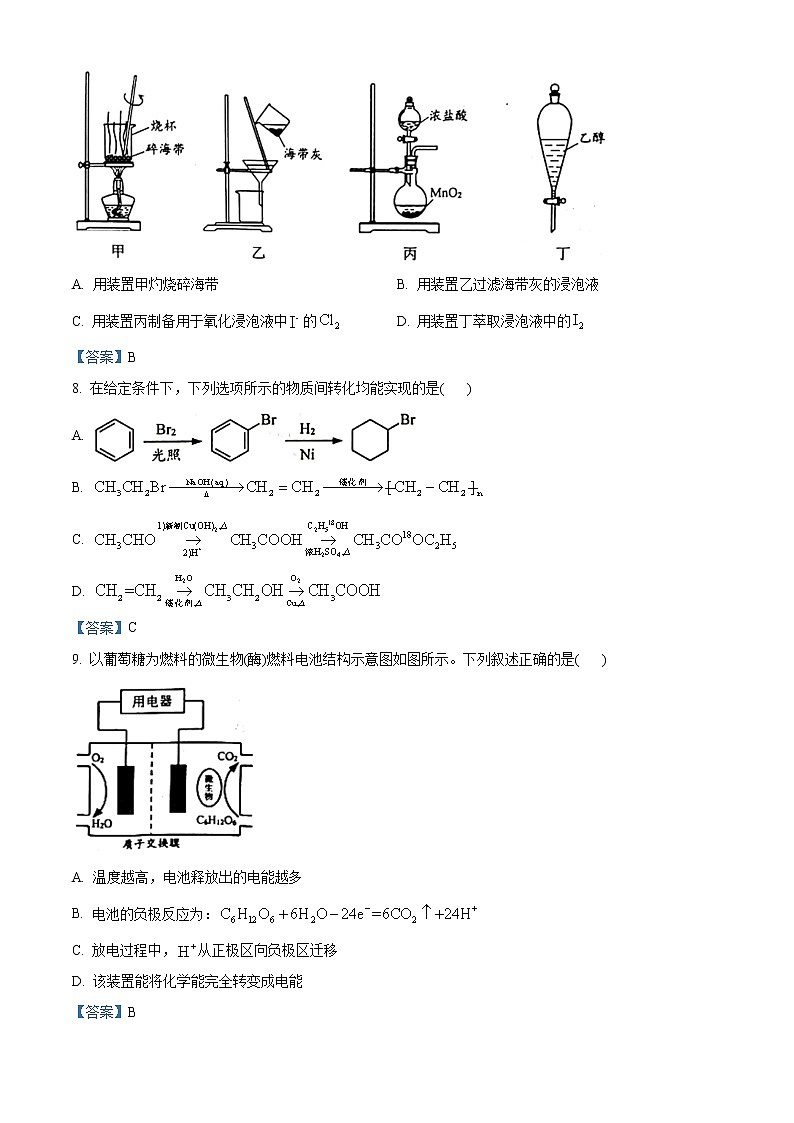
7. 下列有关从海带中提取碘的实验原理和装置能达到实验目的的是( )
A. 用装置甲灼烧碎海带B. 用装置乙过滤海带灰的浸泡液
C. 用装置丙制备用于氧化浸泡液中的D. 用装置丁萃取浸泡液中的
【答案】B
8. 在给定条件下,下列选项所示的物质间转化均能实现的是( )
A.
B.
C.
D.
【答案】C
9. 以葡萄糖为燃料的微生物(酶)燃料电池结构示意图如图所示。下列叙述正确的是( )
A. 温度越高,电池释放出的电能越多
B. 电池的负极反应为:
C. 放电过程中,从正极区向负极区迁移
D. 该装置能将化学能完全转变成电能
【答案】B
10. 下列说法正确的是( )
A. 中含有碳碳双键
B. 钢铁设施在河水中的腐蚀速率比在海水中的快
C. 反应常温下可自发进行,该反应为吸热反应
D. 与混合反应生成,转移电子的数目小于
【答案】D
不定项选择题:本题包括5小题,每小题4分,共20分。每小题只有一个或两个选项符合题意。漏选得2分,错选得0分。
11. 在101 kPa和298 K下,异构化反应过程的能量变化如图所示。
下列说法正确的是( )
A. HNC比HCN稳定B. 该异构化反应的△H=59.3kJ/ml
C. 正反应的活化能小于逆反应的活化能D. 使用催化剂可以改变反应的反应热
【答案】C
12. 化合物Z是一种医药中间体,可由下列反应制得。
下列有关化合物X、Y和Z的说法正确的是( )
A. 最多能与发生反应
B. Y与的加成产物分子中含有手性碳原子
C. X、Z均能与新制的反应生成红色沉淀
D. Y分子中的碳原子可能处于同一平面
【答案】BD
13. 根据下列实验操作和现象所得到的结论正确的是( )
A. AB. BC. CD. D
【答案】D
14. 其他条件相同,等物质的量的ClCH2CH2Cl分别在P1、P2压强下的密闭容器中发生如下反应:。达到平衡时,ClCH2CH2Cl的转化率与温度T的变化关系如图所示。
下列说法正确的是( )
A. P1<P2,Y点对应的反应速率比X的大
B. 图中X点所示条件下的平衡常数比Y点的小
C. 相同条件下,改用高效催化剂能使两条曲线相重叠
D. X点对应的ClCH2CH2Cl的物质的量浓度比Y点的大
【答案】AB
15. 甲醇的羰基化反应具有重要的工业价值。铱()元素形成的复杂阴离子可以催化该反应,机理如图所示。图中的反应速率很快,的反应速率较慢。
下列说法正确的是( )
A. X和Y属于同分异构体
B. 反应过程中的成键数目保持不变
C. 甲醇羰基化反应
D. 羰基化反应的速率主要由的反应速率决定
【答案】AC
非选择题(共60分)
16. 以电厂高镁脱硫废水(含大量Mg2+、Ca2+,少量Fe3+等重金属离子)为原料,生产高纯Mg(OH)2并软化废水的部分工艺流程如下:
(1)除杂。向脱硫废水中加入适量Ca(OH)2,调节废水的pH至8.8以去除重金属离子。滤渣中一定含有_______(填化学式)。
(2)沉镁。向已除杂的废水中加入NaOH,调节废水的pH至10.2以获取高纯Mg(OH)2。溶液的pH与Mg2+沉淀率及Mg2+纯度的关系如图-1所示。调节废水pH至10.2的原因是_______。
(3)碳化。向所得废水中通入CO2,废水中Ca2+的沉淀率随pH的变化如图-2所示。
①碳化时应缓慢通入CO2且不断搅拌,目的是_______。
②Ca2+开始沉淀时反应的离子方程式为_______。
③溶液的pH从过程中,Ca2+沉淀率逐渐下降的原因是_______。
【答案】 (1). Fe(OH)3 (2). Mg2+沉淀率和Mg(OH)2纯度均较高 (3). 提高CO2的利用率 (4). Ca2++2OH-+CO2=CaCO3↓+H2O (5). 随着溶液中H+浓度增大,难溶的CaCO3逐渐转变为可溶的Ca(HCO3)2
17. CO2的固定、利用有利于缓解温室效应和人类的可持续发展。
(1)在催化剂作用下,可用CO2与H2反应制取甲酸。已知:
则的△H=_______。
(2)我国科研人员发现,320℃左右时,在新型纳米催化剂和的表面可以将CO2和H2转化为烷烃X,其过程如图-1所示。
①用系统命名法命名X:_______。
②已知:△H=41 kJ/ml
△H=-128 kJ/ml
写出气体转化为乙烯的热化学方程式:_______。
(3)利用太阳能光解Fe3O4,制备FeO用于还原CO2合成炭黑,可实现资源的再利用。其转化关系如图2所示。过程Ⅱ反应的化学方程式是_______
(4)在酸性电解质溶液中,以太阳能电池作电源,惰性材料作电极,可将CO2转化为乙烯。实验装置如图所示。
①若电解过程中生成3.36 L (标准状况下) O2,则电路中转移的电子至少为_______ml。
②生成乙烯的电极反应式是_______。
【答案】 (1). +16 (2). 2-甲基丁烷 (3). △H=-210 kJ/ml (4). (5). 0.6 (6). 2CO2+12H++12e-=CH2=CH2+4H2O
18. 是重要的化工原料。以软锰矿(主要成分为,杂质有和)为原料,经研磨、还原、纯化、电解等步骤,可制备。
资料:①题给条件下,不与硫酸反应。
②金属离子沉淀的pH
(1)向一定量研磨后的软锰矿中加入过量和过量铁屑,在50℃充分反应后过滤,向所得滤液中先加入,充分反应后再加入调溶液的,过滤,得到纯化液,电解纯化液得到纯净的。
①加入氧化的离子方程式为_______。
②加入调溶液的目的是_______。
(2)产品纯度测定。向产品中依次加入和足量稀,加热至80℃(温度过高草酸易分解)使之充分反应,再用溶液滴定剩余至终点,消耗溶液的体积为。涉及的离子反应方程式为
①上述实验中若加热温度过高,产品中的质量分数的测定结果将_______(填“偏大”或“偏小”或“无影响”)。
②计算该产品中的质量分数_______ (写出计算过程;相对分子质量:;)。
【答案】 (1). (2). 将、完全转化为、沉淀除去 (3). 偏大 (4).
19. 化合物F是合成某种除草剂的重要中间体,其合成路线如下:
回答下列问题:
(1)B中含氧官能团名称为_______、_______。
(2)的反应类型为_______。
(3)C的分子式为。写出C的结构简式:_______。
(4)B的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式_______。
①能与溶液发生显色反应。
②水解后得到两种产物。一种产物分子中含4个碳原子且在同一条直线上,另一种产物分子中不同化学环境的氢原子数目比为1∶2。
(5)写出以为原料制备的合成路线流程图:_______(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
【答案】 (1). 羟基 (2). 酯基 (3). 取代反应 (4). (5). (6).
20. 研究 (主要指和)的性质与转化规律具有十分重要的意义。
(1)用溶液吸收硝酸尾气,可提高尾气中的去除率。其他条件相同,转化为的转化率随溶液初始pH(用稀盐酸调节)的变化如图所示。
①在酸性溶液中,氧化生成和,其离子方程式为_______。
②溶液的初始pH越小,转化率越高。其原因是_______。
(2)在恒压、和的起始浓度一定的条件下,发生如下反应:。催化反应相同时间,测得不同温度下转化为的转化率如图中实线所示(图中虚线表示相同条件下的平衡转化率随温度的变化)。
①反应的_______(填“>”“<”或“=”)0。
②图中X点所示条件下,为了提高转化率,可采取的措施是_______。
(3)温度为时,在两个容积均为的恒容密闭容器中仅发生反应:
①容器Ⅱ中反应开始时,判断的依据是_______。
②实验测得,,、为速率常数,受温度影响。当温度改变为时,若,则时反应的平衡常数为_______(填数值)。
【答案】 (1). (2). 溶液pH越小,溶液中的浓度越大,氧化的能力越强 (3). < (4). 延长反应时间 (5). 由容器Ⅰ中数据可知时,容器Ⅱ中反应开始时的浓度商 (6). 1
注意事项
1.本试卷共8页,包含选择题(第1题~15题,共15题),非选择题(第16题~20题,共5题)两部分,满分100分,考认时间90分钟。考试结束后,请将答题纸交回。
2.请将自己的学校、姓名、考试证号填、涂在答题纸上。
3.作答非选择题时必须用0.5mm黑色墨水签字笔写在答题纸上的指定位置,在其它位置作答一律无效。作答选择题请用2B铅笔涂黑。
选项
实验操作和现象
结论
A
向苯酚浊液中滴加溶液,浊液变清
苯酚的酸性强于的酸性
B
加热乙醇和浓硫酸的混合液,将产生的气体通入酸化的高锰酸钾溶液,溶液褪色
产生的气体为乙烯
C
向淀粉溶液中加适量20%溶液,加热,冷却后加溶液至中性,再滴加少量碘水,溶液变蓝
淀粉未水解
D
室温下,向盐酸溶液中加入少量镁粉,产生大量气泡,测得溶液温度上升
镁与盐酸反应放热
共价键
键能()
799
343
436
463
413
开始沉淀时
1.5
3.4
5.8
6.3
完全沉淀时
2.8
4.7
7.8
8.3
容器编号
物质的起始浓度()
物质的平衡浓度()
Ⅰ
0.6
0
0
0.2
Ⅱ
0.2
0.4
0.1
113,江苏省连云港市2023-2024学年高一上学期期末调研考试化学试题: 这是一份113,江苏省连云港市2023-2024学年高一上学期期末调研考试化学试题,共9页。试卷主要包含了本试卷共6页,包含选择题两部分,下列说法中,正确的是,下列说法正确是的,下列说法错误的是,下列有关的说法中,错误的是等内容,欢迎下载使用。
江苏省连云港市2023-2024学年高二上学期1月期末调研化学试题(PDF版含答案): 这是一份江苏省连云港市2023-2024学年高二上学期1月期末调研化学试题(PDF版含答案),文件包含连云港市2023-2024学年第一学期期末调研考试高二化学试题pdf、2023~2024学年第一学期期末调研考试高二化学试题参考答案pdf等2份试卷配套教学资源,其中试卷共10页, 欢迎下载使用。
江苏省连云港市2023-2024学年高一上学期期末调研考试化学试题(含答案): 这是一份江苏省连云港市2023-2024学年高一上学期期末调研考试化学试题(含答案),共12页。试卷主要包含了本试卷共6页,包含选择题两部分,下列说法中,正确的是,下列说法正确是的,下列说法错误的是,下列有关的说法中,错误的是等内容,欢迎下载使用。












