

07.2021届高考化学三轮考点突破训练 化学平衡常数
展开A.在任何条件下,化学平衡常数都是一个恒定值
B.平衡常数K只与温度有关,与反应物浓度、压强无关
C.从平衡常数K的大小不能推断一个反应进行的程度
D.对于可逆反应C(s)+H2O(g)CO(g)+H2(g)在一定温度下达到平衡时,其平衡常数表达式为
2.下列关于化学平衡常数的说法正确的是( )
A.在任何条件下,化学平衡常数都是一个定值
B.当改变反应物的浓度时,化学平衡常数会发生改变
C.化学平衡常数K与温度、反应物浓度、体系的压强都有关
D.由化学平衡常数K可以推断一个可逆反应进行的程度
3.1000℃时,,。欲使容器中有1.0 ml FeO被还原,反应前容器中应充入。则最接近( )
A.1.0B.2.0C.3.0D.4.0
4.—定条件下,发生反应:2A(g)+2B(g)3C(g)+D(g),该反应在容积不变的密闭容器中进行,达到化学平衡状态的标志是( )
A.单位时间内生成2n ml B,同时消耗3n ml C
B.容器内压强不随时间而变化
C.混合气体的密度不随时间变化
D.单位时间内生成2n ml A,同时生成n ml D
5.化学平衡常数K的数值大小是衡量化学反应进行程度的标准。在一定温度下,下列反应的化学平衡常数数值如下:
,
,
,
以下说法正确的是( )
A.该温度下,分解产生的反应的平衡常数表达式为
B.该温度下,水分解产生,此反应的平衡常数的数值约为
C.该温度下,三种化合物分解产生的倾向由大到小的顺序为
D.以上说法都不正确
6、在常温下,X 2(g)(X代表卤素)和H 2反应生成HX的平衡常数如表所示,仅依据K的变化,判断等物质的量浓度的H 2与X 2反应,下列说法正确的是( )
A.F 2的转化率最大
B.F 2,Cl 2,Br 2,I 2与H 2反应的剧烈程度逐渐减弱
C.F 2,Cl 2,Br 2,I 2与H 2反应的反应速率依次减小
D.升高温度,平衡常数都增大
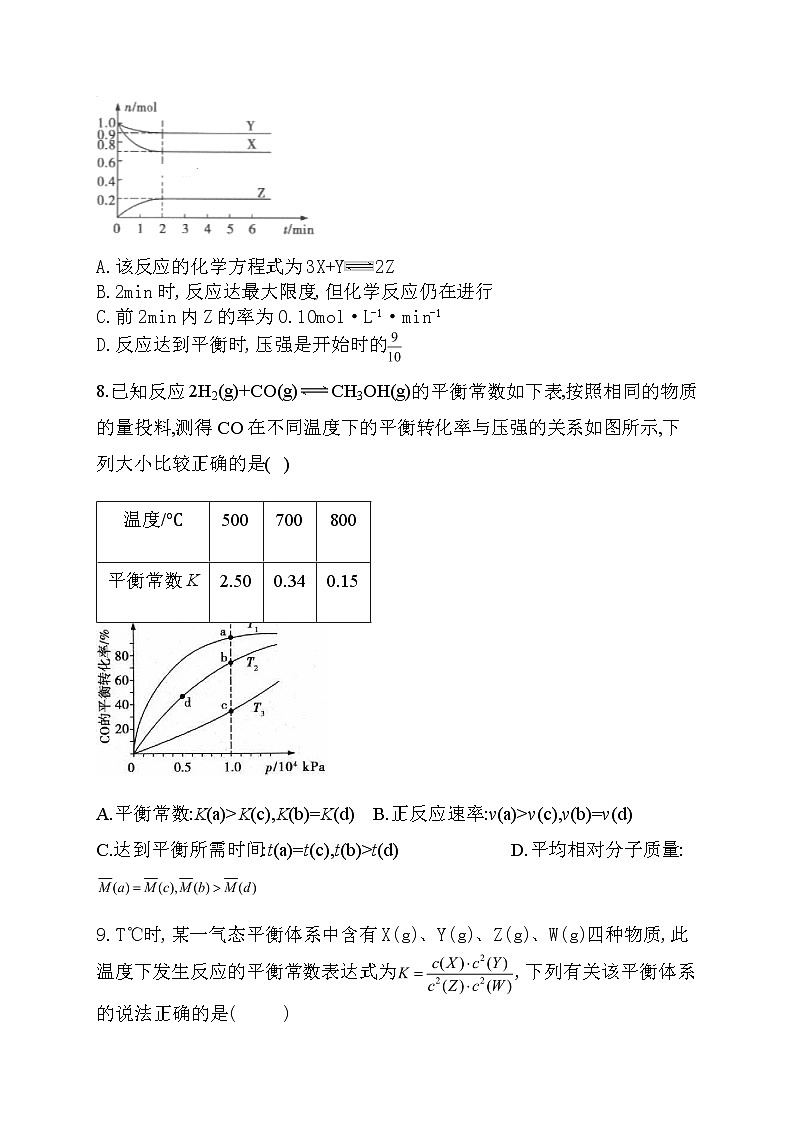
7.某温度时,在一个容积为2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示。根据图中数据判断,下列说法错误的是( )
A.该反应的化学方程式为3X+Y2Z
B.2min时,反应达最大限度,但化学反应仍在进行
C.前2min内Z的率为0.10ml·L-1·min-1
D.反应达到平衡时,压强是开始时的
8.已知反应2H2(g)+CO(g)CH3OH(g)的平衡常数如下表,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示,下列大小比较正确的是( )
A.平衡常数:K(a)>K(c),K(b)=K(d)B.正反应速率:v(a)>v(c),v(b)=v(d)
C.达到平衡所需时间:t(a)=t(c),t(b)>t(d)D.平均相对分子质量:
9.T℃时,某一气态平衡体系中含有X(g)、Y(g)、Z(g)、W(g)四种物质,此温度下发生反应的平衡常数表达式为,下列有关该平衡体系的说法正确的是( )
A.升高温度,W(g)体积分数增大,则正反应是放热反应
B.减小X浓度,平衡向逆反应方向移动,平衡常数K减小
C.平衡正向移动,化学平衡常数一定增大
D.该反应可表示为X(g)+2Y(g)2Z(g)+2W(g)
10.在固定容积的密闭容器中,发生反应:,其化学平衡常数与温度的关系如表:
对该反应而言,下列说法正确的是( )
A.增大压强,平衡向正反应方向移动
B.温度不变,增加X的量,增大
C.若不变,则反应物的转化率一定不变
D.该反应的正反应为吸热反应
11.在一定条件下,将PCl3(g)和Cl2(g)充入容积不变的2L密闭容器中发生反应:PCl3(g)+Cl2(g)PCl5(g),5min末达到平衡,有关数据如表
下列判断不正确的是( )
A.若升高温度,反应的平衡常数减小,则正反应为吸热反应
B.反应5min内,v(PCl3)=0.08ml·L-1·min-1
C.当容器中Cl2为1.2ml时,可逆反应达到平衡状态
D.平衡后移走2.0ml PCl3和1.0ml Cl2,在相同条件下再次达到平衡时,c(PCl5)<0.2ml
12.一定条件下,在体积为10 L的密闭容器中充入1 ml X和1 ml Y进行反应:,60 s后反应达到平衡,生成Z的物质的量为0.3 ml。下列说法正确的是( )
A.X的平衡转化率为40%
B.若将容器体积变为20 L,则Z的平衡浓度小于原来的1/2
C.若增大压强,则Y的平衡转化率减小
D.若升高温度,X的体积分数增大,则该反应的
13.一定条件下,在密闭恒容容器中,能表示反应一定达到化学平衡状态的是( )
①X、Y、Z的物质的量之比是1:2:2
②X、Y、Z的浓度不再发生变化
③容器中的压强不再发生变化
④单位时间内生成nmlZ,同时生成2nmlY
A.①②B.①④C.②③D.③④
14.将装入带活塞的密闭容器中,当反应达到平衡后,改变下列一个条件,其中叙述错误的是( )
A.慢慢压缩气体体积,平衡向右移动,混合气体颜色较原来浅
B. 升高温度,气体颜色加深,则此正反应为放热反应
C.慢慢压缩气体使体积减小一半,压强增大,但小于原来的两倍
D.恒温恒容时,充入惰性气体,压强增大,平衡不会移动
15.对于下列化学平衡在一定条件下发生移动的描述,不正确的是( )
A. Cl2+H2OHCl+HClO,氯水中加入碳酸钙,漂白性增强
B. ZnS + Cu2+CuS + Zn2+,闪锌矿(ZnS)遇溶液转化为铜蓝(CuS)
C. 2NO2N2O4<0,将装有NO2的玻璃球浸入热水中,红棕色变浅
D. (橙色)+H2O2 (黄色) +2H+,溶液中滴加几滴浓硫酸,橙色加深
16.工业制硝酸中的一步重要反应是在加热条件下催化氧化:这是一个正反应放热的可逆反应,如果反应在密闭容器中进行,下列说法中错误的是( )
A.使用催化剂可以加快反应速率,提高生产效率
B.适当提高的浓度可以提高的转化率
C.升高温度,正反应速率增大、逆反应速率减小
D.的转化率为最大值时,该反应达到平衡状态
17.已知某可逆反应在密闭容器中进行。如图表示在不同时刻t、温度T和压强p下B物质在混合气体中的体积分数的变化情况。下列推断中正确的是( )
A.
B.
C.
D.
18.在一定温度下,将3ml CO2和2ml H2混合于2L的密闭容器中,发生如下反应:
CO2(g)+H2(g)CO(g)+H2O(g)。
(1).该反应的化学平衡常数表达式K=__________。
(2).已知在700 ℃时,该反应的平衡常数K1=0.5,则该温度下反应的平衡常数K2=__________,反应的平衡常数=__________。
(3).已知在1000 ℃时,该反应的平衡常数K4=(1).0,则该反应为__________反应(填“吸热”或“放热”)。
(4).在1000 ℃下,某时刻CO2的物质的量为2ml,则此时v(正)__________v(逆)(填“>”、“=”或“<”)。
19.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表所示:
回答下列问题:
(1).该反应的化学平衡常数表达式为K=__________。
(2).该反应为__________(填“吸热”或“放热”)反应。
(3).某温度下,平衡浓度符合下式:c(CO2) • c(H2) = c(CO) • c(H2O),试判断此时的温度为__________℃。
(4).在800 ℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)=2 ml/L,c(H2)=(1).5 ml/L,c(CO)=1 ml/L,c(H2O)=3 ml/L,则下一时刻,反应向__________(填“正向”或“逆向”)进行。
20.已知A(g)+B(g)C(g)+D(g)反应的平衡常数和温度的关系如下:
回答下列问题:
(1).该反应的平衡常数表达式K= , △H 0(填“<”“ >”“ =”);
(2).830℃时,向一个5 L的密闭容器中充入0.20ml的A和0.80ml的B,若反应初始6s内A的平均反应速率v(A)=0.003 ml·L-1·s-1。,则6s时 c(A)=__________ml·L-1, C的物质的量=__________ ml;若经一段时间后,反应达到平衡,则此时A的转化率=__________ ,如果这时向该密闭容器中再充入1 ml氩气,平衡时A的转化率__________( 填“变大”或“变小”或“不变”);
(3).判断该反应达到平衡的依据为__________ (填正确选项前的字母):
a.压强不随时间改变
b.气体的密度不随时间改变
c.c(A)不随时间改变
d.单位时间里生成C和D的物质的量相等
(4).1200℃时反应C(g)+D(g) A(g)+B(g)的平衡常数的值为__________ 。
21.消除含氮、硫等化合物对大气的污染,对建设美丽家乡、打造宜居环境具有重要意义。
(1)容积均恒定为1 L的甲、乙两个容器,其中甲为绝热容器,乙为恒温容器。相同温度下,分别充入0.2 ml的NO2,发生反应: ΔH<0,甲中NO2的相关量随时间变化如图所示。
① 0~3 s内,甲容器中NO2的反应速率增大的原因是________________。
② 甲达到平衡时,温度若为T ℃,此温度下的平衡常数K=________________。
③ 平衡时,p甲________(填“>”“<”或“=”,下同)p乙,K甲________K乙。
(2)汽车尾气中CO与H2O(g)在一定条件下可以发生反应: ΔH2<0。820 ℃ 时在甲、乙、丙三个恒容密闭容器中,起始时按照下表进行投料,达到平衡状态,K=(1).0。
平衡时,甲容器中CO的转化率是________;比较容器中CO的转化率:乙________(填“>”“=”或“<”,下同)甲,丙________甲。
22.硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)2SO3(g) △H<0
(1).如果2min内SO2的浓度由6ml·L-1下降为2ml·L-1,则用O2浓度变化表示的平均反应速率为__________
(2).某温度下,SO2的平衡转化率(a)与体系总压强(p)的关系如图甲所示:
该反应的平衡常数表达式为__________,平衡状态由A变为B时平衡常数K(A)__________K(B)(填">","<"或"=")
(3).此反应在恒温密闭的装置中进行,能说明此反应已达到平衡的是( )
A.接触室中气体的平均相对分子质量不再改变
B.接触室中SO2、O2、SO3的浓度相同
C.接触室中SO2、O2、SO3的物质的量之比为2:1:2
D.接触室中压强不随时间变化而变化
(4).图乙表示该反应在密闭容器中达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况
a~b过程中改变的条件可能是__________;
b~c过程中改变的条件可能是__________;
若增大压强,请把反应速率变化情况画在c~d处
2(3).已知N2O4(g)2NO2(g),△H>0,在80℃时,将0.4ml的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
(1).20s时,N2O4的分解率是______________。
(2).40s时,NO2的浓度为______________,0~40s内N2O4的平均反应速率为______________。
(3).在80℃时该反应的平衡常数K值为______________。
(4).判断t2、t3、t4时刻对该反应采取的措施。
t2:_________;t3:___________;t4:__________。
24.某温度时,在2L密闭容器中,三种气态物质X、Y、Z的物质的量 (n)随时间(t)变化的曲线如图所示,由图中数据分析可得:
(1)该反应的化学方程式为______.
(2)反应开始至2min,用Y表示的平均反应速率为______,X的转化率为______.
(3)在一定温度下,下列情况可作为上述反应达到反应限度的标志的是______.
A.X、Y、Z的浓度相等
B.X、Y、Z的分子数比为3:1:2
C.Z的生成速率是Y的生成速率的二倍
D.单位时间内生成nmlY,同时生成3nmlX
(4)在密闭容器里,通入aml A(g)和bml B(g),发生反应 A(g)+ B(g)= 2C(g) ,当改变下列条件时,会加快反应速率的是______ (填序号).
①降低温度 ②保持容器的体积不变,充入氦气
③加入催化剂 ④保持容器的体积不变,增加A(g)的物质的量.
参考答案
1.答案:B
解析:化学平衡常数随温度的改变而改变,故A错误;平衡常数K只与温度有关,与反应物浓度、压强无关,故B正确;从平衡常数K的大小可以推断一个反应进行的程度,平衡常数越大,反应进行得越彻底,故C错误;对于可逆反应C(s)+H2O(g)CO(g)+H2(g)在—定温度下达到平衡时,其平衡常数表达式为,故c(H2O)D错误
2.答案:D
解析:化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值。平衡常数只与温度和化学计量数有关系,所以选项A、B、C都是错误的,只有选项D正确,答案选D。
3.答案:C
解析:当容器中有1.0ml FeO被还原时,有1.0ml参与反应,生成1.0ml 。设容器容积为,则平衡时,。,解得。
4.答案:D
解析:本题易错之处一是简单地认为压强、密度不变了就达到了化学平衡,忽略了在反应前后气体分子数不变的反应中压强本来就是不变的,忽略了混合气体质量—定、体积一定,密度始终不变,而错选B或C;另一易错之处是未理解正反应速率和逆反应速率的区别,单纯地认为各物质的反应速率之比等于对应化学计量数之比就达到了平衡,而错选A。A项,生成B 和消耗C为同一反应方向,因此无法判断反应是否达到平衡;B项,因为该反应为反应前后气体分子数不变的反应,因此容器内压强不随时间的变化而变化;C项,混合气体的质最一定、容器体积一定,故混合气体的密度始终不变;D项.用不同物质表示的化学反应速率,方向相反,且反应速率之比等于对应的化学计量数之比,所以正反应速率等于逆反应速率,故D项说明反应达到了化学平衡状态。
5.答案:C
解析:常温下,NO分解产生O2的反应的平衡常数表达式K1=,A错误;2H2(g)+O2(g) 2H2O(g) K2=2×1081,
所以2H2O(g) 2H2(g)+O2(g) K==5×10-82,B错误;由2H2O(g) 2H2(g)+O2(g) K=5×10-82,则常温下,NO、H2O、CO2三种化合物分解放出O2的化学平衡常数K的数值逐渐减少,则化学反应进行倾向由大到小的顺序为NO>H2O>CO2,C正确;因C正确,D错误。答案选C。
6.答案: D
解析: 化学平衡常数越大,反应物的转化率越大,A项正确;仅由化学平衡常数不能判断反应速率的大小与反应的剧烈程度,B、C项错误;仅从平衡常数判断不出反应是吸热还是放热,故无法知道平衡常数随温度变化的情况,D项错误。
7.C
根据各物质的物质的量变化量之比等于其化学计量数之比,可知X、Y、Z的系数为3、1、2,该反应为可逆反应,A正确;2min时达到平衡,但化学反应仍在进行,B正确;反应开始至2min,Z的反应速率为,C错误;压强之比等于物质的量之比,由知反应达到平衡时的压强是开始时的,D正确.答案选C.
8.答案:A
解析:温度相同,平衡常数相同,不同温度时,CO的转化率越大,平衡常数越大,所以K(a)>K(c),K(b)=K(d),A项正确;根据表中数据可知,温度越高,平衡常数越小,说明正反应为放热反应,所以T1
解析:由A:的表达式可知,Z、W是反应物,X、Y是生成物,升高温度,W(g)体积分数增大,则反应逆向移动,正反应是放热反应,故A正确;X是生成物,减小X浓度,平衡向正反应方向移动,温度不变,平衡常数K不变,故B错误;平衡正向移动,化学平衡常数不一定增大,若温度不变,则化学平衡常数不变,故C错误;该反应可表示为2Z(g) +2W(g)=X(g) +2Y(g),故D错误。
10.答案:D
解析:该反应为反应前后气体体积不变的反应,增大压强,平衡不移动,A错误;通常情况下,只与温度有关,温度不变,不变,B错误;不变时,温度不变,若减小生成物浓度使平衡正向移动,可增大反应物的转化率,C错误;表中数据可知,温度越高越大,则正反应为吸热反应,D正确。
11.答案:A
解析:A项,升高温度,反应的平衡常数减小,则平衡逆向移动,所以正反应为放热反应,错误;B项,由三段式的计算可知:
PCl3(g)+Cl2(g)PCl5(g)
初始浓度/ml·L-1 2.0 1.0 0
转化浓度/ml·L-1 0.4 0.4 0.4
平衡浓度/ml·L-1 1.6 0.6 0.4
v(PCl3)=" 0.4" /5 ml·L-1·min-1="0.08" ml·L-1·min-1,正确;C项,由上述三段式计算可知,c(Cl2)=
0.6 ml·L-1,n(Cl2)="1.2" ml,正确;D项,首先求得化学平衡常数,平衡后移走2.0 ml PCl3和1.0 ml Cl2,c(PCl3)="0.6" ml·L-1,c(Cl2)="0.1" ml·L-1,根据化学平衡常数不变,求得c(PCl5)=
0.025 ml·L-1,正确。
12.答案:B
解析:A.根据上面关系可知A的转化率为,故A错误;
B. 将容器体积变为20L,若平衡不移动,c(Z)变为原来的,但体积增大,压强减小,平衡逆向移动,则小于原来的,故B正确;
C.增大压强,平衡正向移动,则物质Y的转化率增大,故C错误;
D.升高温度,平衡逆向移动时X的体积分数增大,可知逆反应吸热,则正反应为放热反应,该反应的,故D错误;
13.答案:C
14.答案:A
15.答案:C
解析:A. 氯水中加入碳酸钙,HCl与碳酸钙反应,平衡正向移动,则HClO浓度增大,漂白性增强,故A正确;
B. 发生,溶解度大的物质转化为溶解度小的物质,溶解度ZnS>CuS,则闪锌矿(ZnS)遇溶液转化为铜蓝(CuS),故B正确;
C. 升高稳定,平衡逆向移动,则红棕色变深,故C错误;
D. 增大氢离子浓度,平衡逆向移动,则橙色加深,故D正确。
故选:C。
16.答案:C
17.答案:D
解析:由图象可知,温度为时,根据到达平衡的时间可知,且压强越大,B的含量高,说明压强增大平衡向逆反应方向移动,故正反应为气体体积增大的反应,即;
压强为时,根据到达平衡的时间可知,且温度越高,B的含量低,说明温度升高平衡向正反应方向移动,则正反应为吸热反应,即,
故选D.
18.答案:(1).
(2).2;
(3).吸热; (4).>
解析:(1).根据化学平衡常数的概念
(2).
(3).由于升高温度,该反应的平衡常数增大,故该反应为吸热反应。
(4). CO2(g)+H2(g)CO(g)+H2O(g)
起始/ml: 3 2 0 0
变化/ml: 1 1 1 1
某时刻/ml: 2 1 1 1
所以c(CO)=0.5ml/L,c(H2O)=0.5ml/L
c(CO2)=1 ml/L,c(H2)=0.5 ml/L
故
反应应向正反应方向进行,所以v(正)>v(逆)。
19.答案:(1).
(2).吸热; (3).830; (4).逆向
解析:(1).依据化学平衡常数定义写出表达式。
(2).通过表中K和温度T的关系可知,温度越高,K大,反应向正向进行的程度越大,说明正反应为吸热反应。
(3).当c(CO2) • c(H2) = c(CO) • c(H2O)时,K=1,此时温度由表中数据可知为830℃。
(4).判断反应进行的方向时,可根据浓度商Qc与平衡常数K的大小关系判断,此时刻下, ,所以反应向逆反应方向进行。
20.答案:(1).K= ;<
(2); 0.09; 80%; 不变
(3).c; (4).(2).5
解析:(1).可逆反应达到平衡状态时各生成物浓度的幂指数的乘积与各反应物浓度幂指数的乘积的比。该反应的化学平衡常数K=。因为升高温度,化学平衡常数减小,说明升高温度,化学平衡逆向移动。
(2).根据平衡移动原理:升高温度,化学平衡向吸热反应方向移动。逆反应方向为吸热反应。所以该反应的正反应为放热反应。所以△H<0.(2)v(A)=0.003 ml·L-1·s-1,△c(A)= v(A)×△t=0.003 ml·L-1·s-1×6s=0.018ml/L则6s时c(A)=(0.20ml÷5 L)-0.018ml/L=0.022ml/L.C的物质的量0.018ml/L×5 L= 0.09ml。因为在830℃时化学平衡常数K=1.0.假设在反应的过程中A消耗的物质的量为x 则达到平衡时各物质的物质的量分别是A:(0.20-x)ml;B:(0.80-x)ml;C:x ml;D:x ml.由于各物质的方程式前边的系数都为1,所以达到平衡时的物质的量的比等于浓度的比。X2÷[(0.20-x)×(0.80-x)]=1.0.解得x=0.16.所以A的转化率为(0.16÷0.20)×100%=80%。如果这时向该密闭容器中再充入1 ml氩气,因为容器的容积不变。A的浓度不变,所以平衡不发生移动。故平衡时A的转化率也不变。
(3).a.因为该反应是个反应前后气体体积相等的可逆反应,所以无论反应是否达到平衡,容器内气体的压强都不会发生改变。错误。b.由于在反应前后气体的体积不变,反应遵循质量守恒定律,质量也不变,因此任何时刻,无论反应是否达到平衡,气体的密度都不改变。错误。c.若反应未达到平衡,则 c(A)就会发生改变。现在c(A)不随时间改变,说明反应达到了平衡状态。正确。d.在方程式中,C和D都是生成物,系数相同,所以在任何时间段内单位时间里生成C和D的物质的量总是相等,因此不能以此为标准判断反应是否达到平衡状态。错误。故正确的选项为c。
(4).在1200℃时A(g)+B(g)C(g)+D(g)的平衡常数反应C(g)+D(g) A(g)+B(g)的平衡常数的值为;可见K1、K2互为倒数。因为此时K1=0.4,所以K2=1÷0.4=2 .5。
21.答案:6.(1)① 反应放热,体系的温度升高,反应速率加快
③ >;<
(2)50%;>;=
解析:(1)① 甲为绝热容器,,反应为放热反应,放出的热量对反应速率影响大,0~3s内,甲容器中NO2的反应速率增大的原因是0~3s内温度升高对反应速率影响大于浓度降低的影响,故答案为反应放热,体系的温度升高,反应速率加快。
② 相同温度下,分别充入0.2 ml的NO2,发生反应:,达到平衡状态时二氧化氮浓度为0.02 ml·L-1.
起始量/ 0.2 0
变化量/ 0.18 0.09
平衡量/ 0.02 0.09
平衡常数,故答案为225。
③ 容积均为1L的甲、乙两个容器,其中甲为绝热容器,乙为恒温容器,相同温度下,分别充入0.2 ml的NO,发生反应:,甲容器中温度升高,平衡逆向移动,平衡常数减小,则K甲
(2)甲容器中起始时,根据平衡常数计算可得到CO的转化率为50%;乙容器中起始时n(H2O)=0.20 ml,相当于在甲容器中增大,平衡正向移动,减小,CO的转化率增大;丙容器中起始时,相当于两个甲容器中的量,假设两个甲容器合二为一,反应达到平衡后,缩小体积至一半变成丙容器,相当于对体系加压,平衡不移动,CO的转化率不变。
解析:
22.答案:1.1ml·L-1·min-1
(2). ; =
(3).AD; (4).升温; 减小SO3浓度;
解析:(1).;
(2).在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值为化学平衡常数,故可逆反应2SO2(g)+O2(g)2SO3(g)的平衡常数平衡常数只受温度的影响,温度不变,平衡常数不变,平衡状态由A变为B时,压强增大,温度不变,K(A)=K(B)
(3).气体的总质量不变,随反应的进行,气体的总物质的量减小,平均相对分子质量增大,故平均相对分子质量不变,说明达到平衡状态,A项正确;接触室中SO2、O2、SO3,的浓度相同时,不一定达到平衡,B项错误;平衡时接触室中SO2、O2、SO3的物质的量之比有可能为2:1:2,也可能不是,与二氧化硫的转化率有关,故C项错误; 随反应的进行,气体总物质的量减小,接触室中压强减小,压强不随时间变化而变化,说明达到平衡状态,D项正确。
(4).a时刻逆反应速率大于正反应速率,且正、逆反应速率都增大, 说明平衡应向逆反应方向移动,该反应的正反应放热,改变的条件可能为升髙温度;b时刻正反应速率不变,逆反应速率减小,平衡向正反应方向移动,改变的条件可能为减小生成物的浓度;若增大压强,则正、逆反应速率都增大,且正反应速率大于逆反应速率,平衡向正反应方向移动。
23.答案:1.20%
(2); 0.002ml/L
(3).0.4
(4).增大产物浓度;降温;加入催化剂
24.答案:3X+Y2Z;
0.025ml/(L·min) ;
30% ;
C;
③④
化学方程式
平衡常数K
化学方程式
平衡常数K
F2+H2=2HF
6.5×1095
Br2+H2=2HBr
1.9×1019
Cl2+H2=2HCl
2.6×1033
I2+H22HI
8.7×102
温度/℃
500
700
800
平衡常数K
2.50
0.34
0.15
/℃
700
800
900
1000
1200
0.6
0.9
1.3
1.8
2.7
PCl3(g)
Cl2(g)
PCl5(g)
初始浓度/(ml·L-1)
2.0
1.0
0
平衡浓度/(ml·L-1)
c1
c2
0.4
T(℃)
700
800
830
1000
1200
K
0.6
0.9
1.0
1.7
2.6
温度/ ℃
700
800
830
1000
1200
平衡常数
1.7
1.1
1.0
0.6
0.4
起始物质的量
甲
乙
丙
n(H2O)/ml
0.10
0.20
0.20
n(CO)/ml
0.10
0.10
0.20
0
20
40
60
80
100
C(N2O4)
0.20
a
0.12
c
d
e
C(NO2)
0.00
0.08
b
0.20
0.20
0.20
13.2021届高考化学三轮考点突破训练 有机化学基础应用: 这是一份13.2021届高考化学三轮考点突破训练 有机化学基础应用,共18页。试卷主要包含了关于下列四种烃的说法正确的是,有4种碳骨架如下的烃等内容,欢迎下载使用。
22.2021届高考化学三轮考点突破训练 化学反应平衡的判断: 这是一份22.2021届高考化学三轮考点突破训练 化学反应平衡的判断,共21页。试卷主要包含了下列变化一定会引起平衡移动的是,有三支试管,分别加入下列物质后等内容,欢迎下载使用。
05.2021届高考化学三轮考点突破训练 化学实验基本操作: 这是一份05.2021届高考化学三轮考点突破训练 化学实验基本操作,共25页。












