2021年高考化学非选择题突破训练——综合实验设计与评价(2)(有答案)
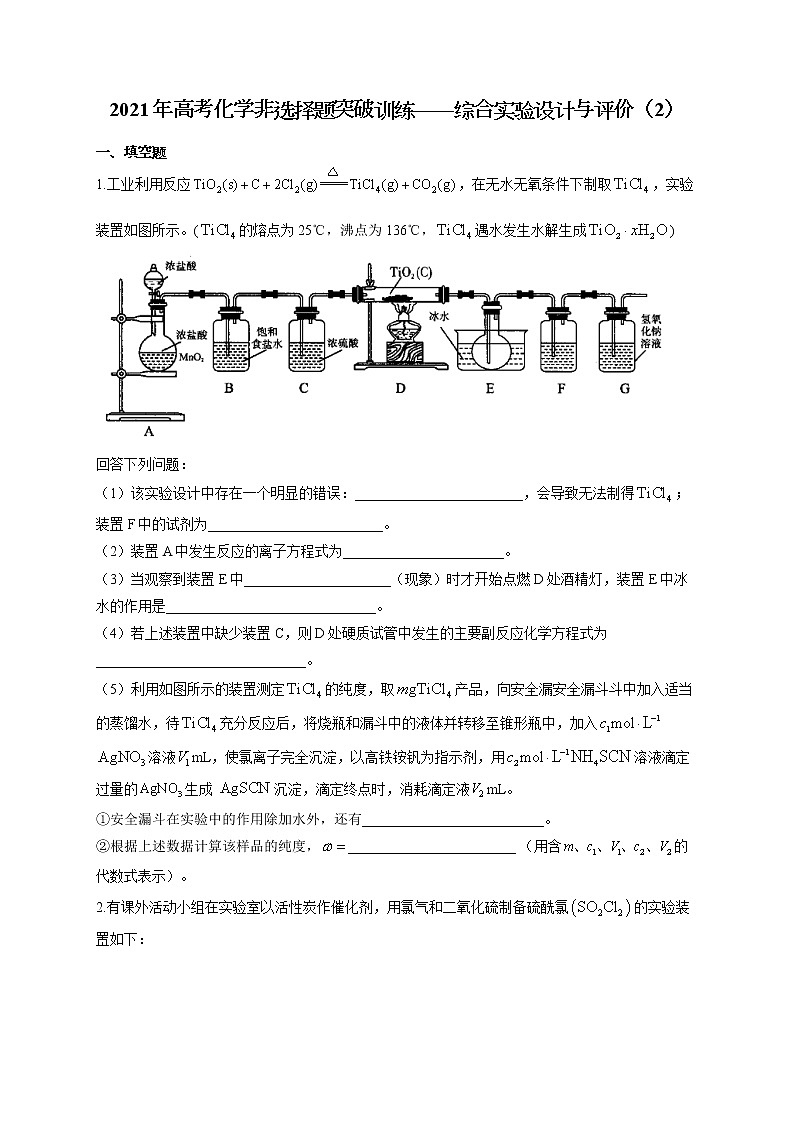
展开1.工业利用反应,在无水无氧条件下制取,实验装置如图所示。(的熔点为25℃,沸点为136℃,遇水发生水解生成)
回答下列问题:
(1)该实验设计中存在一个明显的错误:________________________,会导致无法制得;装置F中的试剂为_________________________。
(2)装置A中发生反应的离子方程式为_______________________。
(3)当观察到装置E中_____________________(现象)时才开始点燃D处酒精灯,装置E中冰水的作用是______________________________。
(4)若上述装置中缺少装置C,则D处硬质试管中发生的主要副反应化学方程式为______________________________。
(5)利用如图所示的装置测定的纯度,取产品,向安全漏安全漏斗斗中加入适当的蒸馏水,待充分反应后,将烧瓶和漏斗中的液体并转移至锥形瓶中,加入溶液mL,使氯离子完全沉淀,以高铁铵钒为指示剂,用溶液滴定过量的生成沉淀,滴定终点时,消耗滴定液mL。
①安全漏斗在实验中的作用除加水外,还有__________________________。
②根据上述数据计算该样品的纯度,________________________ (用含的代数式表示)。
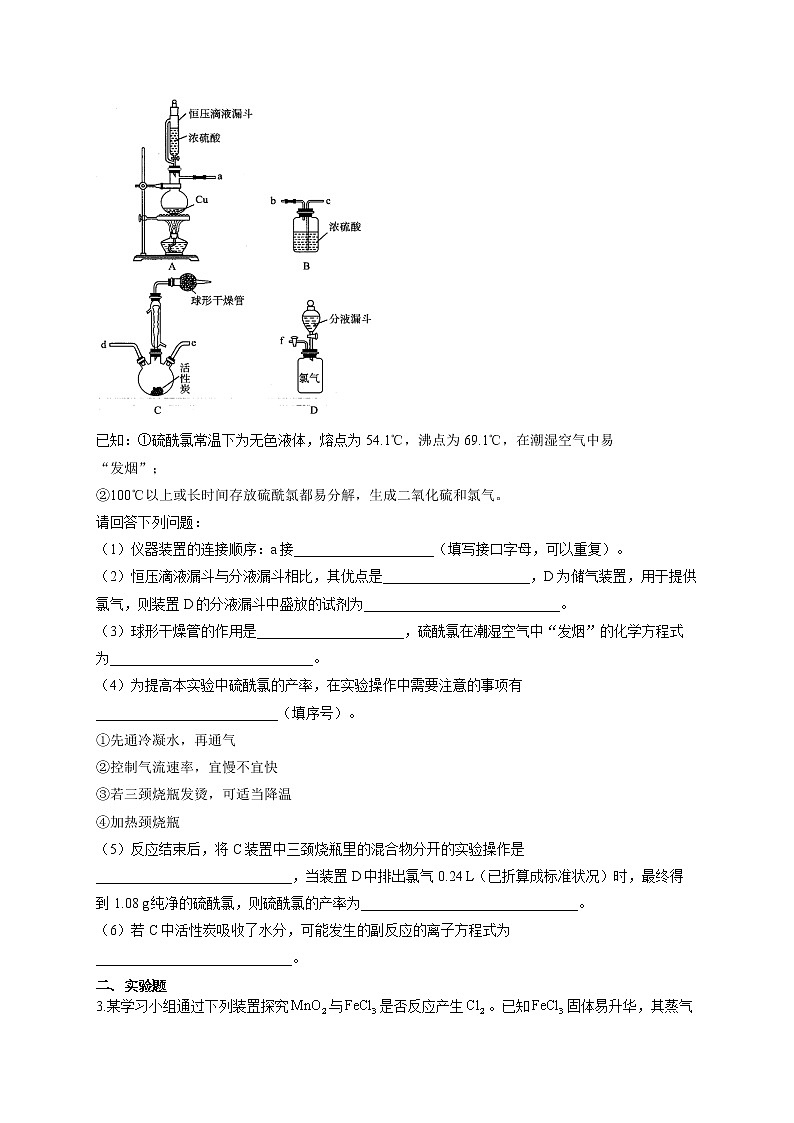
2.有课外活动小组在实验室以活性炭作催化剂,用氯气和二氧化硫制备硫酰氯的实验装置如下:
已知:①硫酰氯常温下为无色液体,熔点为54.1℃,沸点为69.1℃,在潮湿空气中易
“发烟”;
②100℃以上或长时间存放硫酰氯都易分解,生成二氧化硫和氯气。
请回答下列问题:
(1)仪器装置的连接顺序:a接____________________(填写接口字母,可以重复)。
(2)恒压滴液漏斗与分液漏斗相比,其优点是_____________________,D为储气装置,用于提供氯气,则装置D的分液漏斗中盛放的试剂为____________________________。
(3)球形干燥管的作用是_____________________,硫酰氯在潮湿空气中“发烟”的化学方程式为_____________________________。
(4)为提高本实验中硫酰氯的产率,在实验操作中需要注意的事项有__________________________(填序号)。
①先通冷凝水,再通气
②控制气流速率,宜慢不宜快
③若三颈烧瓶发烫,可适当降温
④加热颈烧瓶
(5)反应结束后,将C装置中三颈烧瓶里的混合物分开的实验操作是____________________________,当装置D中排出氯气0.24 L(已折算成标准状况)时,最终得到1.08 g纯净的硫酰氯,则硫酰氯的产率为_______________________________。
(6)若C中活性炭吸收了水分,可能发生的副反应的离子方程式为____________________________。
二、实验题
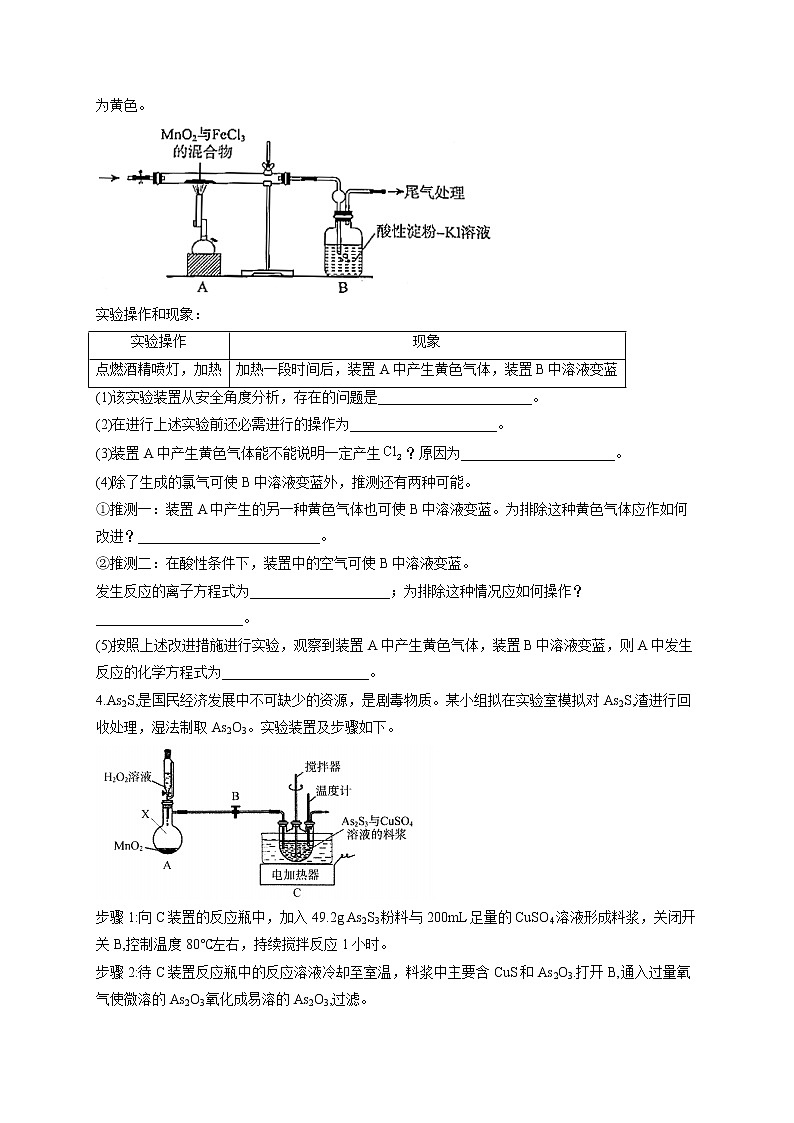
3.某学习小组通过下列装置探究与是否反应产生。已知固体易升华,其蒸气为黄色。
实验操作和现象:
(1)该实验装置从安全角度分析,存在的问题是______________________。
(2)在进行上述实验前还必需进行的操作为_____________________。
(3)装置A中产生黄色气体能不能说明一定产生?原因为______________________。
(4)除了生成的氯气可使B中溶液变蓝外,推测还有两种可能。
①推测一:装置A中产生的另一种黄色气体也可使B中溶液变蓝。为排除这种黄色气体应作如何改进?__________________________。
②推测二:在酸性条件下,装置中的空气可使B中溶液变蓝。
发生反应的离子方程式为____________________;为排除这种情况应如何操作?_____________________。
(5)按照上述改进措施进行实验,观察到装置A中产生黄色气体,装置B中溶液变蓝,则A中发生反应的化学方程式为_____________________。
4.As2S,是国民经济发展中不可缺少的资源,是剧毒物质。某小组拟在实验室模拟对As2S,渣进行回收处理,湿法制取As2O3。实验装置及步骤如下。
步骤1:向C装置的反应瓶中,加入49.2g As2S3粉料与200mL足量的CuSO4溶液形成料浆,关闭开关B,控制温度80℃左右,持续搅拌反应1小时。
步骤2:待C装置反应瓶中的反应溶液冷却至室温,料浆中主要含CuS和As2O3.打开B,通入过量氧气使微溶的As2O3氧化成易溶的As2O3,过滤。
步骤3:向步骤2的滤液中通入二氧化硫,使As2O5还原,经冷却析出As2O3晶体19.8g。
(1)A装置中仪器X的名称是_____;步骤1将As2S3粉碎后制成料浆的目的是____________;实验中的加热方式为________。
(2)C装置反应瓶中发生反应的化学方程式为_______________________。步骤2中,若过滤后的溶液中Cu2+浓度为1.0ml·L-1,已知CuS的Ksp=6.3×10-36.则滤液中S2-浓度为______ml·L-1。
(3)步骤3中,通入二氧化硫使As2O5还原的离子方程式为______________________
(4)本实验中As2O3的产率最接近于( )(填标号)
A.40%B.50%C.60%D.70%
(5)将分离出As2O3晶体后的母液收集、循环使用,其实际工业生产的意义是____________________。
5.工业制得的氮化铝(AlN)产品中常含有少量Al4C3、Al2O3、C等杂质。某同学设计如下实验欲分别测定氮化铝(AlN)样品中AlN和Al4C3的质量分数(忽略NH3在强碱性溶液中的溶解)。
Ⅰ.实验原理:
(1)① Al4C3与硫酸反应可生成CH4且反应放热;请写出Al4C3与硫酸反应的化学方程式:
_______________________________。
② AlN溶于强酸产生铵盐,溶于强碱生成氨气。
Ⅱ.实验装置(如图所示,量气管为碱式滴定管改装)
Ⅲ.实验过程:
连接实验装置,检查装置的气密性。
称取4.8g AlN样品置于装置B锥形瓶中,各装置中加入相应药品,称得装置D的初始质量为a g;,重新连好装置;读取量气管的初始读数为x mL(量气装置左右液面相平)。
(2)①首先测量Al4C3的质量分数,先通过分液漏斗加入过量的_______,与锥形瓶内物质充分反应。对三个活塞的操作是____________。
②若无恒压管,则此步骤所测气体体积______(填“偏大”“偏小”或“无影响”)。
③量气管中液面不再发生变化,说明反应已经结束,调节量气装置使左右液面相平。读取读数,若锥形瓶内气体未冷却至室温,则所测气体的体积_______(填“偏大”“偏小”或“无影响”)。
④记录滴定管的读数为y mL(已知:该实验条件下的气体摩尔体积为VmL·ml-1),则Al4C3的质量分数为_______%(用含x、y、Vm的代数式表示)。
⑤再测量AlN质量分数的数据:关闭活塞K1、K2,打开活塞K3,通过分液漏斗加入过量NaOH溶液并加热,使装置B瓶内物质充分反应;反应完成后,打开K2,通入一段时间空气的理由____________________________。
⑥最后称得装置D的质量为b g,则AlN的质量分数为_______(用含a、b的代数式表示)。
6.某铁矿石主要成分为和,实验室为测定和的物质的量之比,利用如图所示装置进行实验。
实验步骤如下:
Ⅰ.按图示连接仪器,检查装置气密性后加入药品;
Ⅱ.打开,通入一段时间氮气,关闭,取下干燥管快速称量其质量后再连接好装置;
Ⅲ.打开和分液漏斗活塞,向三颈烧瓶中慢慢滴加足量已经除去的稀硫酸(其他杂质与稀硫酸不反应,且无还原性物质),待反应完成后,打开通入一段时间氮气;
Ⅳ.关闭,取下三颈烧瓶过滤、洗涤,将滤液与洗涤液合并配制成100 mL溶液备用;
Ⅴ.取下上述步骤Ⅱ中的干燥管并称量其质量;
Ⅵ.取配制好的滤液25 mL于锥形瓶中,用溶液滴定。
回答下列问题:
(1)步骤Ⅱ中通入氮气的主要目的是_______________,需要称重的干燥管是_______________(填“E”或“F”)。
(2)实验过程中发现装置B中有黑色沉淀生成,写出装置A中与稀硫酸反应的化学方程式_______________。
(3)装置C的作用是_______________。
(4)步骤Ⅳ中过滤操作要迅速,否则会使测得的的含量_______________(填“偏高”或“偏低”)。检验沉淀是否洗涤干净,可采取的操作是_______________。
(5)若上述实验中,步骤Ⅵ消耗溶液45mL,则该矿石样品中_______________。
(6)铁、镍易与CO作用形成羰基配合物,的中心原子价电子数与配体提供的电子数之和为18,则___________________,1 ml 中含有键数目为________________________;已知为正四面体构型,下列溶剂能够溶解的是______________________(填写字母)。
A.四氯化碳
B.苯
C.水
D.液氨
7.三氯乙醛(CCl3CHO)是生产农药、医药的重要中间体,实验室制备三氯乙醛的反应装置示意图(加热装置未画出)和有关数据如图:
①制备反应原理:C2H5OH+4Cl2→CCl3CHO+5HCl
②反应过程中C2H5OH和HCl可能会生成副产物C2H5Cl,同时CCl3CHO(三氯乙醛)也能被次氯酸继续氧化生成CCl3COOH(三氯乙酸)
③相关物质的相对分子质量及部分物理性质:
(1)E的作用是___________,A中所发生反应的离子方程式为____________________。
(2)写出三氯乙醛被次氯酸氧化生成三氯乙酸的化学方程式:___________________。
(3)该设计流程中存在一处缺陷是__________,导致引起的后果是_______________。
(4)反应结束后,有人提出先将C中的混合物冷却到室温,再用分液的方法分离出三氯乙酸。你认为此方案是否可行______(填是或否),原因是________________________。
(5)测定产品纯度:称取产品4.6g配成待测溶液100.00mL,取待测液10.00mL于滴定瓶中,加入0.1000ml•L-1碘标准溶液25.00mL,再加入适量Na2CO3溶液,反应完全后,加盐酸调节溶液的pH,立即用0.02000ml•L-1 Na2S2O3溶液滴定至终点。进行三次平行实验,测得平均消耗Na2S2O3溶液20.00mL。则产品的纯度为______(计算结果保留四位有效数字)。滴定原理:、、。
8.“中国芯”的发展离不开单晶硅,四氯化硅是制备高纯硅的原料。某小组拟在实验室用下列装置模拟探究四氯化硅的制备和应用(夹持装置已省略)。
已知有关信息:
①Si +3HClSiHCl3+H2,Si + 2Cl2SiCl4
②SiC14遇水剧烈水解,SiC14的熔点、沸点分别为-70.0 ℃、57.7 ℃
请回答下列问题:
(1)装浓盐酸的仪器名称是_____________。
(2)写出A中发生反应的离子方程式:_____________。
(3)若拆去B装置,可能的后果是______________。
(4)有同学最初将E、F、G装置设计成图11装置,图11装置的主要缺点是__________(写出一个即可)。
(5)已知NH4Cl在高温条件下易分解生成NH3和HCl。利用SiCl4和NH3制备新型无机非金属材料(Si3N4)的装置如图1。写出该反应的化学方程式:_________。利用尾气制备盐酸,宜选择下列装置中的_____________(字母)。
(6)取少量SiCl4产品溶于足量蒸馏水中生成硅酸,该反应的化学方程式为__________。
参考答案
1.答案:(1)A中缺少加热装置;浓硫酸
(2)
(3)充满黄绿色气体;使冷凝
(4)
(5)①形成液封,吸收HCl气体 ②
解析: (1)实验室用二氧化锰和浓盐酸制取氯气时需要加热,遇水发生水解,需要防止装置G中的水蒸气进入装置E中。
(2)装置A中发生反应的离子方程式为。(3)制取需要在无水无氧条件下进行,因此需要排尽装置内部的空气,当观察到装置E中充满黄绿色气体时,开始点燃D处酒精灯; 的熔点为-25℃,沸点为136℃,装置E中冰水的作用是使冷凝。
(4)若缺少装置C,遇水发生水解生成。
(5)①安全漏斗的双球形成液封,吸收HCl气体。②根据题意可以确立原子守恒关系,,。
2.答案:(1)cbde(或ed)bcf
(2)平衡气压,便于液体流下;饱和食盐水
(3)吸收氯气和二氧化硫,防止污染环境,防止空气中的水分进入装置C;
(4)①②③
(5)过滤;80%
(6)
解析:(1)由题给装置图可知,A为二氧化硫制备装置,D为氯气提供装置、C为硫酰氯的制备装置,由于硫酰氯在潮湿空气中易“发烟”,通入C中的气体必须为于燥气体,则装置的连接顺序为 ABCBD,总接口的连接顺序为 acbde(或ed)bcf。
(2)与分液漏斗相比,恒压滴液漏斗可以平衡气压,便于液体流下;氯气溶于水,几乎不溶于饱和食盐水,则可利用分液漏斗中的饱和食盐水将装置D的氯气排出,与二氧化硫在装置C中反应。
(3)干燥管中盛有的试剂为碱石灰,氰气和二氧化硫都有毒,排入空气会造成环境污染,且装置C中产生的硫酰氯在潮湿空气中易“发烟”,所以要用碱石灰吸收氯气和二氧化硫,防止污染环境,防止空气中的水分进入装置C;由题意可知,硫酰氯在潮湿空气中易“发烟”的原因是硫酰氯与水反应生成三氧化硫和氯化氢,反应的化学方程式为。
(4)由于硫酰氯常温下为无色液体,熔点为-54.1℃,沸点为69.1℃,100℃以上开始分解,生成二氧化硫和氯气,因此为提高本实验中硫酰氯的产率,在实验操作中需要注意的事项有①先通冷凝水,再通气,②控制气流速率,宜慢不宜快,③若三颈烧瓶发烫,可适当降温,但不能加热三颈烧瓶,否则会加速硫酰氯的分解。
(5)反应结束后,装置C中有活性炭和硫酰氯,硫酰氯常温下为无色液体,可以用过滤的方法分离;生成硫酰氯的方程式为,氯气的物质的量为,由方程式可知,故理论上生成的质量为0.01ml×135 g/ml=1.35 g,故硫酰氯的产率为。
(6)若C中1.35 g活性炭吸收了水分,氯气和二氧化硫在水中发生氧化还原反应生成硫酸和盐酸,反应的离子方程式为 。
3.答案:(1)易升华,遇冷会凝华而易堵塞导管使装置炸裂
(2)检验装置气密性
(3)不能,升华后产生的气体也为黄色,也能使装置B中溶液变蓝
(4)①在装置A、B间添加冷凝装置
②
③在开始加热A装置前通入一段时间排尽装置内空气
(5)
解析:
4.答案:(1)蒸馏烧瓶;增大接触面积,加快反应速率和原料的转化率;水浴加热
(2);
(3)
(4)B(5)提高的利用率(答案合理即可)
解析:
5.答案:(1)①
(2)①硫酸();关闭,打开;②偏大;③偏大;④;
⑤将装置内的氨气全部带入装置D中,被完全吸收; = 6 \* GB3 \* MERGEFORMAT ⑥×100%
解析:
6.答案:(1)排出装置内的空气(氧气和二氧化碳),防止生成的被氧化,同时减小装置E的测量误差;E
(2)
(3)除去并检验是否除尽
(4)偏低;取最后一次洗涤液少许于试管中,向其中加入稀盐酸酸化的溶液,观察是否有白色沉淀生成,若有,则未洗涤干净,反之则洗涤干净
(5)4:5
(6)5;10或;AB
解析:(1)分析实验原理和装置可知,实验中要排出装置A中的氧化性气体,同时装置E吸收并测定其质量,故步骤Ⅱ中通入氮气的主要目的是排出装置中的空气(氧气和二氧化碳),需要称重的干燥管是E。
(2)由题意分析装置B中生成的黑色沉淀为CuS,则装置B中与溶液反应的物质为,装置A中与稀硫酸的反应方程式为。
(3)酸性高锰酸钾溶液具有强氧化性,可除去并检验是否除尽。
(4)过滤操作要迅速,否则产物中的易被空气中的氧气氧化,导致步骤Ⅵ中消耗的溶液体积偏小,从而求得的总量偏小,而E中测定的质量不变,则的量不变,所以测得的含量偏低。检验沉淀是否洗涤干净,应取最后一次洗涤液少许于试管中,向其中加入稀盐酸酸化的溶液,观察是否有白色沉淀生成,若有,则未洗涤干净,反之则洗涤干净。
(5)由题干信息知的质量为2.2g,物质的量为0.05ml,则的物质的量为
0.05ml,由离子方程式及消耗的的,可知100mL滤液中,因此,
。
(6)每个配体给中心原子提供一对电子,Fe原子含8个价电子,据题意知。Fe与CO形成5个配位键,配体CO与氮气分子互为等电子体,结构式为(含1个键),故1 ml 中含有键数目为10;为正四面体构型,属于非极性分子,根据相似相溶原理,能够溶解的是四氯化碳苯。
7.答案:(1)冷凝回流;;
(2)CCl3CHO+HClO→CCl3COOH+HCl;
(3)无干燥装置;氯气和水反应生成HCl和HClO,会进一步生成副产物(答副产物增加即给分);
(4)否;CCl3COOH溶于乙醇与CCl3CHO,无法分液;(5)73.75%
解析:
8.答案:(1)分液漏斗
(2)2 + 10Cl-+16H+=2Mn2+ +5Cl2↑+8H2O
(3)HCl和Si反应生成SiHCl3和H2,会使产品纯度降低;Cl2和H2混合共热易发生爆炸(写出一个即可)
(4)SiCl4在试剂瓶e中液化,压强减小,烧碱溶液倒吸入试剂瓶f中;烧碱溶液中水蒸气进入产品收集瓶,SiCl4发生水解(写出一个即可)
(5)3SiCl4+4NH3Si3N4+12HCl;c
(6)SiCl4+3H2O=H2SiO3↓+4HCl
解析:(1)区别分液漏斗、长颈漏斗、漏斗。装有浓盐酸的仪器是分液漏斗,以便于控制加入盐酸的量与速率。
(2)KMnO4与浓盐酸反应生成MnCl2、Cl2、KCl和H2O,化学方为2KMnO4 +16HCl=2KCl+2MnCl2 +SCl2↑+8H2O。
(3)依题意,HCl与Si反应生成SiHCl3和H2,H2和Cl2混合共热易发生爆炸。
(4)SiCl4在试剂瓶e中液化,压强减小,烧碱溶液倒吸入试剂瓶f中;NaOH溶液吸收尾气中的SiCl4和Cl2,水蒸气进入产品收集瓶,SiCl4发生水解反应。
(5)SiCl4与NH3反应生成Si3N4和HCl。收集HCl制备盐酸,要防倒吸,选c。
(6)SiCl4遇水剧烈水解生成硅酸,该反应的化学方程式为SiCl4+3H2O=H2SiO3↓+4HCl。
实验操作
现象
点燃酒精喷灯,加热
加热一段时间后,装置A中产生黄色气体,装置B中溶液变蓝
相对分子质量
熔点/℃
沸点/℃
溶解性
C2H5OH
46
-114.1
78.3
与水互溶
CCl3CHO
147.5
-57.5
97.8
可溶于水、乙醇
CCl3COOH
163.5
58
198
可溶于水、乙醇、三氯乙醛
C2H5Cl
64.5
-138.7
12.3
微溶于水,可溶于乙醇
2021年高考化学非选择题突破训练——物质结构与性质(2)(有答案): 这是一份2021年高考化学非选择题突破训练——物质结构与性质(2)(有答案),共15页。试卷主要包含了填空题等内容,欢迎下载使用。
2021年高考化学非选择题突破训练——化学反应原理综合(2)(有答案): 这是一份2021年高考化学非选择题突破训练——化学反应原理综合(2)(有答案),共20页。试卷主要包含了填空题,问答题等内容,欢迎下载使用。
2021年高考化学非选择题突破训练——有机化学基础(1)(有答案): 这是一份2021年高考化学非选择题突破训练——有机化学基础(1)(有答案),共17页。试卷主要包含了填空题等内容,欢迎下载使用。












