
所属成套资源:2021年高考化学非选择题突破训练(工艺流程、物质结构与性质、有机化学、化学反应原理)
2021年高考化学非选择题突破训练——工艺流程分析(1)(有答案)
展开这是一份2021年高考化学非选择题突破训练——工艺流程分析(1)(有答案),共12页。试卷主要包含了填空题,问答题等内容,欢迎下载使用。
2021年高考化学非选择题突破训练——工艺流程分析(1)
一、填空题
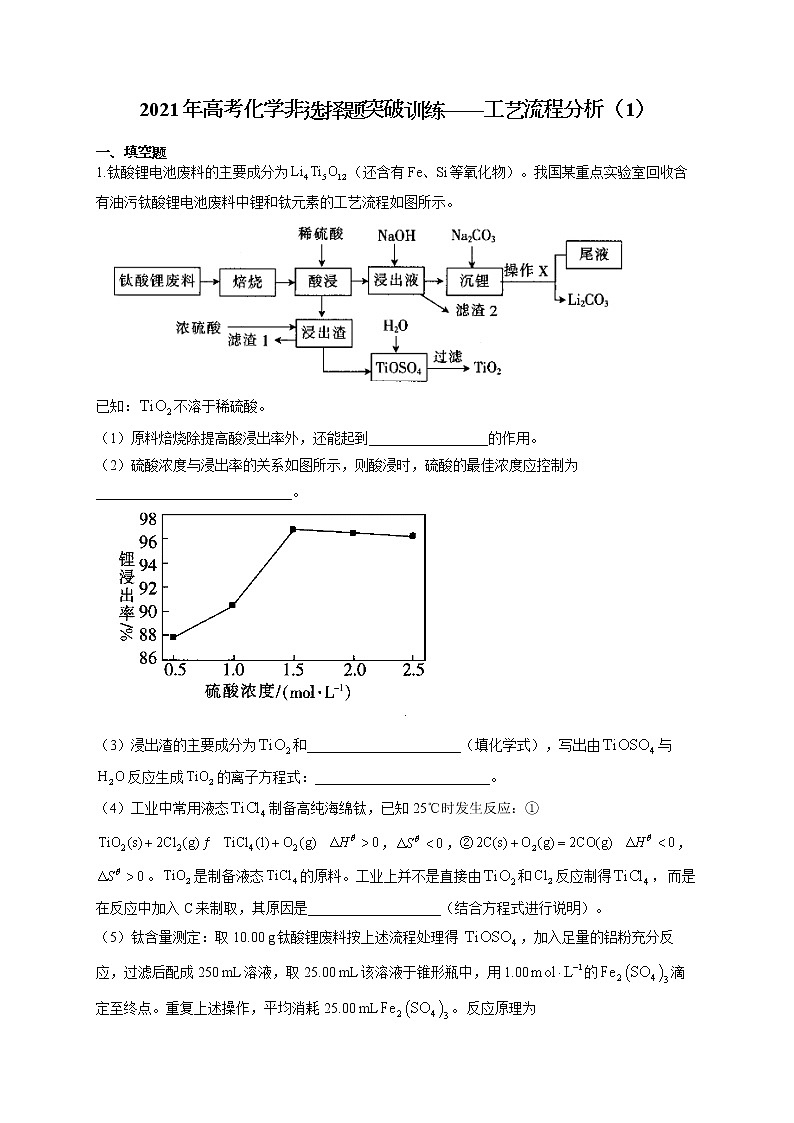
1.钛酸锂电池废料的主要成分为(还含有Fe、Si等氧化物)。我国某重点实验室回收含有油污钛酸锂电池废料中锂和钛元素的工艺流程如图所示。
已知:不溶于稀硫酸。
(1)原料焙烧除提高酸浸出率外,还能起到_________________的作用。
(2)硫酸浓度与浸出率的关系如图所示,则酸浸时,硫酸的最佳浓度应控制为____________________________。
(3)浸出渣的主要成分为和______________________(填化学式),写出由与反应生成的离子方程式:_________________________。
(4)工业中常用液态制备高纯海绵钛,已知25℃时发生反应:①,,②,。是制备液态的原料。工业上并不是直接由和反应制得,而是在反应中加入C来制取,其原因是___________________(结合方程式进行说明)。
(5)钛含量测定:取10.00 g钛酸锂废料按上述流程处理得 ,加入足量的铝粉充分反应,过滤后配成250 mL溶液,取25.00 mL该溶液于锥形瓶中,用1.00的滴定至终点。重复上述操作,平均消耗25.00 mL。反应原理为,,滴定过程中用__________________作指示剂,如果不在隔绝空气的条件下滴定,则测定结果可能___________________(填“偏高”“偏低”或“不变”),废料中钛元素的质量分数为____________________。
2.某种利用废旧可充电电池回收Ni、Cd、Co的新工艺如图所示。
已知:①烧渣的主要成分为NiO、CdO、CoO、;
②浸取液中主要含有、、和;
③可逆过程的平衡常数,。
回答下列问题:
(1)“焙烧”的目的为____________________________。
(2)“预处理”需要合适的条件,向含量为的溶液中通入空气,待反应完全后,记录不同条件下浓度随各条件变化的关系(如图所示),由图中数据可得,被氧化的最佳条件为___________________________。
(3)“转化”过程的离子方程式为______________________,若用浓盐酸进行“转化”,不足之处是________________________________________。
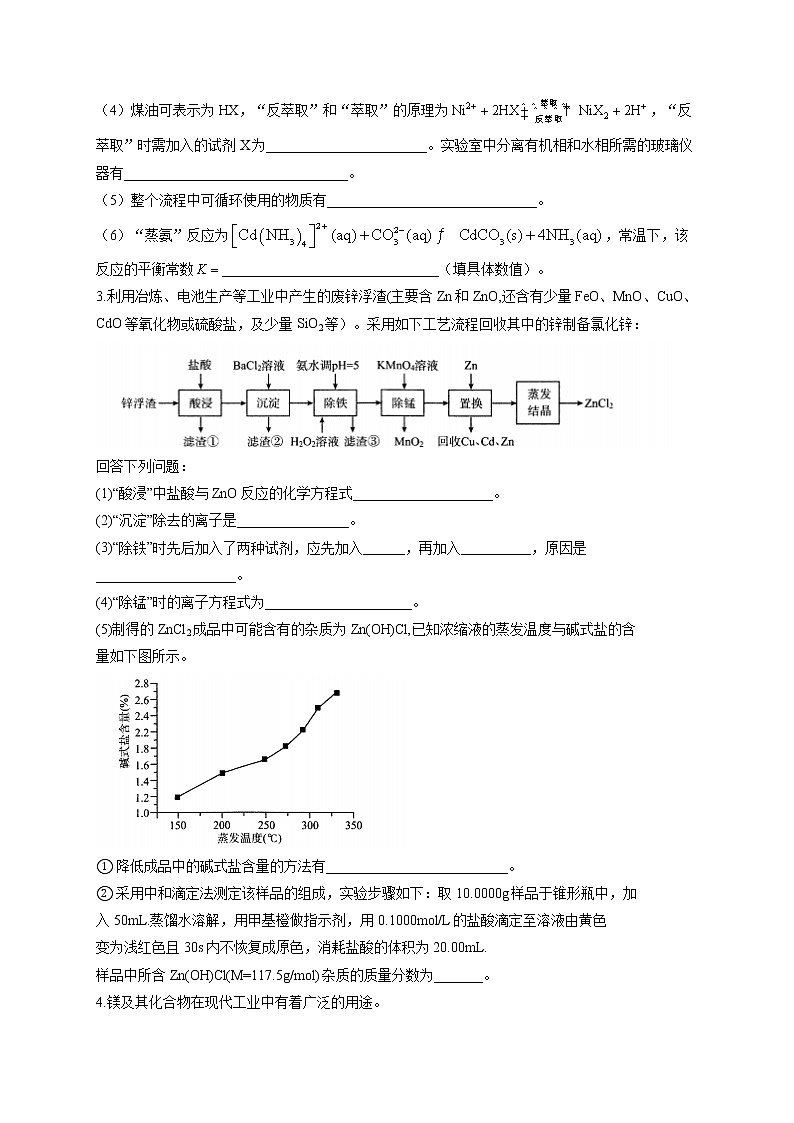
(4)煤油可表示为HX,“反萃取”和“萃取”的原理为,“反萃取”时需加入的试剂X为_______________________。实验室中分离有机相和水相所需的玻璃仪器有________________________________。
(5)整个流程中可循环使用的物质有______________________________。
(6)“蒸氨”反应为,常温下,该反应的平衡常数_______________________________(填具体数值)。
3.利用冶炼、电池生产等工业中产生的废锌浮渣(主要含Zn和ZnO,还含有少量FeO、MnO、CuO、CdO等氧化物或硫酸盐,及少量SiO2等)。采用如下工艺流程回收其中的锌制备氯化锌:
回答下列问题:
(1)“酸浸”中盐酸与ZnO反应的化学方程式____________________。
(2)“沉淀”除去的离子是________________。
(3)“除铁”时先后加入了两种试剂,应先加入______,再加入__________,原因是____________________。
(4)“除锰”时的离子方程式为_____________________。
(5)制得的ZnCl2成品中可能含有的杂质为Zn(OH)Cl,已知浓缩液的蒸发温度与碱式盐的含
量如下图所示。
① 降低成品中的碱式盐含量的方法有__________________________。
② 采用中和滴定法测定该样品的组成,实验步骤如下:取10.0000g样品于锥形瓶中,加
入50mL.蒸馏水溶解,用甲基橙做指示剂,用0.1000mol/L的盐酸滴定至溶液由黄色
变为浅红色且30s内不恢复成原色,消耗盐酸的体积为20.00mL.
样品中所含Zn(OH)Cl(M=117.5g/mol)杂质的质量分数为_______。
4.镁及其化合物在现代工业中有着广泛的用途。
(1)镁被称为国防金属,在真空、高温条件下用焦炭还原MgO可得到Mg,写出该反应的化学方程式____________________________。
(2)硝酸镁可用作生产浓硝酸的吸水剂,也可用作预防小麦灰化病的试剂。某化厂利用工业废料(主要成分为MgO、、及少量、FeO)生产硝酸镁的工艺流程如下图所示:
已知几种金属开始沉淀及沉淀完全时的pH如下表所示:
氢氧化物 | |||
开始沉淀时pH | 9.3 | 2.7 | 3.7 |
沉淀完全时pH | 11 | 3.7 | 4.7(pH=7.8时开始溶解) |
①渣沉Ⅰ中一定含有的物质是______________________;首次用NaOH溶液调pH时,pH的调整最大范围为____________________________。
②试剂A的主要成分是_____________________(填化学式),操作a的内容是__________________、洗涤、干燥。
③酸浸时会发生多种反应,写出有电子转移的反应的离子方程式______________________;若不通入氧气,同样可发生氧化还原反应,但通入氧气的好处是_____________________。
(3)分别将含有0.1 mol 、的两种溶液蒸干并灼烧,发现所得固体的质量前者约为后者的,则最可能的原因是____________________________。
5.目前锂电池的应用日益广泛,而废旧锂电池的回收利用是十分重要的课题。回收利用废旧锂电池的流程如下:
已知:①锂电池废料的主要成分是LiCoO2、铝、炭黑及其他杂质。
②“溶液A”中主要金属离子是Co2+、Li+,还含有少量Fe3+、Al3+、Cu2+。
请回答:
(1)步骤Ⅰ中铝溶解的离子方程式为________________;步骤Ⅲ的主要目的是将Co(Ⅲ)转化为________.
(2)关于步骤Ⅱ,下列实验操作或说法合理的是( )
A.灼烧前,灼烧使用的蒸发皿洗净后不需要擦干,然后加入固体X进行灼烧
B.灼烧时需要用玻璃棒不断搅拌
C.灼烧至恒重是指前后两次称量所得质量之差不得超过一定的允许误差,这个允许误差一定为0.01g
D.在电解熔融的Al2O3制备金属铝时,通常需加入冰晶石(NaAlF6)以增强其导电性
(3)步骤Ⅳ中除杂时可加入氨水调节溶液的pH,实验表明溶液A中各种金属离子的沉淀率随pH的变化如下图所示,则步骤Ⅳ中可除去的杂质离子是________。
(4)步骤Ⅴ可采用酸碱滴定法测定碳酸锂的纯度。滴定原理如下:碳酸锂能够与盐酸反应生成氯化锂和二氧化碳,在碳酸锂未完全反应时,溶液保持中性(pH=7)。反应完全后,随着盐酸的继续滴入,溶液pH下降,以甲基红(变色范围4.4-6.2)-溴甲粉绿为指示剂,用盐酸标准液滴定试样,用消耗盐酸标准滴定溶液的量来计算碳酸锂的含量。
①配制约0.30mol·L-1盐酸溶液不需要用到的仪器有______(填编号)
a.量筒 b.电子天平 c.漏斗 d.烧杯 e.容量瓶 f.玻璃棒 g.胶头滴管
②碳酸锂的纯度可用下式计算:
其中:ω-碳酸锂试样的纯度;m-碳酸锂试样的质量(g);
c-盐酸标准液的浓度(mol·L-1);
V1-试样滴定时消耗盐酸的体积(mL);
V0-滴定空白溶液(指不加试样进行滴定)时标准盐酸消耗的体积(mL);
0.03694-与1.00mL标准盐酸(c=1.000mol·L-1);相当的碳酸锂的质量(g);
滴定空白溶液的目的是_______________________。
上述滴定操作中,缺少“煮沸去除CO2,再冷却到室温”这个步骤,测定结果将______(填“偏大”、“偏小”、“无影响”)。
6.三氧化二镍(Ni2O3)是重要的电子元件材料和蓄电池材料,工业上利用含镍废料(主要成分为镍、铝、氧化铁、碳等)提取Ni2O3,工业流程如下:
已知:① NiCl2易溶于水,Fe3+不能氧化Ni2+。
② 已知实验温度时的溶解度:NiC2O4>NiC2O4·H2O>NiC2O4·2H2O
③ Ksp[Al(OH)3]=1.9×10-23 Ksp[Fe(OH)3]=4.0×10-38
Ksp[Ni(OH)2]=1.6×10-14 Ksp(NiC2O4)=1.0×10-9
回答下列问题:
(1)“预处理”操作可以选择用____(填标号)来除去废旧镍电池表面的矿物油污。
A.纯碱溶液浸泡 B.NaOH溶液浸泡C.酒精清洗
(2)酸浸时:
① 镍的浸出率与温度的关系如下图所示,温度高于40℃ 时镍的浸出率开始下降,主要原因可能是________________________(从两个角度分析)
② 常温下,盐酸的浓度为2.5mol/L,液固比与镍的浸出率的关系如表所示,
液固比 | 7:1 | 6:1 | 5:1 |
镍的浸出率/% | 95.63 | 95.32 | 89.68 |
实际生产采取的液固比为_____,主要原因是____________________。
(3)室温下,“浸出”所得溶液中Fe3+的浓度为0.2mol·L-1,当溶液的pH从1调到2时,沉铁率为_______。
(4)证明“沉镍”中,Ni2+已经沉淀完全的实验步骤及现象为:____________________。
(5)写出加入Na2C2O4溶液的反应的化学方程式:____________________。
(6)电解过程产生的氯气在弱碱条件下生成了ClO-,再把二价镍氧化为三价镍,写出“氧化”反应的离子方程式:____________________。
7.钛及其合金在工业、医疗、军事领域有着非常重要的用途。我国含钛主要矿物为钛铁矿(主要成分为 ,可表示为),一种由钛铁矿制备金属钛和绿矾的工艺流程如下:
请回答下列问题:
(1)钛铁矿中铁元素的化合价为___________________________。
(2)向滤液Ⅰ中加入金属X的目的是,晶体Y的化学式为________________________________。
(3)浓硫酸溶解钛铁矿后,钛主要以形式存在,滤液Ⅲ中 水解生成偏钛酸
,化学方程式为_______________________,该反应完成后过滤,可将滤液中的另一种产物用于该工艺流程中的________________________步骤循环使用。
(4)写出由生成反应的化学方程式:__________________________。
(5)若处理吨钛铁矿,制得吨钛,则该钛铁矿中 的质量分数为___________________________(用含和的代数式表示)。
二、问答题
8.钻可用于火箭发动机、导弹的耐热部件以及原子能工业。下图是由铜钴精矿提取钴的相关工业流程。铜钴精矿中主要含氧化铜、硫化钴(CoS)和少量FeS等。
已知:在pH为4~6时Fe3+水解生成胶体,具有吸附性。
(1)从“氨浸”可知,Cu2+、 Fe2+、Co2+三者中易于形成氨合物的离子是______ ;含
的溶液“电解”阴极反应式为_______________。
(2) “酸浸”中硫化钴(CoS) 、Na2SO3与盐酸共同反应的离子方程式为____________。
(3)“除铁”加入了试剂X,使Fe2+转化为Fe3+,则试剂X最好选用____ ( 填字母编号)。
A. KMnO4 溶液 B. H2O2 溶液 C. HNO3 D. SO2
(4)“ 萃取”是利用某磷酸酯P50 (用RH表示)萃取钴,其反应的离子方程式为_______。
(5)整个流程中可以循环利用的物质有______________。
(6)"除铁”中,溶液pH对钴回收影响密切,如下图所示该步应控制pH范围为_________,
pH较大时钴回收率骤降的原因是_____________。(已知Co2+沉淀的pH为6.7~8.7)。
参考答案
1.答案:(1)除去油污
(2)
(3);
(4)由25℃时,,,可知,反应不可能自发进行,而反应,可自发进行,往和反应体系中加入C可以起到减焓增熵的效果,促使反应正向进行
(5)KSCN溶液;偏低;24.00%
解析: (1)钛酸锂受热分解为和的同时油污燃烧生成气体除去。
(2)由图像可知,随着硫酸浓度的增大,金属元素的浸出率先增大后减小,硫酸的最佳浓度应控制为。
(3)和不溶于稀硫酸,故浸出渣中含有和,滤渣1为;的水解方程式为。
(4)25℃时,,无论怎么改变温度都大于零,反应不可能自发进行;由于反应,往和反应体系中加入C可以起到减焓增熵的效果,导致反应更容易正向进行,故需要在和反应体系中加入C。
(5)通过铁离子的反应消耗确定终点,选择KSCN溶液;生成的亚铁离子易被空气中的氧气氧化为铁离子,铁离子又会氧化三价钛离子,相当于一部分三价钛离子被氧气氧化,从而降低了标准液的用量,导致测得钛含量偏低;废料中钛元素的质量分数为。
2.答案:(1)使废旧电池中的金属元素转化为易浸取的氧化物
(2)2.5h、95℃石墨催化
(3);产生,污染环境
(4);分液漏斗、烧杯
(5)、含LIX的煤油
(6)
解析:(1)工艺流程原料常需要“焙烧”来除去一些可燃烧的物质,或将金属元素转化为易溶于酸或碱的氧化物。
(2)由图像可知使用石墨催化,在95℃条件下,随着时间推移,得到+3价的含钴微粒浓度较大,在2.5h便接近氧化完全。
(3)根据Co的化合价变化情况,可知此时作还原剂,根据电子得失守恒与原子守恒,可写出该反应的离子方程式:;若用浓盐酸代替、酸浸,浓盐酸作还原剂,氧化产物为,会污染环境。
(4)由“萃取”与“反萃取”的原理可知,实现“反萃取”可加入酸,而水相中最终得到产品,则应加入;分离有机相和水相需要进行分液,分液所需的玻璃仪器有分液漏斗、烧杯。
(5)有机相中煤油作萃取剂可回收使用,“蒸氨”过程产生,故可循环使用的物质有、含LIX的煤油。
(6)由信息“可逆过程的平衡常数,”可知,,。反应的。
3.答案:(1)(2)
(3)溶液;氨水调节pH=5;避免离子沉淀不完全,或精准控制溶液pH(答案合理均可)
(4)
(5)①蒸发溶液产生大量气泡时,加入一定量的盐酸;加热蒸发时控制浓缩液温度不要太高;②2.35%
解析:
4.答案:(1)
(2)①;4.7≤pH<78
②;蒸发结晶、过滤
③;不会产生有害气体,节省硝酸用量
(3)先完全水解生成,然后分解为MgO,而属于难挥发性酸的盐,最终所得固体仍为(其他合理说法也给分)
解析:(1)由于高温下过量的焦炭能与反应,故MgO与焦炭反应的生成物是Mg与CO。
(2)不与硝酸反应,渣沉Ⅰ中含有。用NaOH调pH的目的是使、转化为、沉淀除去,故pH的调节范围为4.7≤pH<7.8。从溶液中得到硝酸镁的方法是蒸发结晶,然后过滤洗涤、干燥。酸浸时,空气中的氧气将FeO氧化为,若没有空气,硝酸直接氧化FeO时会产生有害的氮氧化物,同时也会导致硝酸用量增加。
(3)是易挥发性酸的弱碱盐,可水解完全生成,在加热条件下不稳定,继续分解为4 g的MgO; 属于难挥发性酸的盐,不能水解完全,最终得到的固体是,约为12 g。
5.答案:(1);(2)B
(3)(4)bc;消除滴定误差;偏小
解析:(1)步骤Ⅰ中,铝与氢氧化钠反应生成偏铝酸钠,离子方程式为。
步骤Ⅲ中,反应物有LiCoO2、双氧水、硫酸,生成物有Li2SO4和CoSO4,LiCoO2中Co化合价降低,则H2O2化合价升高生成O2,所以化学方程式为.
(2)步骤Ⅱ将氢氧化铝,灼烧、电解后得到铝,
A.蒸发皿一般用于蒸发溶液,氢氧化铝为固体,一般用坩埚灼烧,A错误;
B.灼烧时需要用玻璃棒不断搅拌,避免局部过热,引起蹦溅,B正确;
C.在重量分析法中,经烘干或灼烧的坩埚或沉淀,前后两次称重之差小于0.2mg,C错误;
D.在电解熔融的Al2O3制备金属铝时,通常需加入冰晶石(NaAlF6),目的是降低氧化铝的熔点,D错误。
(3)如图可知pH<5.0时,Co2+不生成沉淀,而Fe3+、Al3+易生成沉淀而除去,所以可除去的杂质离子是Fe3+、Al3+。
(4)①配制约0.30mol•L-1盐酸溶液需要的仪器有量筒、烧杯、容量瓶、玻璃棒、胶头滴管,则不需要用到的仪器有bc;②滴定空白溶液的目的是消除实验中的试剂、操作等综合因素造成的滴定误差;上述滴定操作中,如缺少煮沸去除CO2,则CO2溶于水使溶液呈酸性,所加盐酸体积偏少,所以测定结果将偏小。
6.答案:(1)C(2)①温度升高导致盐酸挥发,导致反应物浓度降低;温度升高促进镍离子水解,浸出率降低
②6:1;三种液固比中5:1的浸出率最低且与其它两种相差较大,不考虑,液固比为7:1和6:1的浸出率都较高且相差不多,但考虑到液体即盐酸成本,会优先考虑液体用量较小的方式,即液固比为6:1。(3)80%
(4)静置取上层清液滴加适量溶液,若无沉淀生成,则说明已经沉淀完全
(5)
(6)
解析:
7.答案:(1)+2
(2)将还原为;
(3) ;酸溶
(4)
(5)
解析: (1)据化学式可判断铁元素为+2价。
(2)据题给流程可知,酸溶过程中可能被氧化为,晶体Y为绿矾,所以加入的金属X为铁,将还原为。
(3)据题给流程可知, 可溶于水,加热水解生成偏钛酸,Ti元素化合价不变,反应的化学方程式为,生成的可返回至酸溶步骤循环使用。
(4)据题给流程可知,与、焦炭在高温下反应生成,反应的化学方程式为。
(5)据关系式,制得吨钛,需要吨=吨,则钛铁矿中含的质量分数为。
8.答案:(1)
(2)
(3)B
(4)
(5)和
(6)3~4;在pH大于4水解生成胶体吸附大量钴而损失
相关试卷
这是一份2021年高考化学非选择题突破训练——化学反应原理综合(2)(有答案),共20页。试卷主要包含了填空题,问答题等内容,欢迎下载使用。
这是一份2021年高考化学非选择题突破训练——有机化学基础(1)(有答案),共17页。试卷主要包含了填空题等内容,欢迎下载使用。
这是一份2021年高考化学非选择题突破训练——工艺流程分析(2)(有答案),共16页。试卷主要包含了填空题等内容,欢迎下载使用。












