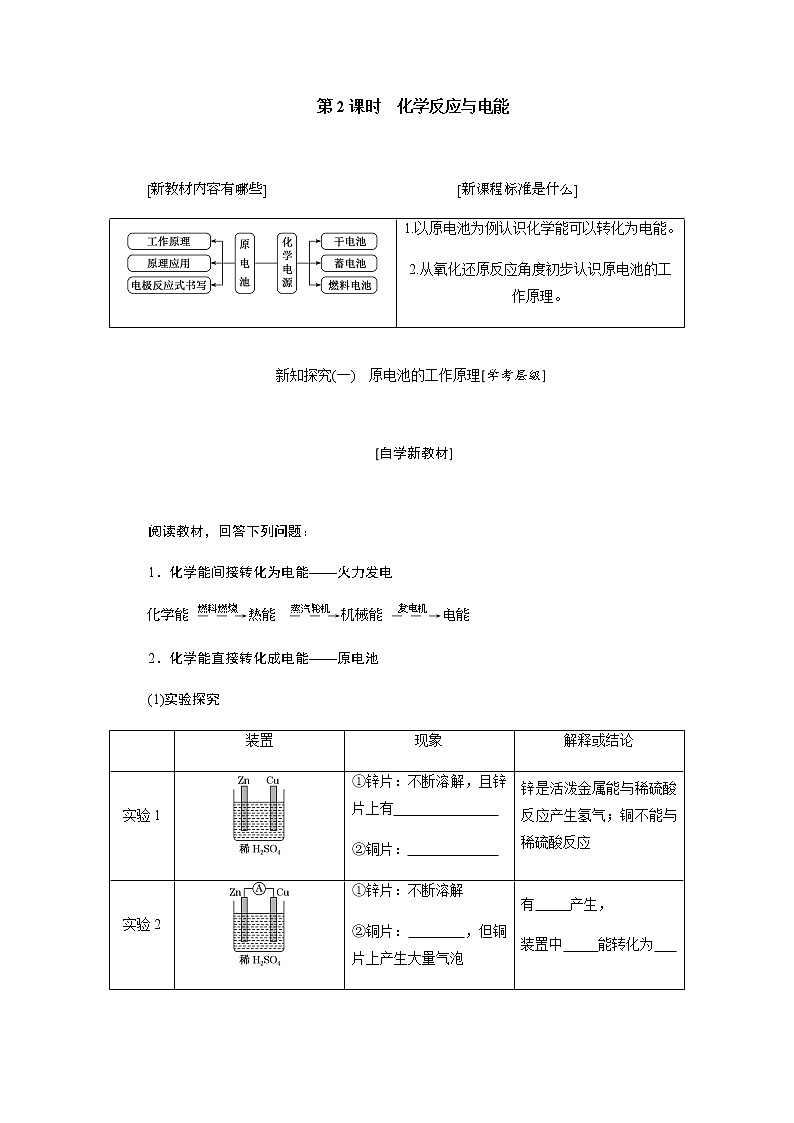

人教版 (2019)必修 第二册第一节 化学反应与能量变化第2课时教案设计
展开eq \a\vs4\al([新教材内容有哪些]) eq \a\vs4\al([新课程标准是什么])
新知探究(一) 原电池的工作原理[学考层级]
[自学新教材]
阅读教材,回答下列问题:
1.化学能间接转化为电能——火力发电
eq \a\vs4\al(化学能)eq \(――→,\s\up7(燃料燃烧))eq \a\vs4\al(热能)eq \(――→,\s\up7(蒸汽轮机))eq \a\vs4\al(机械能)eq \(――→,\s\up7(发电机))eq \a\vs4\al(电能)
2.化学能直接转化成电能——原电池
(1)实验探究
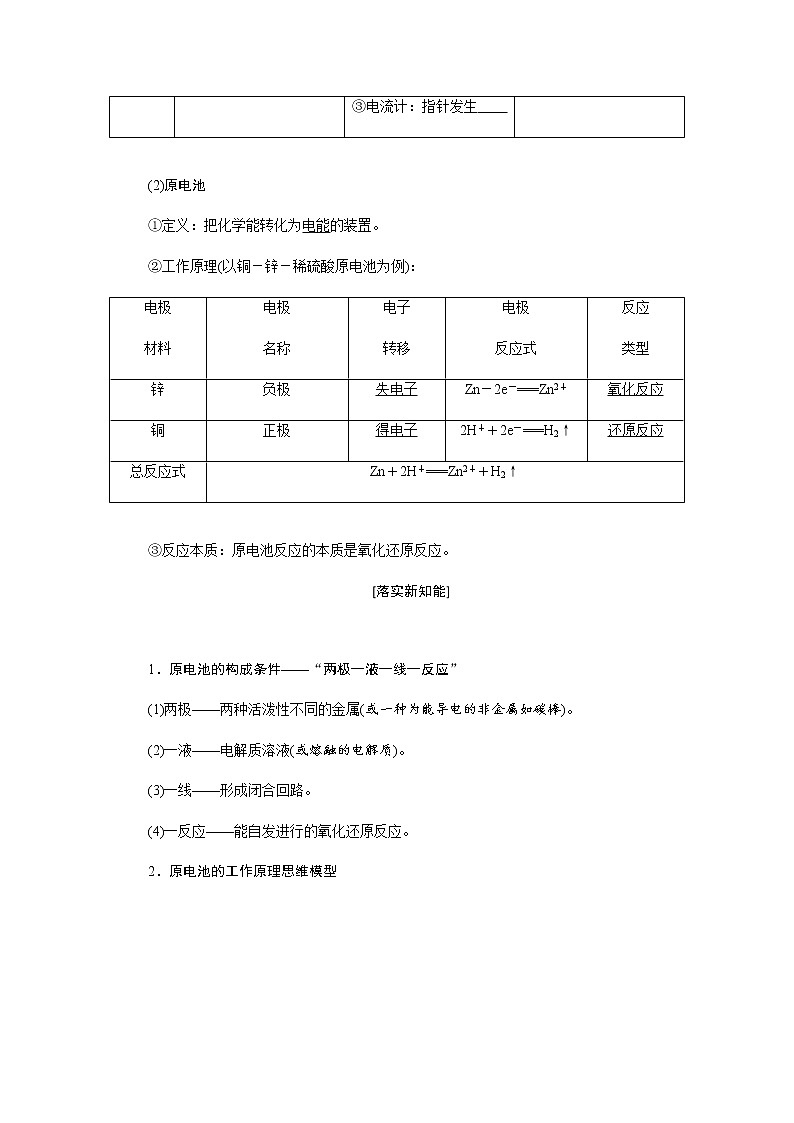
(2)原电池
①定义:把化学能转化为电能的装置。
②工作原理(以铜-锌-稀硫酸原电池为例):
③反应本质:原电池反应的本质是氧化还原反应。
[落实新知能]
1.原电池的构成条件——“两极一液一线一反应”
(1)两极——两种活泼性不同的金属(或一种为能导电的非金属如碳棒)。
(2)一液——电解质溶液(或熔融的电解质)。
(3)一线——形成闭合回路。
(4)一反应——能自发进行的氧化还原反应。
2.原电池的工作原理思维模型
(1)电子的移动方向:从负极流出,经导线流向正极。
(2)离子的移动方向:阳离子向正极移动,阴离子向负极移动。
[注意] ①电子只能在导线中定向移动,离子只能在电解质溶液或熔融电解质中定向移动。(简记为:电子不下水,离子不上岸)
②负极区失电子带正电,所以带负电的阴离子移向负极,电子流向正极后正极带负电,所以溶液中带正电的阳离子移向正极。(简记为:负负、正正)
3.原电池正负极的判断方法
[演练新学考]
1.如图所示,把锌片和铜片用导线相连后插入稀硫酸溶液构成原电池。下列叙述正确的是( )
A.Zn是负极,发生还原反应
B.电流从锌片流向铜片
C.一段时间后,铜片质量减轻
D.该装置将化学能转变为电能
2.如图所示的装置中,M为活动性顺序位于氢之前的金属,N为石墨棒。下列关于此装置的叙述中,不正确的是( )
A.N上有气体放出
B.M为负极,N为正极
C.是化学能转变为电能的装置
D.导线中有电流通过,电流方向由M到N
3.(1)下列装置属于原电池的是________。
(2)在选出的原电池中,________是负极,发生________反应,________是正极,该极的现象是________________________________________________________________________。
(3)此原电池反应的化学方程式为___________________________________________。
新知探究(二) 化学电源[学考层级]
[自学新教材]
1.干电池
(1)构造示意图
(2)工作原理和正负极
作负极,发生氧化反应, 作正极, 不断被还原,电子由 流向 。
(3)特点
①一次电池,放电后 充电。
②便于携带,价格低。
2.蓄电池
(1)特点:又称 电池,它在放电时进行氧化还原反应,在充电时可以逆向进行,使电池恢复到放电前的状态。
(2)实例: 、镍氢电池、 等。目前汽车上使用的多数是 。手机、笔记本计算机、照相机和摄像机等电器所用的电池多数为 。
3.燃料电池
如图是氢氧燃料电池结构示意图,结合图示思考什么是燃料电池,其有什么特点:
(1)概念:一种将 (如氢气、甲烷、乙醇)与 (如氧气)的化学能直接转化为电能的电化学反应装置。
(2)特点:
①电极反应物不是储存在电池内部,从外部提供,同时将电极反应产物不断排出电池。
②具有清洁、安全、能量转化率高、供电量易于调节,能适应用电器负载的变化等特点。
(3)常见燃料电池:氢氧燃料电池、甲烷燃料电池等。
几种电池的特点比较
[演练新学考]
1.下列有关电池的叙述正确的是( )
A.水果电池是高效环保的家用电池
B.锌锰干电池是一种常用的二次电池
C.锌锰干电池中碳棒是负极,锌是正极
D.锌锰干电池工作一段时间后锌外壳逐渐变薄
2.下列电池不属于二次电池的是( )
3.氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图所示。下列有关氢氧燃料电池的说法,正确的是( )
A.该电池工作时电能转化为化学能
B.该电池中电极a是正极
C.外电路中电子由电极b通过导线流向电极a
D.该电池的总反应:2H2+O2===2H2O
新知探究(三) 原电池原理的应用[选考层级]
[难度增一点]
[典例] 有a、b、c、d四个金属电极,有关的实验装置及部分实验现象如下:
由此可判断这四种金属的活动性顺序是( )
A.a>b>c>d B.b>c>d>a
C.d>a>b>c D.a>b>d>c
[知能深一点]
1.原电池原理的应用
(1)比较金属活动性
作负极的金属活动性强,作正极的金属活动性弱。
(2)改变化学反应速率
如:在Zn和稀硫酸反应时,滴加少量CuSO4溶液,则Zn置换出的铜和锌能构成原电池的正、负极,从而加快Zn与稀硫酸反应的速率。
(3)设计原电池
如:把Fe+2Fe3+===3Fe2+设计成原电池,可用Fe作负极,铜(或石墨)作正极,FeCl3溶液作电解质溶液。
(4)保护金属设备
如:船体是钢铁材料,在海水中易被腐蚀,在船体外壳焊接上比铁活泼的金属(如Zn),则构成以Zn、Fe为电极的原电池,Zn被消耗掉而Fe得到保护。
2.设计原电池的一般思路
(1)将已知氧化还原反应拆分成两个半反应
氧化反应:还原剂-ne-===氧化产物
还原反应:氧化剂+ne-===还原产物
正极反应式+负极反应式===电池总反应式
(2)根据总反应式并结合两个半反应,找出正、负极材料及电解质溶液。
①电极材料的选择:选活泼性较强的金属作负极,活泼性较弱的金属或能导电的惰性材料作正极。
②电解质溶液的选择:电解质溶液一般要能与负极发生反应,可参照总反应式选择电解质溶液。
[选考难一点]
1.100 mL 2 ml·L-1的盐酸与过量的锌反应,为加快速率,又不影响产生氢气的总量,可采用的方法是( )
A.加入适量的6 ml·L-1的盐酸
B.加入数滴氯化铜溶液
C.加入适量的蒸馏水
D.加入适量的氯化钠溶液
2.如图所示装置,电流表指针发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的( )
A.A是Zn,B是Cu,C为稀硫酸
B.A是Cu,B是Zn,C为稀硫酸
C.A是Fe,B是Ag,C为稀AgNO3溶液
D.A是Ag,B是Fe,C为稀AgNO3溶液
3.利用反应Zn+CuSO4===Cu+ZnSO4,设计一个原电池。
(1)选用______为负极材料,_______为正极材料,电解质溶液为________。
(2)写出电极反应式:负极________________,正极___________________________。
(3)试画出上述装置图。
新知探究(四) 化学电源 电极反应式的书写[选考层级]
[难度增一点]
[典例1] 铅酸蓄电池是化学电源,其电极材料分别是Pb和PbO2,电解液为稀硫酸。工作时该电池总反应式为Pb+PbO2+2H2SO4===2PbSO4+2H2O。根据上述情况判断:
(1)工作时,电解质溶液的pH________(填“增大”“减小”或“不变”)。
(2)工作时,电解质溶液中的阴离子移向________极。
(3)电流方向从______极流向______极。
(4)写出负极的电极反应式:___________________________________________________。
(5)当铅酸蓄电池向外电路提供1 ml电子时,理论上负极板的质量增加________g。
[典例2] 如图所示,可形成氢氧燃料电池。通常氢氧燃料电池有酸式(当电解质溶液为硫酸时)和碱式[当电解质溶液为NaOH(aq)或KOH(aq)时]两种。
试回答下列问题:
(1)酸式电池的电极反应:负极:_______________________________________________,
正极:__________________________________________________________;
电池总反应:___________________________________________________;
电解质溶液pH的变化为________(填“变大”“变小”或“不变”)。
(2)碱式电池的电极反应:负极:_______________________________________________,
正极:_______________________________________________________________;
电池总反应:______________________________________________________;
电解质溶液pH的变化为__________(填“变大”“变小”或“不变”)。
[知能深一点]
常见化学电源电极反应式
1.普通锌锰干电池
负极:Zn-2e-===Zn2+
正极:2MnO2+2NHeq \\al(+,4)+2e-===Mn2O3+2NH3+H2O
总反应:Zn+2MnO2+2NHeq \\al(+,4)===Zn2++Mn2O3+2NH3+H2O
2.铅酸蓄电池
负极(Pb):Pb+SOeq \\al(2-,4)-2e-===PbSO4
正极(PbO2):PbO2+4H++SOeq \\al(2-,4)+2e-===PbSO4+2H2O
总反应:Pb+PbO2+2H2SO4===2PbSO4+2H2O
3.氢氧燃料电池
[选考难一点]
1.汽车的启动电源常用铅酸蓄电池,放电时的电池反应如下:PbO2+Pb+2H2SO4===2PbSO4↓+2H2O,根据此反应判断下列叙述中正确的是( )
A.PbO2是电池的负极
B.负极反应式为Pb+SOeq \\al(2-,4)-2e-===PbSO4↓
C.PbO2得电子,被氧化
D.电池放电时,溶液酸性增强
2.一种燃料电池中发生的化学反应为酸性溶液中甲醇(CH3OH)与氧反应生成水和二氧化碳。该电池负极发生的反应是( )
A.CH3OH+O2-2e-===H2O+CO2+2H+
B.O2+4H++4e-===2H2O
C.CH3OH+H2O-6e-===CO2+6H+
D.O2+2H2O+4e-===4OH-
3.银锌电池是一种常见化学电源,其反应原理:Zn+Ag2O+H2O===Zn(OH)2+2Ag,其工作示意图如图。下列说法不正确的是( )
A.Zn电极是负极
B.Ag2O电极发生还原反应
C.Zn电极的电极反应式:Zn-2e-+2OH-===Zn(OH)2
D.放电前后电解质溶液的pH保持不变
eq \a\vs4\al([课时跟踪训练])
A级—学业水平考试达标练
1.下面是四个化学反应,你认为理论上不可用于设计原电池的化学反应是( )
A.2Al+2NaOH+2H2O===2NaAlO2+3H2↑
B.2H2+O2eq \(=====,\s\up7(点燃))2H2O
C.Mg3N2+6H2O===3Mg(OH)2+2NH3↑
D.CH4+2O2eq \(=====,\s\up7(点燃))CO2+2H2O
2.下列说法中正确的是( )
A.碱性锌锰电池是二次电池
B.铅酸蓄电池是一次电池
C.二次电池又叫蓄电池,它放电后可以再充电使活性物质获得再生
D.燃料电池的活性物质储存在电池内
3.如图所示各装置中,不能构成原电池的是(烧杯中所盛液体都是稀硫酸)( )
4.如图为某原电池的示意图,下列说法正确的是( )
A.铜片作负极
B.溶液的颜色逐渐变浅
C.电子由铜棒流出
D.锌片上发生还原反应
5.人造地球卫星用到的一种高能电池——银锌蓄电池,其电池的电极反应式为Zn+2OH--2e-===ZnO+H2O,Ag2O+H2O+2e-===2Ag+2OH-。据此判断氧化银是( )
A.负极,并被氧化 B.正极,并被还原
C.负极,并被还原 D.正极,并被氧化
6.将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的pH均增大
D.产生气泡的速率甲比乙慢
7.“盐水动力”玩具车的电池以镁片、活性炭为电极,向极板上滴加食盐水后电池便可工作,电池反应为2Mg+O2+2H2O===2Mg(OH)2。下列关于该电池的说法错误的是( )
A.镁片作为正极
B.食盐水作为电解质溶液
C.电池工作时镁片逐渐被消耗
D.电池工作时实现了化学能向电能的转化
8.最早使用的化学电池是锌锰电池,即大家熟悉的干电池,其结构如图所示。
尽管这种电池的历史悠久,但对于它的化学过程人们尚未完全了解。一般认为,放电时,电池中的反应如下:
E极:2MnO2+2e-+2NHeq \\al(+,4)===Mn2O3+H2O+2NH3↑
F极:Zn-2e-===Zn2+
总反应式:2MnO2+Zn+2NHeq \\al(+,4)===Mn2O3+Zn2++2NH3↑+H2O
下列说法正确的是( )
A.E极是电池的正极,发生的是氧化反应
B.F极是电池的负极,发生的是氧化反应
C.从结构上分析,锌锰电池应属于可充电电池
D.锌锰电池内部发生的氧化还原反应是可逆的
9.镍镉(Ni—Cd)可充电电池可以发生如下反应:Cd(OH)2+2Ni(OH)2eq \(,\s\up7(充电),\s\d5(放电))Cd+2NiO(OH)+2H2O,由此可知,该电池的负极材料是( )
A.Cd B.NiO(OH)
C.Cd(OH)2 D.Ni(OH)2
10.
在铜锌原电池中(如图),以硫酸铜为电解质溶液,锌为________极,电极上发生的是________(填“氧化”或“还原”)反应,电极反应式为________________________________________________________________________。
锌片上观察到的现象为___________________________________________;
铜为________极,电极上发生的是________(填“氧化”或“还原”)反应,电极反应式为________________________________________________________________________;
铜片上观察到的现象为______________________________________________________,
原电池总反应的离子方程式为________________________________________________。
11.某学习小组设计如图所示装置观察氧化还原反应中电子的转移。
(1)实验Ⅰ中,Fe与CuSO4溶液反应的离子方程式是____________________,负极反应式为________________________________________________________________________。
(2)根据实验Ⅰ的原理,推测实验Ⅱ中:锌片上发生____(填“氧化”或“还原”)反应;铜片上的实验现象是_________________________________________________________
________________________________________________________________________。
B级—选考等级考试增分练
1.将等质量的两份锌粉a、b分别加入过量的稀硫酸,同时向a中加入少量CuSO4溶液,产生H2的体积V(L)与时间t(min)的关系是( )
2.燃料电池是利用燃料(如H2、CO、CH4等)跟氧气或空气反应,将化学能转化为电能的装置。电解质溶液是强碱溶液。下列关于甲烷燃料电池说法中正确的为( )
A.负极反应:O2+2H2O+4e-===4OH-
B.随着放电进行,溶液的pH不变
C.负极的电极反应式为CH4+8OH--8e-===CO2+6H2O
D.放电时溶液中的OH-向负极移动
3.金属(M)-空气电池的工作原理如图所示。下列说法中不正确的是( )
A.金属M作电池负极
B.电解质是熔融的MO
C.正极的电极反应:O2+4e-+2H2O===4OH-
D.电池反应:2M+O2+2H2O===2M(OH)2
4.根据下列实验事实:①X+Y2+===X2++Y;②Z+2H2Oeq \(=====,\s\up7(冷))Z(OH)2+H2↑;③Z2+的氧化性比X2+弱;④由Y、W电极组成原电池,电极反应为W2++2e-===W,Y-2e-=== Y2+,可知X、Y、Z、W的还原性由强到弱的顺序是( )
A.X>Z>Y>W B.Z>W>X>Y
C.Z>X>Y>W D.Z>Y>X>W
5.人们应用原电池原理制作了多种电池以满足不同的需要,同时废弃的电池随便丢弃也会对环境造成污染。请回答下列问题:
(1)电子表和电子计算器中所用的是纽扣式微型银锌电池,其电极分别为Ag2O和Zn,电解质为KOH溶液,工作时电池总反应为Ag2O+Zn+H2O===2Ag+Zn(OH)2。
①工作时电流从_____极流向_____极(填“Ag2O”或“Zn”)。
②电极反应式:正极:_______________________________________________________,
负极:________________________________________________________________。
③工作时电池正极区的pH________(填“增大”“减小”或“不变”)。
(2)氢镍电池是近年来开发出来的可充电电池,它可以取代会产生镉污染的镉镍电池。氢镍电池的总反应式为eq \f(1,2)H2+NiO(OH)eq \(,\s\up7(放电),\s\d5(充电))Ni(OH)2。
电池放电时, 负极反应式为_______________,正极反应式为__________________, 正极附近溶液的pH ______(填“增大”“减小”或“不变”)。
6.为了探究原电池的工作原理,某化学学习小组设计了一组实验,其装置如图所示:
回答下列问题:
(1)根据原电池原理填写下表:
(2)电极类型除与电极材料的性质有关外,还与 ___________有关。
(3)根据上述电池分析,负极材料是否一定参加电极反应? ______(填“一定”或“不一定”),用上述电池说明: ______________________________________________。
(4)上述电池放电过程中,电解质溶液酸碱性的变化:甲 ________,丙 ________,戊 ________(填“酸性减弱”或“碱性减弱”)。
1.以原电池为例认识化学能可以转化为电能。
2.从氧化还原反应角度初步认识原电池的工作原理。
装置
现象
解释或结论
实验1
①锌片:不断溶解,且锌片上有
②铜片:
锌是活泼金属能与稀硫酸反应产生氢气;铜不能与稀硫酸反应
实验2
①锌片:不断溶解
②铜片: ,但铜片上产生大量气泡
③电流计:指针发生
有 产生,
装置中 能转化为
电极
材料
电极
名称
电子
转移
电极
反应式
反应
类型
锌
负极
失电子
Zn-2e-===Zn2+
氧化反应
铜
正极
得电子
2H++2e-===H2↑
还原反应
总反应式
Zn+2H+===Zn2++H2↑
名称
干电池
(一次电池)
充电电池
(二次电池)
燃料电池
特点
①活性物质(发生氧化还原反应的物质)消耗到一定程度后,不能再使用
②电解质溶液为胶状,不流动
①放电后可再充电使活性物质获得再生
②可以多次充电,重复使用
①电极本身不包含活性物质,只是一个催化转换元件
②工作时,燃料和氧化剂连续地由外部供给,在电极上不断地进行反应,生成物不断地被排出
举例
普通的锌锰电池、碱性锌锰电池、银锌电池等
铅酸蓄电池、锂电池、镍氢电池
氢氧燃料电池、CH4燃料电池、CH3OH燃料电池等
A
B
C
D
手机用锂电池
电动汽车用电池
铅酸蓄电池
锌锰干电池
实验装置
部分实验现象
a极质量减小,b极质量增大
b极有气体产生,c极无变化
d极溶解,c极有气体产生
电流从a极流向d极
酸性
碱性
负极
2H2-4e-===4H+
2H2+4OH--4e-===4H2O
正极
O2+4H++4e-===2H2O
O2+2H2O+4e-===4OH-
总反应
2H2+O2===2H2O
实验Ⅰ
实验Ⅱ
装置
现象
电流计指针向右偏转;铁片溶解;铜片上有红色物质(铜)析出,铜片质量增加
电流计指针向右偏转;……
装置序号
正极
负极反应式
阳离子移动方向
甲
乙
丙
丁
戊
高中化学人教版 (2019)必修 第二册第一节 化学反应与能量变化教学设计及反思: 这是一份高中化学人教版 (2019)必修 第二册第一节 化学反应与能量变化教学设计及反思,文件包含人教版2019高中化学必修二61化学反应与能量变化第一课时教案docx、人教版2019高中化学必修二61化学反应与能量变化第二课时教案docx等2份教案配套教学资源,其中教案共10页, 欢迎下载使用。
苏教版选修4 化学反应原理第二单元 化学能与电能的转化教案: 这是一份苏教版选修4 化学反应原理第二单元 化学能与电能的转化教案,共4页。教案主要包含了学习目标,重点与难点,教学方法,教学用品,教学过程,练习,课后作业等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第二册第六章 化学反应与能量第一节 化学反应与能量变化教案设计: 这是一份高中化学人教版 (2019)必修 第二册第六章 化学反应与能量第一节 化学反应与能量变化教案设计,共5页。教案主要包含了化学能转化为电能等内容,欢迎下载使用。













