

浙教版九年级上册第6节 几种重要的盐教学设计
展开1.6 几种常见的盐
第1课时 常见的盐和盐的制取
目录
1
4
7
9
12
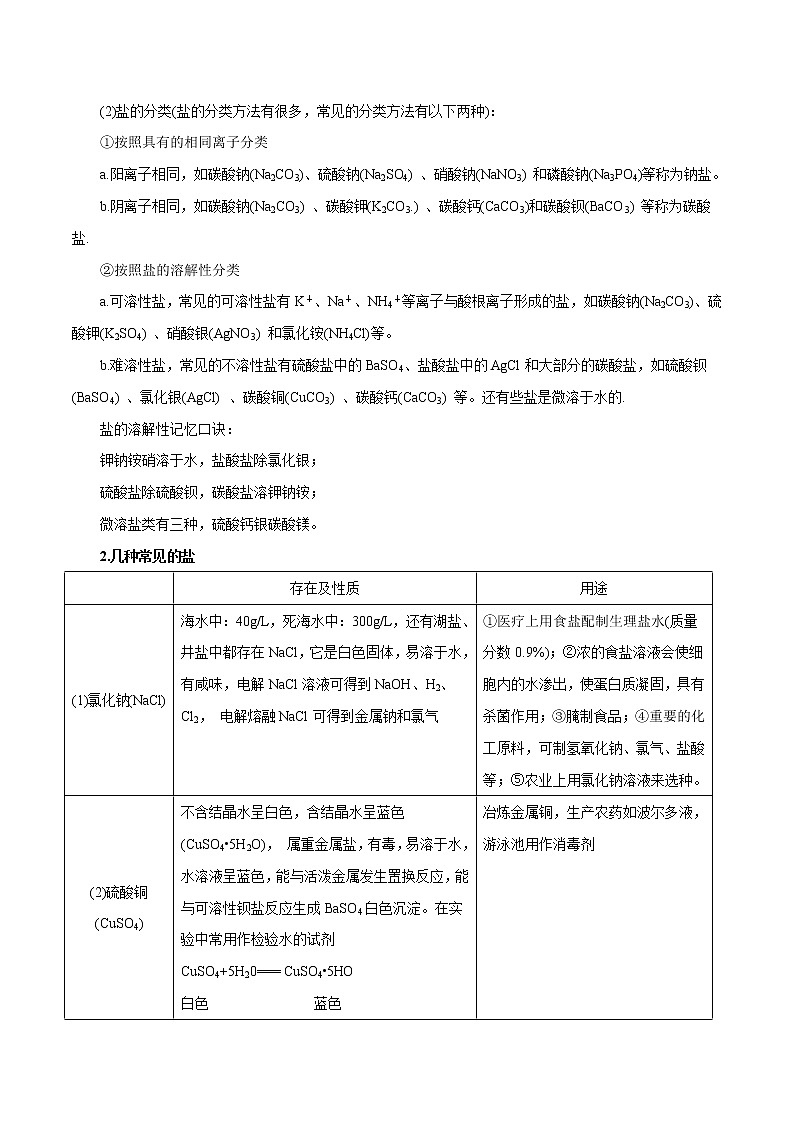
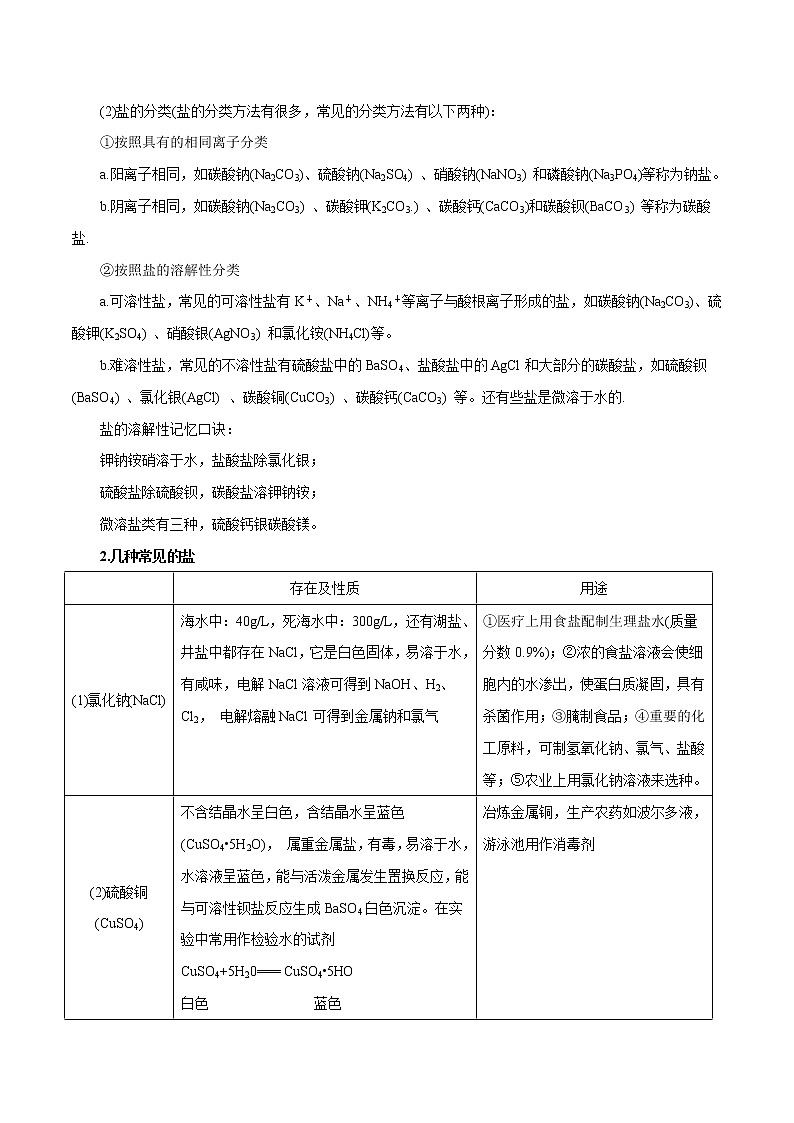
1.盐的概念
(1) 在溶解或熔化状态下能电离出金属离子(或NH) 和酸根离子的化合物叫做盐。如:
KClO3===K++C1O
KNO3===K++NO
FeSO2===Fe2++SO
NH4NO3===NH+NO
NaHSO4===Na++H++SO
【注意】①注意分清“盐”与“食盐”,盐是含有金属离子(或铵根离子)和酸根离子的一类化合物;食盐的主要成分是氯化钠,氯化钠是盐的一种。② NH4NO3电离出的阳离子是NH,尽管无金属元素,但可以把NH看成类金属离子。还有NaHSO4可电离出Na+、H+、SO,称做酸式盐;而Cu2(OH)2C03称为碱式盐;KClO3、KNO3、FeSO2、NH4NO3属于正盐。
(2)盐的分类(盐的分类方法有很多,常见的分类方法有以下两种):
①按照具有的相同离子分类
a.阳离子相同,如碳酸钠(Na2CO3)、硫酸钠(Na2SO4) 、硝酸钠(NaNO3) 和磷酸钠(Na3PO4)等称为钠盐。
b.阴离子相同,如碳酸钠(Na2CO3) 、碳酸钾(K2CO3.) 、碳酸钙(CaCO3)和碳酸钡(BaCO3) 等称为碳酸盐.
②按照盐的溶解性分类
a.可溶性盐,常见的可溶性盐有K+、Na+、NH4+等离子与酸根离子形成的盐,如碳酸钠(Na2CO3)、硫酸钾(K2SO4) 、硝酸银(AgNO3) 和氯化铵(NH4Cl)等。
b.难溶性盐,常见的不溶性盐有硫酸盐中的BaSO4、盐酸盐中的AgCl和大部分的碳酸盐,如硫酸钡(BaSO4) 、氯化银(AgCl) 、碳酸铜(CuCO3) 、碳酸钙(CaCO3) 等。还有些盐是微溶于水的.
盐的溶解性记忆口诀:
钾钠铵硝溶于水,盐酸盐除氯化银;
硫酸盐除硫酸钡,碳酸盐溶钾钠铵;
微溶盐类有三种,硫酸钙银碳酸镁。
2.几种常见的盐
存在及性质
用途
(1)氯化钠(NaCl)
海水中:40g/L,死海水中:300g/L,还有湖盐、井盐中都存在NaCl,它是白色固体,易溶于水, 有咸味,电解NaCl溶液可得到NaOH、H2、Cl2, 电解熔融NaCl可得到金属钠和氯气
①医疗上用食盐配制生理盐水(质量分数0.9%);②浓的食盐溶液会使细胞内的水渗出,使蛋白质凝固,具有杀菌作用;③腌制食品;④重要的化工原料,可制氢氧化钠、氯气、盐酸等;⑤农业上用氯化钠溶液来选种。
(2)硫酸铜(CuSO4)
不含结晶水呈白色,含结晶水呈蓝色(CuSO4•5H2O), 属重金属盐,有毒,易溶于水,水溶液呈蓝色,能与活泼金属发生置换反应,能与可溶性钡盐反应生成BaSO4白色沉淀。在实验中常用作检验水的试剂
CuSO4+5H20=== CuSO4•5HO
白色 蓝色
冶炼金属铜,生产农药如波尔多液,游泳池用作消毒剂
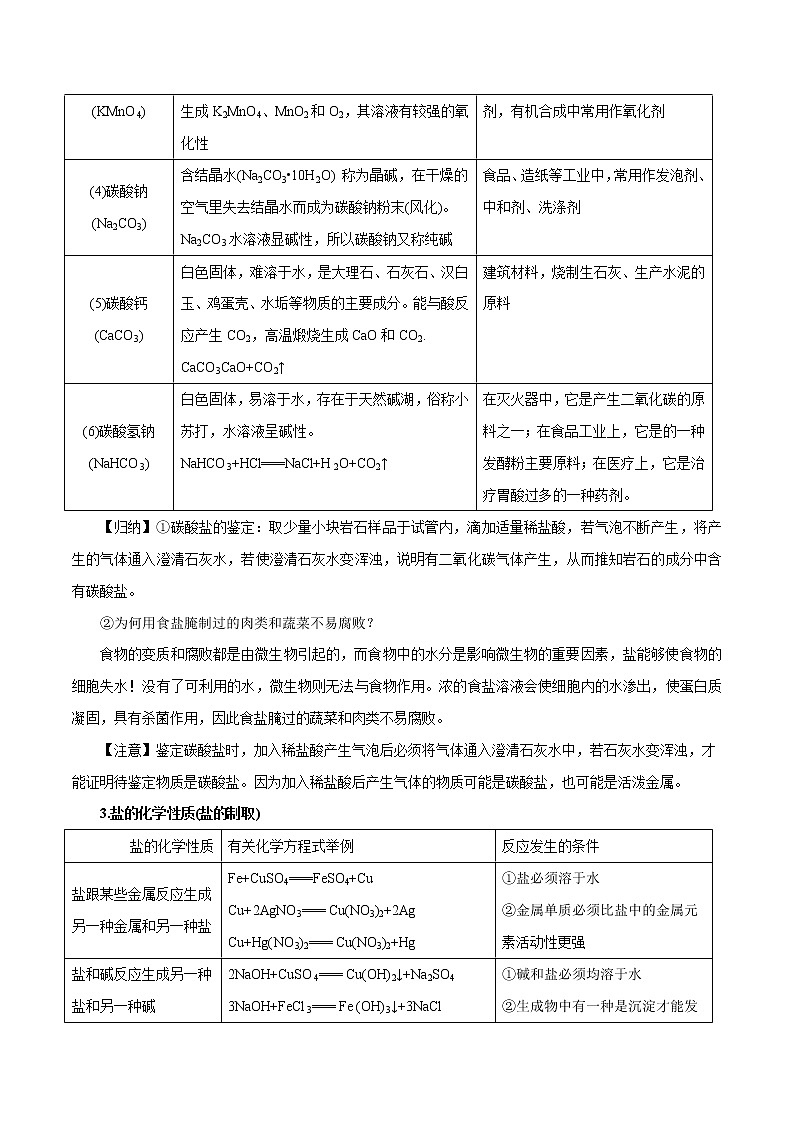
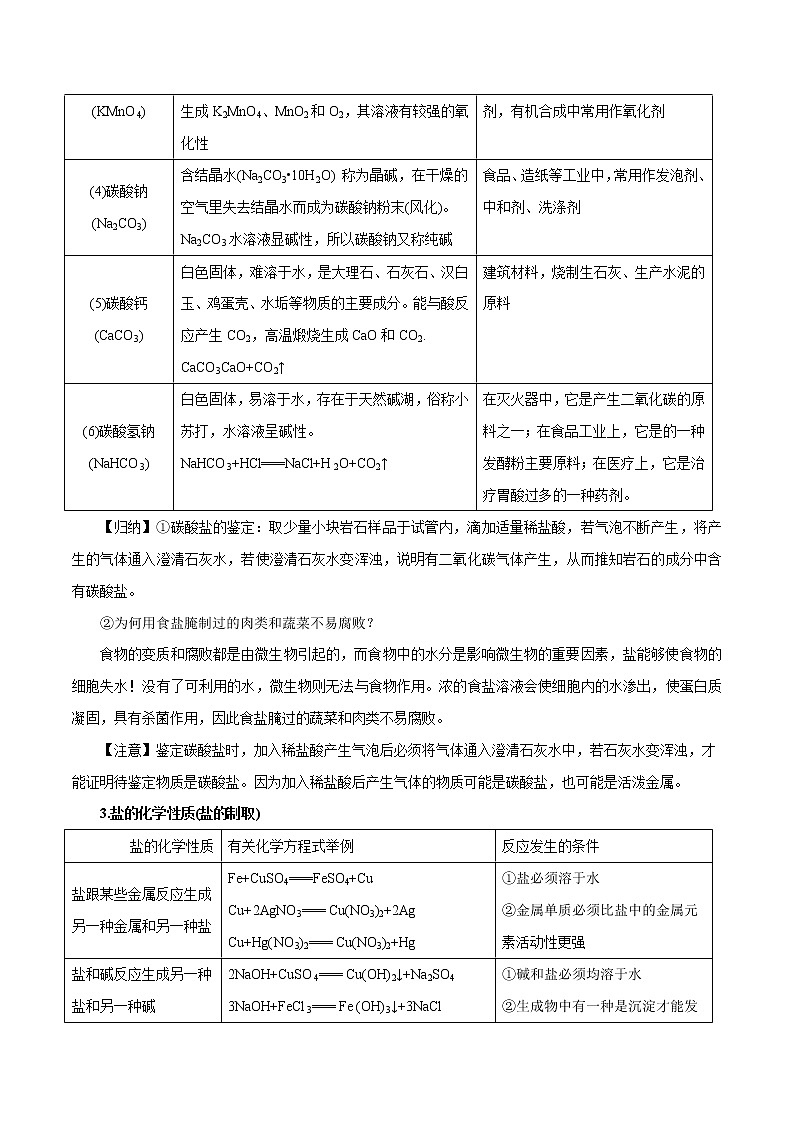
(3)高锰酸钾(KMnO4)
紫黑色晶体,溶液呈红色,其固体加热易分解,生成K2MnO4、MnO2和O2,其溶液有较强的氧化性
实验室制取氧气,医疗上常用作消毒剂,有机合成中常用作氧化剂
(4)碳酸钠(Na2CO3)
含结晶水(Na2CO3•10H2O) 称为晶碱,在干燥的空气里失去结晶水而成为碳酸钠粉末(风化)。Na2CO3水溶液显碱性,所以碳酸钠又称纯碱
食品、造纸等工业中,常用作发泡剂、中和剂、洗涤剂
(5)碳酸钙(CaCO3)
白色固体,难溶于水,是大理石、石灰石、汉白玉、鸡蛋壳、水垢等物质的主要成分。能与酸反应产生CO2,高温煅烧生成CaO和CO2. CaCO3CaO+CO2↑
建筑材料,烧制生石灰、生产水泥的原料
(6)碳酸氢钠(NaHCO3)
白色固体,易溶于水,存在于天然碱湖,俗称小苏打,水溶液呈碱性。NaHCO3+HCl===NaCl+H2O+CO2↑
在灭火器中,它是产生二氧化碳的原料之一;在食品工业上,它是的一种发酵粉主要原料;在医疗上,它是治疗胃酸过多的一种药剂。
【归纳】①碳酸盐的鉴定:取少量小块岩石样品于试管内,滴加适量稀盐酸,若气泡不断产生,将产生的气体通入澄清石灰水,若使澄清石灰水变浑浊,说明有二氧化碳气体产生,从而推知岩石的成分中含有碳酸盐。
②为何用食盐腌制过的肉类和蔬菜不易腐败?
食物的变质和腐败都是由微生物引起的,而食物中的水分是影响微生物的重要因素,盐能够使食物的细胞失水!没有了可利用的水,微生物则无法与食物作用。浓的食盐溶液会使细胞内的水渗出,使蛋白质凝固,具有杀菌作用,因此食盐腌过的蔬菜和肉类不易腐败。
【注意】鉴定碳酸盐时,加入稀盐酸产生气泡后必须将气体通入澄清石灰水中,若石灰水变浑浊,才能证明待鉴定物质是碳酸盐。因为加入稀盐酸后产生气体的物质可能是碳酸盐,也可能是活泼金属。
3.盐的化学性质(盐的制取)
盐的化学性质
有关化学方程式举例
反应发生的条件
盐跟某些金属反应生成另一种金属和另一种盐
Fe+CuSO4===FeSO4+Cu
Cu+2AgNO3=== Cu(NO3)2+2Ag
Cu+Hg(NO3)2=== Cu(NO3)2+Hg
①盐必须溶于水
②金属单质必须比盐中的金属元素活动性更强
盐和碱反应生成另一种盐和另一种碱
2NaOH+CuSO4=== Cu(OH)2↓+Na2SO4
3NaOH+FeCl3=== Fe (OH)3↓+3NaCl
Ca(OH)2+Na2CO3=== 2 NaOH+ CaCO3↓
①碱和盐必须均溶于水
②生成物中有一种是沉淀才能发生
盐跟某些酸反应生成新酸和新盐
CaCO3+2HCl=== CaCl2+H2O+CO2↑
AgNO3+2HCl===AgCl2↓(白色)+HNO3
H2SO4 +BaCl2 ===BaSO4↓(白色)+ 2HCl
H2SO4 +Na2CO3=== Na2SO4+H2O+CO2↑
一般酸与盐均溶于水,只要符合复分解反应条件,则反应可以发生。碳酸盐等弱酸盐可与强酸反应
盐和盐反应生成另外两种新盐
NaCl+AgNO3==AgCl2↓(白色)+NaNO3
Na2SO4 +BaCl2 ===BaSO4↓(白色)+2NaCl
Na2CO3+CaCl2=== CaCO3↓(白色)+ 2NaCl
KCl+AgNO3==AgCl2↓(白色)+KNO3
①两种盐必须均溶于水
②生成物中有沉淀,反应才能发生
【注意】①潮解是物理变化,风化是化学变化。
②氢氧化钙与碳酸钠的反应是制取烧碱的原理。
③由于碳酸钙与硫酸反应时生成的硫酸钙微溶,会附着在碳酸钙表面,使反应不能继续进行,所以实验室制取二氧化碳时不能用石灰石和稀硫酸反应。
4.盐的制取
有些盐是天然存在的,如可从海水、盐湖或盐井中提取食盐,也有些盐是用化学方法制取的。制取盐类物质,除了分析反应的可能性外,还需注意环保、经济、可行性等。由前述所学,归纳盐的制取有以下几种:
①酸+金属→盐+氢气
②酸+金属氧化物→盐+水
③酸+碱→盐+水
④碱+多数非金属氧化物→盐+水
⑤酸+盐→新酸+新盐
⑥碱+盐→新碱+新盐
⑦盐+金属→新金属+新盐[后面学]
⑧盐+盐→新盐+新盐
其中体现了盐的化学性质的是盐与酸、碱、盐、金属的反应。
【拓展】我国化学家侯德榜对制碱工业有重大贡献,他发明的制碱方法被誉为“侯氏制碱法”,广泛应用于工业生产中。
1.物质的检验方法与技巧
物质的检验包括鉴定、鉴别和推断等类型。鉴定是根据一种物质的特性,用化学方法检验它是不是这种物质,若是离子化合物,必须检验出它的阳离子和阴离子;鉴别是根据几种物质的不同特性,区别它们各是什么物质;推断是根据已知实验步骤和实验现象,运用物质特性进行分析,通过推理,判断被检验的样品是什么物质,或样品中含有什么物质,不含什么物质等。
(1)解题时,一般应包括取样、操作、现象、结论四个部分,要求做到:
①“先取样,后操作”,如果样品是固体,一般先用水溶解,配成溶液后再检验;
②要“各取少量溶液分别放入几支试管中”进行检验,不得在原试剂瓶中进行检验;
③要“先现象,后结论”,如向Na2CO3溶液中滴加盐酸,所观察到的现象应记录为“有气泡产生”或“有无色气体放出”,不能说成“碳酸钠和盐酸反应,放出二氧化碳”或“有无色二氧化碳气体放出”
(2)物质的检验最关键的是掌握有关阳离子、阴离子的检验(见下表)。
①常见阳离子
离子
所用的试剂
主要实验现象
相关化学方程式
H+
①紫色石蕊试液
②锌片
③pH试纸
①紫色石蕊试液变为红色
②锌片表面生成无色气体
③pH试纸变为红色(pH<7)
Zn+2HCl===ZnCl2+H2↑
Ag+
①盐酸或可溶性氯化物溶液,稀硝酸、氨水
②氢氧化钠溶液、氨水
①生成白色沉淀,该沉淀不溶于稀硝酸,但溶于氨水
②生成白色沉淀,该沉淀迅速转变成棕色,此沉淀溶于氨水,形成无色溶液
NaCl+AgNO3===AgCl↓+NaNO3
AgNO3+NaOH===AgOH↓ + NaNO3
AgOH+2NH3·H2O===Ag(NH3)2OH + 2H2O
Ba2+
稀硫酸或硫酸盐溶液、稀硝酸
生成白色沉淀,该沉淀不溶于稀硝酸
H2SO4 +BaCl2 ===BaSO4↓+2HCl
Fe3+
①氢氧化钠溶液
②KSCN溶液
①生成红褐色沉淀
②溶液呈血红色
3NaOH+FeCl3===Fe(OH)3↓+3NaCl
Cu2+
氢氧化钠溶液
生成蓝色絮状沉淀,加热变成黑色
2NaOH+CuSO4=== Cu(OH)2↓+Na2SO4
NH4+
加入浓氢氧化钠溶液、湿润的红色石蕊试纸
加热并用湿润的红色石蕊试纸检验产生的气体,试纸变蓝
NH4Cl+NaOH===NaCl+NH3↑+H2O
②常见阴离子
离子
所用的试剂
主要实验现象
相关化学方程式
OH-
①紫色石蕊试液
②无色酚酞试液
③pH试纸
①紫色石蕊试液变为蓝色
②无色酚酞试液变为红色
③pH试纸显蓝色至深蓝
——
Cl-
硝酸银溶液、稀硝酸
生成白色沉淀,此沉淀不溶于稀硝酸
HCl+AgNO3===AgCl↓+HNO3
CO32-
①氯化钡溶液、稀盐酸
②稀盐酸、澄清的石灰水
①生成白色沉淀,该沉淀溶于稀盐酸且有气泡产生
②生成的气体能使澄清的石灰水变浑浊
Na2CO3+BaCl2=== BaCO3↓+ 2NaCl
BaCO3+2HCl=== BaCl2+H2O+CO2↑
Na2CO3+2HCl===2NaCl+H2O+CO2↑
CO2+Ca(OH)2===CaCO3↓+H2O
SO
氯化钡(或硝酸钡)、稀硝酸
生成的白色沉淀不溶解
Na2SO4 +BaCl2 ===BaSO4↓+2NaCl
SO
①氯化钡、稀盐酸
②稀盐酸或稀硫酸、品红溶液
①生成白色沉淀,此沉淀溶于稀盐酸并放出有刺激性气味气体(SO2)
②生成的气体能使品红溶液褪色
Na2SO3+BaCl2 ===BaSO3↓+2NaCl
BaSO3+2HCl=== BaCl2+H2SO3
Na2SO3+2HCl===2NaCl+H2O+SO2↑
2.几种特殊的盐
盐
性质
用途与应用
氯化银(AgCl)
白色固体,难溶于水,不溶于酸,是可溶性银盐和可溶性氯化物反应的产物(Ag++Cl-===AgCl↓)
判断溶液中的Ag+或Cl-
硫酸钡(BaSO4)
白色固体,难溶于水,不溶于酸,是可溶性钡盐与硫酸或可溶性硫酸盐反应的产物(Ba2++SO=BaSO4↓)
判断溶液中的Ba2+或SO
碳酸氢钠(NaHCO3小苏打)
白色粉末,水溶液显碱性,固体粉末加热易分解生成Na2CO3
2NaHCO3Na2CO3+H2O+CO2↑
具有盐的一般性质
食品中的膨化剂,灭火器中的药品
亚硝酸钠(NaNO2)
白色粉末,酷似NaCl,有咸味,水溶液显碱性,有毒,是致癌物
工业上用作生物制品的保鲜剂、氧化剂
碘酸钾(KIO3)
白色固体,易溶于水,固体加热易分解,所以加碘盐不能干炒以免损失碘元素
食盐中的加碘剂
常考1 知道盐的含义,认识常见盐的物理性质和化学性质
例1 厨房中有一包无标识的白色粉末,经初步认定可能是氯化钠、碳酸钠、碳酸氢钠中的一种。小明对白色粉末的成分进行了探究。
[查阅资料] 碳酸钠俗称苏打,碳酸氢钠俗称小苏打,两者都属于 (填“酸”“碱”或“盐”),都能溶于水,且水溶液都呈碱性。
[实验探究] 小明取适量白色粉末,配制成溶液,按下表中所示实验方案进行探究。
实验步骤
实验内容
实验现象
实验结论
1
取少量溶液,滴加无色酚酞试液
溶液变红
白色粉末肯定不是____________
2
取少量溶液,滴加稀盐酸
___________
——
3
取少量溶液,滴加澄清石灰水
产生白色沉淀
——
实验步骤2中可能发生反应的化学方程式为______________________________________________________(写出一个即可)。实验步骤 3中白色沉淀的成分是________(填写化学式)。
[实验反思] 小明实验后发现上述实验方案并不能确定白色粉末的组成。经老师指导后,小明再取少量配制的溶液滴加氯化钙溶液,没有观察到明显现象,则该白色粉末是 。
方法归纳:熟悉几种常见盐(氯化钠、碳酸钠、碳酸钙等)的性质是解决此类题的关键,其具体性质可见正文讲解内容。
常考2 理解复分解反应,能根据复分解反应发生的条件判断酸、碱、盐之间的反应能否发生
例2 如图中的几种物质是常见的盐,请回答下列问题。
(1)在碳酸钠溶液中滴入氯化钙溶液,现象是 。
(2)碳酸钙、碳酸钠均能与稀盐酸反应生成 CO2,是因为碳酸钙、碳酸钠中均含有 ( 写离子符号 )。
(3)硫酸铜溶液与氢氧化钠溶液能反应,化学方程式为
;硫酸铜溶液与氯化钠
溶液不能 反应,其理由是 。
方法归纳:书写复分解反应化学方程式的方法:复分解反应的特点是“双交换、价不变”,即化合物互相交换成分,反应前后各元素的化合价不变。从书写上看是“里面”的离子结合生成一种化合物,“外面”的离子结合生成另外一种化合物,即“内内结合、外外结合”,在“结合”过程中还要根据元素或原子团的化合价,正确书写物质的化学式。
1.下列物质的用途中,不正确的是( )
A.大理石用作建筑材料
B.石灰石可用于实验室制取二氧化碳
C.纯碱用于降低土壤酸性
D.氯化钠用作烹调食物时的调味品
2.下列关于盐的说法中,正确的是 ( )
A.能解离出金属阳离子(或铵根离子)的物质叫盐
B.能解离出金属阳离子(或铵根离子)和酸根离子的化合物叫盐
C.盐的水溶液一定呈中性
D.盐的化学式中一定含有金属离子和酸根离子
3.科学就在我们身边,生活中处处有科学。根据你所学过的科学知识,下列说法错误的是( )
A.“请往菜里加点盐”中的“盐”特指食盐NaCl
B.体温计中的水银不是银,是金属汞
C.食品工业中,发酵粉的主要成分是小苏打Na2CO3
D.建筑材料大理石的主要成分是碳酸钙
4.下列推论正确的是 ( )
A.碳酸盐可与盐酸反应放出气体,所以与盐酸反应放出气体的物质一定是碳酸盐
B.酸与碱反应生成盐和水,所以生成盐和水的反应一定是酸与碱的反应
C.燃烧都伴随着发光、放热,所以有发光、放热现象的就是燃烧
D.碱性溶液能使石蕊试液变蓝,所以能使石蕊试液变蓝的溶液呈碱性
5.甲、乙、内、丁四小组同学分别对实验废液中成分进行分析检测,结果见下表:
检测小组
检测结果
甲组
KCl、KNO3、KOH、HCl
乙组
KCl、KNO3、K2CO3、HCl
丙组
KCl、KNO3、K2O4、KOH
丁组
KCl、KNO3、K2CO3、KOH
其中,检测结果合理的是 ( )
A.甲组、乙组 B. 丙组、丁组 C.甲组、丙组 D.乙组、丁组
6.化学学习中经常要查阅各种数据或相关的图表。若要推测一个复分解反应能否发生,下列能给你提供帮助的是 ( )
A.元素周期表 B.常见物质的溶解性表 C.相对原子质量表 D.常见元素的化合价表
7.在带有磨砂玻璃盖的培养皿内,一边放几粒碳酸钠晶体,另一边放几小块固体氢氧化钠,放置一段时间后,可以看到碳酸钠晶体变成白色粉末,固体氢氧化钠表面湿润,请你指出:_______________晶体所表现出的现象叫作风化,____________________固体所表现出的现象叫作潮解。
8.痕检是公安机关提取犯罪嫌疑人指纹的一种重要方法,硝酸银显现法就是其中的一种。人的手上有汗迹,用手拿过白纸后,指纹线就留在纸上。如果将硝酸银溶液小心地涂到纸上,硝酸银溶液就跟汗迹中的氯化钠作用,生成氯化银,其反应的化学方程式为__________________________________________,反应的类型是___________________________。
9.X射线不能穿透硫酸钡,因此常用硫酸钡作为诊断胃病的造影剂(“钡餐”)。但是如果病人误服了碳酸钡,却会发生中毒(可溶性的钡盐是有毒的)。一旦中毒,应立即服用泻盐(MgSO) 解毒。用化学方程式表示:
(1)误服碳酸钡引起中毒的原因:____________________________________________________________________。
(2)用泻盐可以解毒的原因:____________________________________________________________________。
10.用石灰石与稀盐酸反应,制取二氧化碳。取石灰石20g,反应后生成二氧化碳4.4g,求石灰石中碳酸钙的纯度。
11.在67.87g盐酸中逐滴滴入85.00g硝酸银溶液至不再产生沉淀,过滤,得到的沉淀质量为2.87g.问:
(1)硝酸银溶液中溶质的质量.
(2)硝酸银溶液中溶质的质量分数。
(3)反应后所得溶液中溶质的质量分数。(保留到0.01%)
1.实验室有一瓶保管不当的试剂,其残缺的标签如图,这瓶试剂中的溶质可能是()
A.单质 B.氧化物 C.碱 D.盐
2.角胆弄破后,会使角肉沾上一种叫胆汁酸(一种酸)的难溶丁水的物质,使鱼肉变苦。要消除这种苦味,最适宜冲洗的溶液是( )
A.食盐水 B.氢氧化钠溶液 C.纯碱溶液 D.醋酸
3.下列各组物质能够在溶液中大量共存的是 ( )
A.KCI、NaNO3 B.HCL、NaHCO3 C.NaCl、AgNO3 D.H2SO4、NaOH
4.下列几组物质按酸、碱、盐顺序排列的是 ( )
A.KNO、NaOH、HCl B.Ca(OH)2、HCl、NaCl
C.H2SO4、Na2CO3、Ba(OH)2 D.HNO3、KOH、CuSO4
5.有四瓶常用溶液:①BaCl2溶液; ②NaCl溶液; ③Na2SO4溶液;④CuSO4溶液。不用其他试剂,可通过实验方法将它们一一鉴别开来,鉴别出来的先后顺序可能是 ( )
A.①④③② B.①③④② C.④①③② D.④③②①
6.除去下列物质中的杂质所用试剂和方法不正确的是 ( )
7.某同学在自家厨房中找到一种白色粉末,到学校实验室进行实验,实验过程与现象如图所示。对此粉末的成分判断正确的是( )
A.该粉末一定是碳酸钠
B.该粉末一定是碳酸氢钠
C.该粉末一定是氯化钠
D.该粉末可能是碳酸钠或碳酸氢钠
8.(丽水中考) 向一定质量CaCl2和HCl的混合溶液中, 逐渐加人Na2CO3溶液,反应过程中产生气体或沉淀的质量与加人的Na2CO3溶液的质量关系如图,下列说法错误的是 ( )
A.OE段发生的化学反应:Na2CO3+2HCl===2NaCl+H2O+CO2↑
B.PF段有沉淀生成
C.G点溶液的pH>7
D.反应过程有气体和沉淀生成,不遵循质量守恒定律
9.纯碱(Na2CO3)属于__________ (填“酸”“碱”或“盐”)。向纯碱的水溶液中滴加酚酞试液,试液变__________色,说明纯碱溶液呈 性,其pH__________7(填“=”“>”或“<”)。我国科学家侯德榜创造了一种著名的纯碱生产方案——“联合制碱法”。
(1)“联合制碱法”的生产过程用化学方程式可简要表示为:
①NH3+CO2+H2O===NH4HCO3
②NH4HCO3+NaCl=NaHCO3+NH4Cl
③2NaHCO3===Na2CO3+H2O+CO2↑
该过程中没有涉及的基本反应类型是 ( )
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
(2)第②步中加入的是磨细食盐粉,食盐磨细的目的是______________________________ .
(3)将第②步中所得滤液(NH4Cl与剩余NaCl的混合溶液)降温,NH4Cl晶体大量析出,而NaCl却仍留在溶液中。你认为NH4Cl先结晶的原因可能是__________。所得NH4Cl属于化学肥料中的__________肥。
10.现有A和B两种无色溶液,A是某种钠盐,据图所示各步实验回答下列问题。
(1)写出A、B、C三种物质的化学式:A. ,B. ,C. 。
(2)写出有关的化学方程式:
①A+B:_______________________________________。
②C+HCl:_______________________________________。
③D+AgNO3:_______________________________________。
④E+Ca(OH)2:_______________________________________。
11.(宁波中考) 活性碳酸钙(CaCO3) 和炭黑( C )常用作橡胶的填充料,用来改良橡胶性能。在不同的橡胶制品中,对活性碳酸钙和炭黑的投料比有不同的要求。现有一份由活性碳酸钙和炭黑组成的橡胶填充料样品,为测定其中活性碳酸钙的含量,小科用如图所示的实验装置进行实验。
实验步骤如下:①按图连接装置并检查装置的气密性;
②取样品4.0g,置于甲中的硬质玻璃管内,乙中加入足量的氢氧化钠溶液;
③通入干燥的氧气一段时间后,电子秤的示数稳定在150.0g;
④继续保持氧气通入,点燃洒精喷灯,加强热;
⑤充分反应后(C被完全氧化, CaCO3被完全分解) , 最终电子秤的示数稳定在152.2g;
⑥实验结束后,根据实验所得的数据进行计算。
请回答下列问题:
(1)实验中所用的氧气可以在实验室中利用 分解得到。
(2)步骤③中先通入干燥的氧气一段时间的目的是 。
(3)计算样品中活性CaCO3的质量分数(结果精确到0.1%)。
12.(杭州中考)有一包白色固体,可能由硫酸钾、氢氧化钾、碳酸钙、氯化钡中的一种或几种物质组成。为探究该白色固体的组成,某小组取适量样品按下列流程进行实验。请回答下列问题。
(1)白色沉淀Ⅰ与稀盐酸反应的化学方程式为 。
(2)白色沉淀Ⅱ的化学式: 。
(3)原白色固体中含有的物质: 。
13.(温州中考)在校园科技节上,为测出鸡蛋壳(主要成分是碳酸钙)中钙元素的质量分数,某同学称取已洗净、晾干、研成粉末的鸡蛋壳10克置于烧杯中,将烧杯放在电子天平上,往烧杯中加人足量的稀盐酸,每0.5分钟记录一次电子天平的示数,据此计算出产生气体的质量。具体数据如下表:(反应的化学方程式为CaCO3+2HCl===CaCl2+H2O+CO2↑)
(1)若产生的气体全部是鸡蛋壳中的碳酸钙与盐酸反应生成的CO2,根据实验结果计算出该鸡蛋壳中钙元素的质量分数。(假定鸡蛋壳中其他成分不含钙元素,写出具体计算过程)
(2)下列哪些情况会导致实验中钙元素质量分数测量结果偏大? (可多选)
A.盐酸溶质质量分数过大 B.鸡蛋壳未晾干
C.鸡蛋壳中含有碳酸镁 D.鸡蛋壳未充分研碎
浙教版九年级上册第3节 体内物质的运输教案: 这是一份浙教版九年级上册第3节 体内物质的运输教案,文件包含精品讲义浙教版科学9年级上册431体内物质的运输血液心脏和血管学生版docx、精品讲义浙教版科学9年级上册431体内物质的运输血液心脏和血管教师版含解析docx等2份教案配套教学资源,其中教案共32页, 欢迎下载使用。
初中科学浙教版九年级上册第5节 物体的内能教案及反思: 这是一份初中科学浙教版九年级上册第5节 物体的内能教案及反思,文件包含精品讲义浙教版科学9年级上册352物体的内能-比热容和热机学生版docx、精品讲义浙教版科学9年级上册352物体的内能-比热容和热机教师版含解析docx等2份教案配套教学资源,其中教案共22页, 欢迎下载使用。
科学九年级上册第6节 几种重要的盐教案: 这是一份科学九年级上册第6节 几种重要的盐教案,文件包含精品讲义浙教版科学9年级上册162盐与化肥碱和盐的性质探究实验学生版docx、精品讲义浙教版科学9年级上册162盐与化肥碱和盐的性质探究实验教师版含解析docx等2份教案配套教学资源,其中教案共27页, 欢迎下载使用。













