


2021高中化学专项练习 分压平衡常数的计算专题
展开
这是一份2021高中化学专项练习 分压平衡常数的计算专题,文件包含突破分压平衡常数的计算原卷版docx、突破分压平衡常数的计算解析版docx等2份试卷配套教学资源,其中试卷共19页, 欢迎下载使用。
CO2(g)+3H2(g)(CH3OH(g)+H2O(g)反应,达到平衡时,测得CO2的平衡转化率为50%,则该反应条件下的平衡常数为Kp=________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
【答案】
【解析】若反应条件为压强8MPa,300℃的反应温度下二氧化碳和氢气按1:3的比例通入,测得二氧化碳的平衡转化率为50%,结合三段式列式计算,
分压=总压×物质的量分数,物质的量分数=,故P(CO2)=,P(H2)=,P(CH3OH)=,P(H2O)=Kp==(MPa)−2
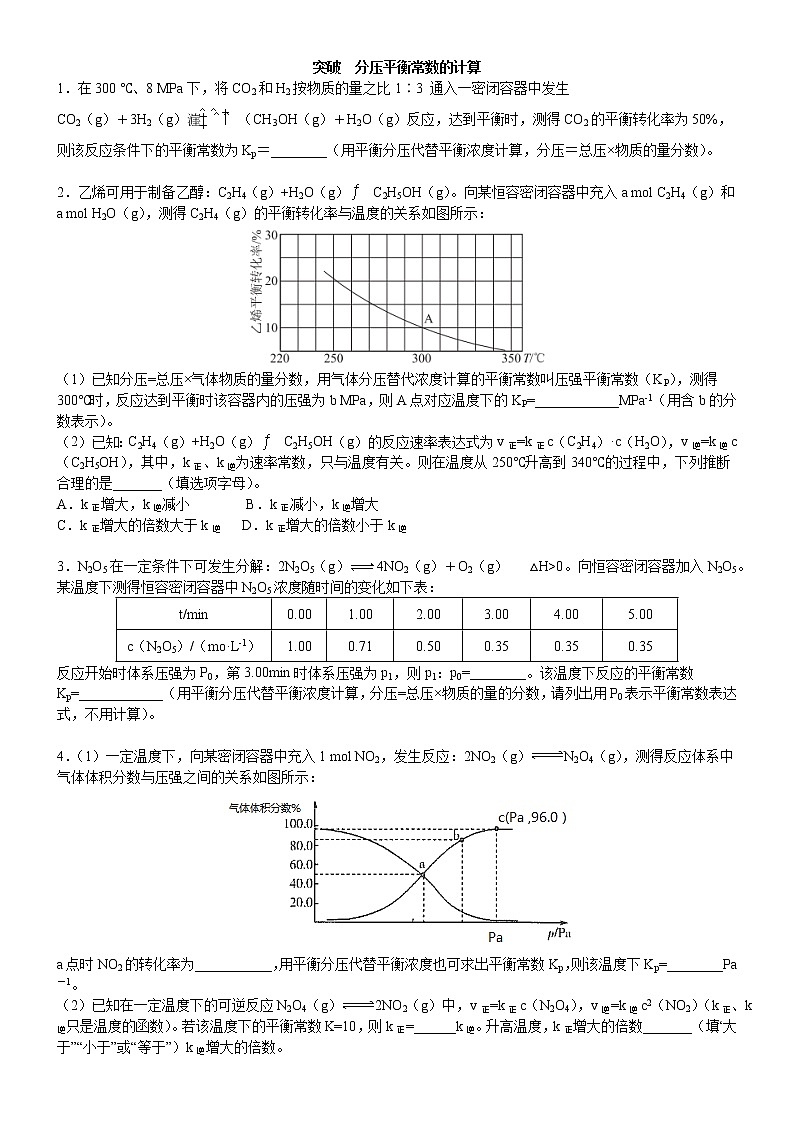
2.乙烯可用于制备乙醇:C2H4(g)+H2O(g)C2H5OH(g)。向某恒容密闭容器中充入a ml C2H4(g)和 a ml H2O(g),测得C2H4(g)的平衡转化率与温度的关系如图所示:
(1)已知分压=总压×气体物质的量分数,用气体分压替代浓度计算的平衡常数叫压强平衡常数(KP),测得300℃时,反应达到平衡时该容器内的压强为b MPa,则A点对应温度下的KP=____________MPa-1(用含b的分数表示)。
(2)已知:C2H4(g)+H2O(g)C2H5OH(g)的反应速率表达式为v正=k正c(C2H4)·c(H2O),v逆=k逆c(C2H5OH),其中,k正、k逆为速率常数,只与温度有关。则在温度从250℃升高到340℃的过程中,下列推断合理的是_______(填选项字母)。
A.k正增大,k逆减小 B.k正减小,k逆增大
C.k正增大的倍数大于k逆 D.k正增大的倍数小于k逆
【答案】(1) (2)D
【解析】(1)由图可知,A点时乙烯的平衡转化率为10%,则平衡时C2H4(g)、H2O(g)、C2H5OH(g)的物质的量分别为0.9a ml、0.9a ml、0.la ml,总的物质的量为1.9aml。平衡时A点对应容器的总压强为b MPa,故C2H4(g)、H2O(g)、C2H5OH(g)的分压分别为、、,则。故答案为:。
(2)平衡时,正、逆反应速率相等,即。升高温度,正、逆反应速率都增大,即k正和k逆均增大,但由于正反应是放热反应,K减小,故k正增大的倍数小于k逆。故选D。
3.N2O5在一定条件下可发生分解:2N2O5(g)4NO2(g)+O2(g) △H>0。向恒容密闭容器加入N2O5。某温度下测得恒容密闭容器中N2O5浓度随时间的变化如下表:
反应开始时体系压强为P0,第3.00min时体系压强为p1,则p1:p0=________。该温度下反应的平衡常数Kp=____________(用平衡分压代替平衡浓度计算,分压=总压×物质的量的分数,请列出用P0表示平衡常数表达式,不用计算)。
【答案】1.975
【解析】压强之比等于物质的量之比,第3.00min时,c(N2O5)=0.35m·L-1,c(NO2)=1.3m·L-1,c(O2)=0.325m·L-1,设容器的体积为VL,;根据表中数据可知3min时达到平衡状态,且上一步计算得到平衡时总压为1.975P0;
该温度下平衡常数
4.(1)一定温度下,向某密闭容器中充入1 ml NO2,发生反应:2NO2(g)N2O4(g),测得反应体系中气体体积分数与压强之间的关系如图所示:
a点时NO2的转化率为___________,用平衡分压代替平衡浓度也可求出平衡常数Kp,则该温度下Kp=________Pa-1。
(2)已知在一定温度下的可逆反应N2O4(g)2NO2(g)中,v正=k正c(N2O4),v逆=k逆c2(NO2)(k正、k逆只是温度的函数)。若该温度下的平衡常数K=10,则k正=______k逆。升高温度,k正增大的倍数_______(填“大于”“小于”或“等于”)k逆增大的倍数。
【答案】(1)66.7% 600/p0 (2)10 大于
【解析】(1)②a点时,设消耗了xmlNO2,则生成0.5xmlN2O4,剩余(1-x)mlNO2,1-x=0.5x,x=2/3ml,此时NO2的转化率为66.7%,平衡时p(N2O4)=0.96p0,p(NO2)=0.04p0,由此可求出Kp=600/p0。(2)当反应达到平衡时,v正=v逆,即k正∙c(N2O4)=k逆∙c2(NO2)。k正=k逆∙c2(NO2)/c(N2O4)=k逆∙K=10k逆;该反应是吸热反应,升高温度,平衡向正方向移动,k正增大的倍数大于k逆增大的倍数。
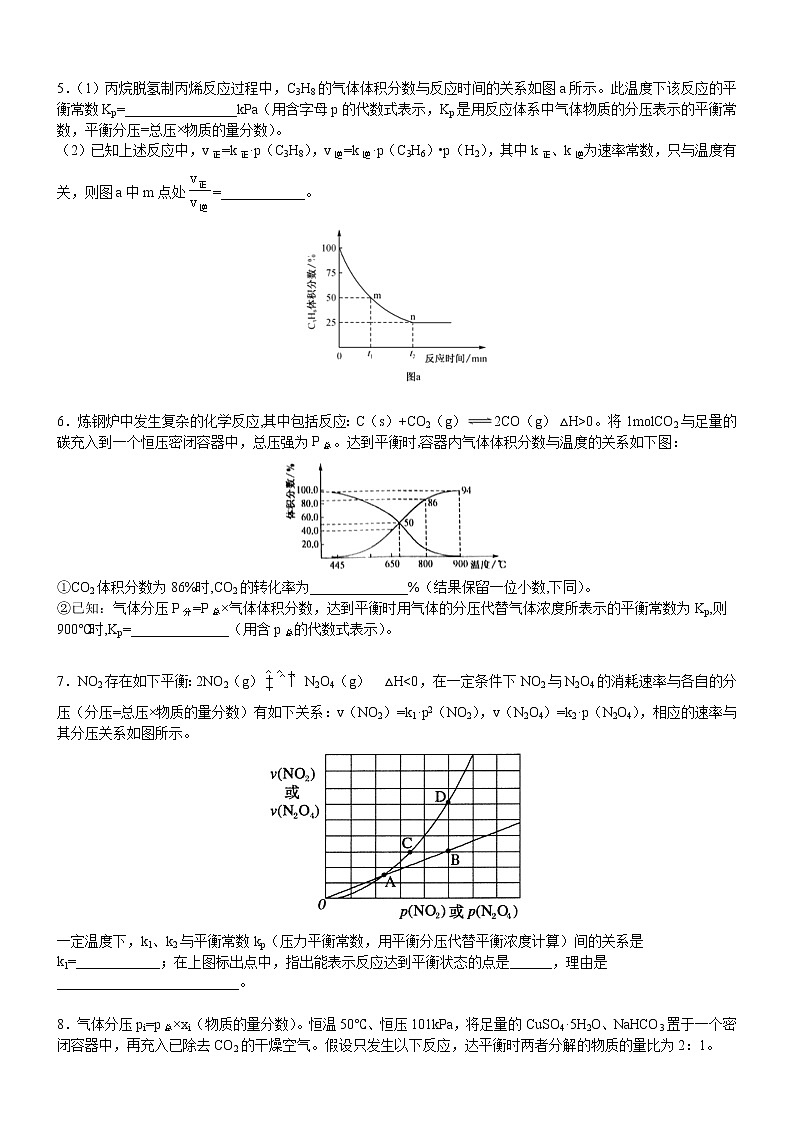
5.(1)丙烷脱氢制丙烯反应过程中,C3H8的气体体积分数与反应时间的关系如图a所示。此温度下该反应的平衡常数Kp=________________kPa(用含字母p的代数式表示,Kp是用反应体系中气体物质的分压表示的平衡常数,平衡分压=总压×物质的量分数)。
(2)已知上述反应中,v正=k正·p(C3H8),v逆=k逆·p(C3H6)•p(H2),其中k正、k逆为速率常数,只与温度有关,则图a中m点处=____________。
【答案】(1)0.9P (2)5.4
【解析】(1)由图可知达到平衡时,丙烷的体积分数为25%,设丙烷的转化量为xml,可列出三段式(单位为:ml):
,则丙烷的体积分数为,解得x=0.6,则平衡时气体总物质的量为1.6ml,根据恒温恒容时,压强之比等于物质的量之比可得,平衡时,气体的总压强为1.6pkPa,丙烯的物质的量分数、氢气的物质的量分数均为,则p(C3H8)=,p(C3H6)=p(H2)=,则
(2)当反应达到平衡时,v正=v逆,即k正·p(C3H8)= k逆·p(C3H6)•p(H2),则,m点处,丙烷的体积分数为50%,设丙烷的转化量为xml,可列出三段式(单位为:ml):
,则丙烷的体积分数为,解得x=,则此时气体总物质的量为,根据恒温恒容时,压强之比等于物质的量之比可得,此时气体的总压强为,丙烯的物质的量分数、氢气的物质的量分数均为,则p(C3H8)=,p(C3H6)=p(H2)=,则。
6.炼钢炉中发生复杂的化学反应,其中包括反应:C(s)+CO2(g)2CO(g) △H>0。将1mlCO2与足量的碳充入到一个恒压密闭容器中,总压强为P总。达到平衡时,容器内气体体积分数与温度的关系如下图:
①CO2体积分数为86%时,CO2的转化率为______________%(结果保留一位小数,下同)。
②已知:气体分压P分=P总×气体体积分数,达到平衡时用气体的分压代替气体浓度所表示的平衡常数为Kp,则900℃时,Kp=______________(用含p总的代数式表示)。
【答案】①7.5% ②14.73p总
【解析】①设CO2的转化率为x,则剩余CO2为(1-x)ml,生成CO为2xml,CO2的体积分数=1-x1-x+2x=0.86,解得x≈0.075,故答案为:7.5%;②由题示信息可得Kp=(=0.94( P2总÷0.06 P2总=14.73p总,故答案为:14.73p总。
7.NO2存在如下平衡:2NO2(g)N2O4(g) △H0
实际生产中常通入水蒸气以降低双环戊二烯的温度(水蒸气不参与反应)。某温度下,通入总压为300 kPa的双环戊二烯和水蒸气,达到平衡后总压为500 kPa,双环戊二烯的转化率为80%,则 p(H2O)=________kPa,平衡常数Kp=__________kPa (Kp为以分压表示的平衡常数)。
【答案】50 3200
【解析】设加入的双环戊二烯的物质的量为x ml、水的物质的量为y ml,由于达到平衡时双环戊二烯的转化率为80%,则剩余双环戊二烯的物质的量为0.2x ml、生成环戊二烯的物质的量为1.6x ml。在恒温恒容条件下,气体的压强之比等于物质的量之比,所以(x+y)ml:(0.2x+1.6x+y)ml=300kPa:500kPa=3:5,解得x:y=5:1,则平衡时H2O的分压p(H2O)==50 kPa;p(双环戊二烯)==50 kPa;p(环戊二烯)==400 kPa,则该反应的化学平衡常数用平衡分压表示Kp==3200 kPa。
10.如图是当反应器中按n(N2)∶n(H2)=1∶3投料后,在200 ℃、400 ℃、600 ℃反应达到平衡时,混合物中NH3的物质的量分数随总压强的变化曲线。
①曲线a、b对应温度较高的是 (填“a”或“b”)。
②列出b点平衡常数的计算式Kp= (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数;不要求计算结果)。
【答案】b (或)
【解析】①合成氨反应为放热反应,升高温度,平衡逆向移动,NH3的物质的量分数减小,故曲线a、b对应温度较高的是b;
②根据图4中的数据可知,b点时NH3的平衡物质的量分数为20%,总压强p=70 MPa。
解法一:设起始加入的N2为1 ml,反应的N2为m ml,则根据三段式法有:
则=20%,解得m=,所以b点时,NH3和N2的物质的量分数均为20%,H2的物质的量分数为60%,则Kp=(或);
解法二:起始投料比等于化学计量数之比,则b点时N2的物质的量分数为(1-20%)×=20%,H2的物质的量分数为20%×3=60%,则Kp=(或)。
11.(g)+I2(g)===(g)+2HI(g) ΔH3=89.3kJ·ml-1。
某温度下,等物质的量的碘和环戊烯()在刚性容器内发生反应③,起始总压为105 Pa,平衡时总压增加了20%,环戊烯的转化率为________,该反应的平衡常数Kp=________Pa。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有________(填标号)。
A.通入惰性气体B.提高温度
C.增加环戊烯浓度D.增加碘浓度
【答案】40% 3.56×104 BD
【解析】设容器中起始加入I2(g)和环戊烯的物质的量均为a,平衡时转化的环戊烯的物质的量为x,列出三段式:
eq \a\vs4\ac\hs10\c8(,(g),+,I2(g),===,(g),+,2HI(g),起始:,a,,a,,0,,0,转化:,x,,x,,x,,2x,平衡:,a-x,,a-x,,x,,2x)
根据平衡时总压强增加了20%,且恒温恒容时,压强之比等于气体物质的量之比,得eq \f(a+a,(a-x)+(a-x)+x+2x)=eq \f(1,1.2),解得x=0.4a,则环戊烯的转化率为eq \f(0.4a,a)×100%=40%,平衡时(g)、I2(g)、(g)、HI(g)的分压分别为eq \f(p总,4)、eq \f(p总,4)、eq \f(p总,6)、eq \f(p总,3),则Kp=eq \f(\f(p总,6)×(\f(p总,3))2,\f(p总,4)×\f(p总,4))=eq \f(8,27)p总,根据p总=1.2×105 Pa,可得Kp=eq \f(8,27)×1.2×105 Pa≈3.56×104 Pa。通入惰性气体,对反应③的平衡无影响,A项不符合题意;反应③为吸热反应,提高温度,平衡正向移动,可提高环戊烯的平衡转化率,B项符合题意;增加环戊烯浓度,能提高I2(g)的平衡转化率,但环戊烯的平衡转化率降低,C项不符合题意;增加I2(g)的浓度,能提高环戊烯的平衡转化率,D项符合题意。
12.(1)工业合成NH3的反应,解决了世界约三分之一的人粮食问题。已知:N2+3H22NH3,且该反应的v正=k正·c(N2)·c3(H2),v逆=k逆·c2(NH3),则反应eq \f(1,2)N2+eq \f(3,2)H2NH3的平衡常数K=________(用k正和k逆表示)。
(2)500 ℃时,向容积为2 L的密闭容器中通入1 ml N2和3 ml H2,模拟合成氨的反应,容器内的压强随时间的变化如下表所示:
①达到平衡时N2的转化率为________。
②用压强表示该反应的平衡常数Kp=________(Kp等于平衡时生成物分压幂的乘积与反应物分压幂的乘积的比值,某物质的分压等于总压×该物质的物质的量分数)。
③随着反应的进行合成氨的正反应速率与NH3的体积分数的关系如下图所示,若升高温度再次达到平衡时,可能的点为________(从点“A、B、C、D”中选择)
【答案】(1)eq \r(\f(k正,k逆))
(2)①90% ②48 MPa-2 ③A
【解析】
(1)当正、逆反应速率相等时,反应到平衡,即v正=v逆=k正·c(N2)·c3(H2)=k逆·c2(NH3) ,则反应eq \f(1,2)N2+eq \f(3,2)H2((NH3的平衡常数K=eq \r(c2(NH3)/c(N2)·c3(H2))=eq \r(\f(k正,k逆));
(2)假设到平衡时氮气转化浓度为x ml/L,则有
eq \a\vs4\ac\hs10\c6(,N2,+,3H2,,2NH3,,起始浓度/ml/L,0.5,,1.5,,0,改变浓度/ml/L,x,,3x,,2x,平衡浓度/ml/L,0.5-x,,1.5-3x,,2x)
根据压强比等于物质的量比分析,有关系式:eq \f(0.5-x+1.5-3x+2x,0.5+1.5)=eq \f(11,20)
解x=0.45;
①达到平衡时N2的转化率为0.45/0.5×100%=90%;
②用压强表示该反应的平衡常数Kp=eq \f((\f(0.9,1.1)×11 MPa)2,\f(0.05,1.1)×11 MPa×(\f(0.15,1.1)×11 MPa)3)=48 MPa-2;
③合成氨的反应为放热反应,若升温,则反应速率增大,平衡逆向移动,氨气的体积分数减小,可能的点为A。
13.石油化工生产中,利用裂解反应可以获得重要化工原料乙烯、丙烯。一定条件下,正丁烷裂解的主反应如下:
反应Ⅰ C4H10(g) CH4(g)+CH3CH==CH2(g) ΔH1;
反应Ⅱ C4H10(g) C2H6(g)+CH2==CH2(g) ΔH2;
一定温度下,向容积为5 L的密闭容器中通入正丁烷,反应时间(t)与容器内气体总压强(p)数据如下:
若平衡时甲烷、乙烯的体积分数分别为eq \f(2,11)、eq \f(1,4),则该温度下反应Ⅰ的压强平衡常数Kp=________MPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,保留三位有效数字)。
【答案】2.13
【解析】
反应Ⅰ C4H10(g) CH4(g)+CH3CH==CH2(g),平衡时,若平衡时甲烷、乙烯的体积分数分别为eq \f(2,11)、eq \f(1,4),则丙烯和乙烷的体积分数分别为eq \f(2,11)、eq \f(1,4),正丁烷为1-2/11-2/11-1/4-1/4=3/22,Kp=eq \f(8.8×\f(2,11)×8.8×\f(2,11),8.8×\f(3,22))=2.13;
14.某温度下,已知:2SO2(g)+O2(g)2SO3(g) △H1=-196.6kJ/ml。按投料比2:1把SO2和O2加入到一密闭容器中发生反应2SO2(g)+O2(g)2SO3(g) ,测得平衡时SO2的转化率与温度T、压强p的关系如图甲所示:
①A、B两点对应的平衡常数大小关系为KA __________(填“>”“<”或“=”,下同)KB;温度为T,时D点vD正与vD逆的大小关系为vD正 _____________vD逆;
②T1温度下平衡常数Kp=______________ kPa-1(Kp为以分压表示的平衡常数,结果保留分数形式)。
【答案】①> < ②
【解析】①2SO2(g)+O2(g)2SO3(g)反应放热,压强一定时,温度越低,SO2的转化率越大,所以T1<T2,该反应的平衡常数K随温度升高而降低,所以KA>KB;温度为T1时D点SO2的转化率大于平衡转化率,所以反应需要逆向移动达到平衡,即v正<v逆。
②选取C点计算T1温度下的Kp值,设SO2的起始加入量为2ml:
SO2%=,O2%=,SO3%=。由于分压=总压×物质的量分数,所以C平衡点各物质的分压分别为p(SO2)=pc,p(O2)=pc,P(SO3)=pc,Kp=kPa-1。
15.CO2在 Cu-ZnO催化下,同时发生如下反应I,II,是解决温室效应和能源短缺的重要手段。
Ⅰ.CO2(g)+3H2(g)CH3OH (g)+H2O(g) △H10
保持温度T时,在容积不变的密闭容器中,充入一定量的CO2及H2,起始及达平衡时,容器内各气体物质的量及总压强如下表:
若反应I、II均达平衡时,p0=1.4p,则表中n=__________;反应1的平衡常数Kp=____ (kPa)-2。(用含p的式子表示)
【答案】0.2
【解析】
(2)根据表格列出各物质物质的量变化:
Ⅰ CO2(g)+3H2(g)CH3OH (g)+H2O(g) △H10
△n 0.3-n 0.3-n 0.3-n 0.3-n
平衡时各物质的量为:CO2(g):0.5-n-0.3+n=0.2ml H2(g):0.9-3n-0.3+n=0.6-2n
CH3OH (g):n H2O(g):0.3 CO(g):0.3-n
根据T、V一定时,压强比等于物质的量之比计算n
==1.4,计算得出n=0.2;
平衡后物质的总量:0.2+0.6-2×0.2+0.2+0.3+0.3-0.2=1.0ml
平衡后各物质分压: CO2(g):(0.2/1)P=0.2P H2(g) :(0.2/1)P=0.2P CH3OH (g):(0.2/1)P=0.2P H2O(g):(0.3/1)P=0.3P
Kp==
16.(1)活性炭还原NO2的反应为2NO2(g)+2C(s)N2(g)+2CO2(g),在恒温条件下,1 ml NO2和足量活性炭发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
①A、B、C三点中NO2的转化率最高的是__________(填“A”“B”或“C”)点。
②计算C点时该反应的压强平衡常数Kp=________(Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(2)以CO作还原剂与磷石膏反应,不同反应温度下可得到不同的产物。向盛有CaSO4的真空恒容密闭容器中充入CO,反应体系起始总压强为0.1a MPa,不同温度下反应后所得固体成分的物质的量如图所示。在低于800 ℃时主要反应的化学方程式为______________________________;1 150 ℃下,反应CaSO4+COCaO+CO2+SO2达到平衡时,c平衡(SO2)=8.0×10-5 ml·L-1,CO的转化率为80%,则c初始(CO)=________ ml·L-1,该反应的压强平衡常数Kp=________(用含a的代数式表示;用平衡分压代替平衡浓度计算,分压=总压×物质的量分数;忽略副反应)。
【答案】(1)①A ②4 (2)CaSO4+4COCaS+4CO2 1.0×10-4 0.32a
【解析】(1)①增大压强,平衡左移,NO2的转化率减小,所以A点NO2的转化率最高。
②设C点时NO2的浓度为c ml·L-1,则CO2的浓度也为c ml·L-1
2NO2(g)+2C(s)N2(g) + 2CO2(g)
c ml·L-1 eq \f(1,2)c ml·L-1 c ml·L-1
p(NO2)=20 MPa×eq \f(c,\f(5,2)c)=8 MPa
p(N2)=20 MPa×eq \f(\f(1,2)c,\f(5,2)c)=4 MPa
p(CO2)=20 MPa×eq \f(c,\f(5,2)c)=8 MPa
Kp=eq \f(p2(CO2)·p(N2),p2(NO2))=eq \f(82×4,82)=4。
(2)在低于800 ℃时,固体产物为CaS,所以此时反应方程式为CaSO4+4COCaS+4CO2
c初始(CO)=eq \f(8.0×10-5 ml·L-1,80%)=1.0×10-4 ml·L-1
CaSO4+COCaO+CO2 + SO2
平衡(ml·L-1)2.0×10-5 8.0×10-5 8.0×10-5
平衡时总压强:0.1a MPa×eq \f(2.0×10-5+8.0×10-5+8.0×10-5,1.0×10-4)
=0.18a MPa
p(CO2)=p(SO2)=0.18a MPa×eq \f(8.0×10-5,18×10-5)=0.08a MPa
p(CO)=0.18a MPa×eq \f(2.0×10-5,18×10-5)=0.02a MPa
Kp=eq \f(p(SO2)·p(CO2),p(CO))=eq \f(0.08a×0.08a,0.02a)=0.32a。
17.利用废弃的H2S的热分解可生产H2:2H2S(g)2H2(g)+S2(g)。现将0.20 ml H2S(g)通入某恒压(压强p=a MPa)密闭容器中,在不同温度下测得H2S的平衡转化率如图所示:
已知:对于气相反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可表示平衡常数。温度为T4℃时,该反应的平衡常数Kp=________(用含a的代数式表示)。
【答案】eq \f(2a,27) MPa
【解析】由图像可知,温度为T4℃时,H2S平衡转化率为40%,故反应所消耗H2S的物质的量为0.20 ml×40%=0.08 ml,剩余H2S的物质的量为0.20 ml-0.08 ml=0.12 ml,生成H2的物质的量为0.08 ml,生成S2的物质的量为0.04 ml,则p(H2S)=eq \f(a,2) MPa,p(H2)=eq \f(a,3) MPa,p(S2)=eq \f(a,6) MPa,故T4℃时反应的平衡常数Kp=eq \f(\b\lc\(\rc\)(\a\vs4\al\c1(\f(a,3) MPa))\s\up12(2)×\f(a,6) MPa,\b\lc\(\rc\)(\a\vs4\al\c1(\f(a,2) MPa))\s\up12(2))=eq \f(2a,27) MPa。
t/min
0.00
1.00
2.00
3.00
4.00
5.00
c(N2O5)/(m·L-1)
1.00
0.71
0.50
0.35
0.35
0.35
时间/min
0
10
20
30
40
+∞
压强/MPa
20
17
15
13.2
11
11
t/min
0
a
2a
3a
4a
p/MPa
5
7.2
8.4
8.8
8.8
相关试卷
这是一份专题复习 高考化学 考点43 电离平衡常数及相关计算 讲义,共13页。试卷主要包含了表达式,意义,特点,影响因素,电离常数的三大应用,电离平衡常数相关计算等内容,欢迎下载使用。
这是一份高考化学微专题小练习专练37化学平衡常数及转化率的计算含答案,共8页。
这是一份高考化学二轮专题大题练习专题31《化学平衡常数及化学平衡相关计算》(含详解),共8页。









