

所属成套资源:2021年浙教版中考科学重难点+易错点复习练习
质量守恒定律应用(7个考点)-2021年中考科学(浙教版)重难点、易错点复习练习(教育机构专用)
展开
这是一份质量守恒定律应用(7个考点)-2021年中考科学(浙教版)重难点、易错点复习练习(教育机构专用),共19页。试卷主要包含了根据守恒定律写化学方程式,根据事实与信息写化学方程式,已知反应物求生成物或另一反应物,根据生成物求反应物或另一生成物,有关不纯反应物或生成物的计算,质量守恒定律的验证与探究等内容,欢迎下载使用。
2020走进重高-尖子生培优集训
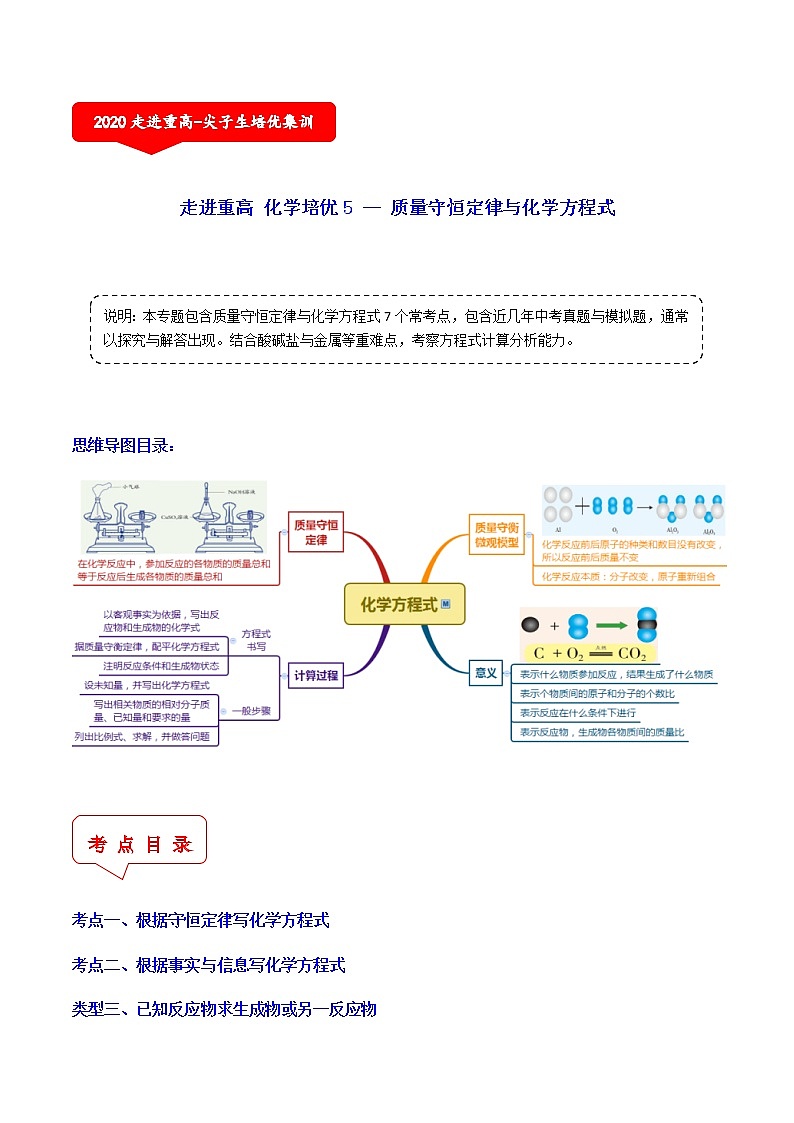
走进重高 化学培优5 -- 质量守恒定律与化学方程式
说明:本专题包含质量守恒定律与化学方程式7个常考点,包含近几年中考真题与模拟题,通常以探究与解答出现。结合酸碱盐与金属等重难点,考察方程式计算分析能力。
思维导图目录:
考 点 目 录
考点一、根据守恒定律写化学方程式
考点二、根据事实与信息写化学方程式
类型三、已知反应物求生成物或另一反应物
类型四、根据生成物求反应物或另一生成物
类型五、有关不纯反应物或生成物的计算
类型六、质量守恒定律在化学方程式计算中的应用
考点七、质量守恒定律的验证与探究
习 题 集 训
考点一、根据守恒定律写化学方程式
1.[2018·黄石]下列化学方程式书写正确的是( B )
A.2Fe+6HCl===2FeCl2+H2↑
B.ZnO+H2SO4===ZnSO4+H2O
C.CO2+CCO
D.CuSO4+NaOH===Cu(OH)2↓+Na2SO4
【解析】A选项化学方程式配平后应为:Fe+2HCl===FeCl2+H2↑。C选项CO前的系数应为2。D选项NaOH前的系数应为2。
2﹒[2018]化学方程式a C2H2+b O2 点燃 c H2O+d CO2配平后a、b、c、d数值为( A )
A.2、5、2、4 B.1、2、1、2 C.4、5、2、4 D.1、3、1、2
3.[广东中考]现有反应:2Cu(NO3)2 △ 2CuO+O2↑+4X↑,则X的化学式为( B )
A.NO B.NO2 C.NH3 D.N2O3
4.[2018中考]NH4ClO4可用作火箭推进剂,当它发生分解反应时,不能生成的物质是( A )
A. CO2 B.Cl2 C.O2 D. N2
5.[2018]下列关于化学反应“X2+3Y2===2Z”的叙述正确的是 ( C )
A.Z的化学式为X2Y3
B.若有a g X2 完全反应,生成b g Z,则同时消耗(2b-a)g Y2
C.m g X2 和n g Y2 恰好完全反应,则一定生成(m+n)g Z
D.若X2 和Y2的相对分子质量分别为M和N,则Z的相对分子质量为(M+N)
6.[2018·杭州余杭区一模]在一定条件下,甲、乙能反应生成丙、丁,如图是该反应的化学微观模型,下列说法错误的是( B )
A.氮元素的化合价从-3价变成0价
B.甲、乙、丁是氧化物
C.该反应遵循质量守恒定律
D.该反应是置换反应
7.[2019]在X+2O2CO2+2H2O中,根据质量守恒定律,X的化学式为( A )
A.CH4 B.C2H5OH C.CH3OH D.CH3COOH
【解析】从微观上看,质量守恒定律在一切化学反应中都成立是因为在反应前后原子的种类和数目都不变,所以我们可以根据它来解此题。依据质量守恒定律,X分子与O2分子中的原子种类和数目一定与CO2和H2O中的相同。在生成物中共有1个碳原子、4个氢原子和4个氧原子,反应物中2个氧分子有4个氧原子,所以推断出:在1个X分子中有1个碳原子、4个氢原子,而没有氧原子,X的化学式为CH4。
8﹒[2019]全球能源生产正向“氢能经济”转型,以可再生生物资源(如纤维素)等为原料生产氢气已成为能源研究的重点。如图是某新型能源转换与利用模式示意图。
某有机物水相重整制取氢气分两步进行反应,其中第一步反应可表示为:CxHyOz→CO+H2(未配平),则x:z的值为( B )
A.1:2 B.1:1 C.2:1 D.任意比
考点二、根据事实与信息写化学方程式
1.[巴中中考]下列反应的化学方程式书写完全正确的是 ( B )
A.铁在氧气中燃烧:2Fe+3O22Fe2O3
B.盐酸除铁锈:Fe2O3+6HCl===2FeCl3+3H2O
C.密闭容器中燃烧红磷验证质量守恒定律:P+O2P2O5
D.CO还原氧化铁:Fe2O3+3CO===2Fe+3CO2
2、用粮食作原料酿酒时,往往发现制得的酒发酸,这实际上是因为酒精(C2H5OH)在酶的作用下与空气中的氧气作用,生成了醋酸(CH3COOH)和水,请你写出该反应的化学方程式为 。
【答案】C2H5OH + O2 酶 CH3COOH + H2O
3、哥伦比亚号航天飞机曾用金属铝和高氯酸铵(NH4ClO4)的混合物作为固体燃料。加热铝粉使其被氧气氧化,放出大量的热,促使混合物中的高氯酸铵受热分解,同时生成四种气体:两种气体是空气中的主要成分,一种气体是Cl2,还有一种气体是化合物(常温下是液态),因而产生巨大的推动力。试写出其中涉及的化学方程式:
⑴、铝粉被氧气氧化成三氧化二铝: ;⑵、高氯酸铵受热分解: ;
【答案】 4Al + 3O2 ==== 2Al2O3 2NH4ClO4 △ N2↑ + Cl2↑ + 2O2↑ + 4H2O
4、在通常情况下,碳单质的化学性质稳定,但它在常温下可与一种叫高氯酸的物质发生反石墨,产物除水是液体外,其余都是气体,一种是有毒的氯气(Cl2),一种是无色无毒的化合物。请写出此反应的化学方程式: 。
【答案】 7C + 4HClO4 ==== 2Cl2↑ + 7CO2↑ + 2H2O
5.[2018·苏州]根据下列反应事实写出相应的化学方程式。
(1)稀硫酸与锌粒反应制氢气:__Zn+H2SO4===ZnSO4+H2↑__。
(2)金属铝与氧气反应生成氧化膜:__4Al+3O2===2Al2O3__。
(3)碳酸钙在高温下分解:__CaCO3CaO+CO2↑__。
(4)石灰水与硫酸铜溶液反应:__Ca(OH)2+CuSO4===Cu(OH)2↓+CaSO4__。
(5)甲烷在足量氧气中充分燃烧:__CH4+2O2CO2+2H2O__。
【解析】此题是对化学方程式的考查,有置换反应、分解反应、化合反应、复分解反应(还有未来高中所涉及到的氧化还原反应),要注意一些细节部分:反应的条件、化学方程式的配平及沉淀或气体符号的标注等。铝常温下就能被氧气氧化。
类型三、已知反应物求生成物或另一反应物
1.[2018·昆明]在一密闭容器中加入a、b、c、d四种物质,测得反应前后各物质的质量如表。
物质
a
b
c
d
反应前的质量(g)
40
40
10
32
反应后的质量(g)
12
x
10
0
下列说法正确的是 ( D )
A.x等于90
B.b可能是单质
C.c一定是催化剂
D.参加反应的a与d的质量比为7∶8
【解析】根据质量守恒定律,在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和。x=40+40+32+10-12-10=100;故a、d为反应物,b为生成物,该反应为化合反应,故b为化合物;c的质量不变,可能为催化剂;参加反应的a与d的质量比为(40-12)∶32=7∶8。
2.水通电生成氢气和氧气,其反应的化学方程式为:2H2O 通电 2H2↑+O2↑,试计算:
(1)该反应中H2O、H2、O2微粒的个数比为 2:2:1 ;
(2)该反应中H2O、H2、O2的质量比为 9:1:8 ;
(3)如果18g水通电全部分解,可得到氧气16g,同时得到氢气 2 g;
(4)如果72g水通电全部分解,可得到氢气 8 g;
(5)要得到1g氢气,需要分解水的质量是 9 g;
3.工厂烟气脱硫工艺,不仅能消除二氧化硫,还能将其转化为硫酸钙(CaSO4)等产品,实现“变废为宝”。反应的化学方程式为:2CaCO3+O2+2SO2 高温2CaSO4+2CO2,现用1.25 t含碳酸钙80%的石灰石吸收烟气中的二氧化硫。求:
(1)石灰石中碳酸钙的质量?(2)可吸收二氧化硫的质量?
【答案】(1)碳酸钙的质量=1.25t×80% = 1t
(2)设可吸收二氧化硫的质量为x。
2CaCO3 + 2SO2 + O2 高温 2CaSO4 + 2CO2
200 128
1t x
200 ∶128 = 1t ∶x x=0.64t答: 可吸收二氧化硫的质量为0.64t。
类型四、根据生成物求反应物或另一生成物
1、在“绿色氧化剂”双氧水(H2O2)的溶液中加入二氧化锰后,常温下即可产生大量氧气。
(1)若制取48g氧气需消耗纯净的双氧水多少克?
(2)如实验室里制取时用20%的双氧水,双氧水的实际质量是多少?
【答案】102g 610g
2、氢气跟氧化铜反应的化学方程式为:H2+CuO====Cu+H2O 现在要想得到12.8克铜,问需要氧化铜多少?同时参加反应的氢气又是多少?这些氢气在标准状况下占多大的体积?(ρH2=0.09克/升)
【答案】16g 0.4g 4.4L
3.[2018·昆明]已知:Si+2NaOH+H2O===Na2SiO3+2H2↑,向100g NaOH溶液中加入足量Si,充分反应后生成0.4g H2。求:
(1)参加反应的Si的质量。
(2)该NaOH溶液中溶质的质量分数。
【答案】设参加反应的Si质量为x,该NaOH溶液中溶质的质量分数为y,
Si+2NaOH+H2O===Na2SiO3+2H2↑
28 80 4
x 100g×y 0.4g
==,
解得x=2.8g,y=8%,
所以参加反应的Si质量为2.8g,该NaOH溶液中溶质的质量分数为8%。
4、现有氯酸钾和二氧化锰的混合物15克,加热使它完全反应,结果发现试管内固体质量比原来减少了4.8克。求:(1)生成氧气多少克?(2)充分反应后,试管内有哪些物质?各多少克?(3)原混合物中氯酸钾的质量分数为多少?
【答案】生成氧气4.8g,氯化钾的质量为7.45g,二氧化锰的质量为2.75g.(3)81.7%
类型五、有关不纯反应物或生成物的计算
1、把17.5g干燥纯净的氯酸钾和3.25g克二氧化锰充分混合后装入大试管,给试管加热一段时间后中止反应,等试管冷却后,称量,得15.95g固体物质。求反应中制得的氧气多少克和氯酸钾分解的百分率?
【答案】设反应的氯酸钾质量为x,
反应生成氧气的质量为:17.5g+3.25g-15.95g=4.8g,
2KClO3 MnO2 加热 2KCl+3O2↑
245 96
X 4.8g x=12.25g
氯酸钾分解的百分率为12.25/17.5=70%:
答:反应生成了4.8g氧气,氯酸钾分解的百分率是70%.
2.将由氯酸钾和二氧化锰组成的混合物25克加热一段时间后,停止加热,冷却后称得剩余固体为25.2克,经分析,在剩余固体中,二氧化锰的质量分数为25%,求:
(1)生成的氧气的质量; (2)原混合物中二氧化锰的质量;
(3)剩余固体中有多少质量的氯化钾?
【答案】4.8g 5.05g 7.45g
3.[2018·铜仁]FeCl2溶液中混有少量的CuCl2,为了除去CuCl2,某课外小组同学取该溶液50g于烧杯中,然后分5次等量加入某物质M充分反应,所得数据如表,请根据相关知识和数据回答下列问题:
次数
1
2
3
4
5
加入M的质量(g)
0.28
0.28
0.28
0.28
0.28
溶液的总质量(g)
49.96
49.92
49.88
49.84
49.84
(1)写出物质M的化学式:__Fe__。
(2)参加反应M的总质量是多少?
(3)FeCl2溶液中CuCl2的质量分数是多少?
【答案】设参加反应的铁粉的总质量为x,溶液中CuCl2的质量分数是y,
Fe+CuCl2===FeCl2+Cu
56 135 127
x 50g×y 50g×y-(50g-49.84g)
==,
解得x=1.12g,y=5.4%,
所以参加反应的铁粉的总质量为1.12g,FeCl2溶液中CuCl2的质量分数是5.4%。
【解析】(1)要除去FeCl2溶液中混有的少量CuCl2,只能选用铁粉。(3)整个过程中溶液减少的质量即为CuCl2转化为FeCl2所减少的质量。
类型六、质量守恒定律在化学方程式计算中的应用
1.[成都中考]用如图所示装置验证质量守恒定律,能达到实验目的的物质组合是( C )
A.锌和稀硫酸
B.碳酸钠和稀盐酸
C.铁和硫酸铜溶液
D.氯化钠和稀盐酸
【解析】锌和稀硫酸反应有氢气生成,碳酸钠和稀盐酸反应有二氧化碳产生,气体会逸出烧杯,故两者都不可以达到实验目的;铁和硫酸铜溶液无气体参加反应,也无气体生成,反应前后质量不变,能用图示装置验证质量守恒定律;氯化钠和稀盐酸之间不发生化学反应,故也不能达到目的。
3.[扬州中考]某实验过程如下:取a g锡粉置于密闭容器中,称得容器和固体的总质量为b g,煅烧使锡粉与O2充分反应;冷却后打开容器时发现有空气冲入,待容器内气体组成恢复到反应前,称得容器和固体的总质量为c g;取出所有固体,称得固体为d g,则c( D )
A.d+b+a B.d-b-a C.d-b+a D.d+b-a
【解析】根据题意,参加反应的氧气为c g-b g。根据质量守恒定律可知,d g=a g+(c g-b g),则c=d+b-a。
4.[2018·嘉兴舟山]化学反应的实质是构成物质分子的原子重新进行组合,形成新分子的过程。如图是在密闭容器中某化学反应过程的微观示意图。据图回答:
(1)参加反应的“”与“”的分子个数比为__2∶1__。
(2)该反应的基本反应类型是__化合反应__。
5、“史上最贵”的实验:步骤Ⅰ:让金刚石(C)在充足的氧气中燃烧,收集生成的气体。步骤Ⅱ:让足量镁条在步骤Ⅰ生成的气体中燃烧,生成黑色的炭粉和白色的固体氧化物。若金刚石质量为m1,按上述步骤反应且转化完全,生成的炭粉质量为m2,则(选填“”)m1 = m2,理由为 物质转花过程中质量守恒 。
6.判断下列有关质量守恒定律的说法是否正确:
(1)2g食盐完全溶于10g水中得到12g食盐水,该变化符合质量守恒定律; 错 (判断对错)
(2)煤燃烧后,剩余煤灰的质量比原来减轻了,该反应不符合质量守恒定律; 错 (判断对错)
(3)ag硫与bg氧气充分反应,一定生成(a+b)g二氧化硫; 错 (判断对错)
7.[2018·杭州江干区三模]甲同学取某种氧化铜与炭粉的混合物样品 a g,加强热充分反应后,发现生成的气体不能使澄清石灰水变浑浊。再将反应后的固体与足量的稀硝酸微热[已知3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O,且炭粉不与稀硝酸反应],充分反应后,有b g固体剩余。该混合物样品加强热时发生的化学反应方程式为__CuO+C △ Cu+CO__。参加反应的氧化铜和炭粉的总质量为__a-b__ g(以含a、b的代数式表示)。
【解析】氧化铜与炭粉加强热充分反应,产物只能是铜和碳的氧化物,生成的气体不能使澄清石灰水变浑浊,则产生的气体为CO。炭粉过量,则氧化铜完全反应。
8.[2018·昆明]金属钛被用于航空航天工业、化工、医疗等领域。用钛铁矿(主要成分为FeTiO3)制取钛并获得副产品A的主要工艺流程如下:
(1)反应①的化学方程式为__H2TiO3 △ H2O+TiO2__。
(2)TiO2与焦炭(C)和Cl2在高温下反应,该反应中C和Cl2按质量比为12∶71的比例参加反应,相应的化学方程式为__TiO2+2C+2Cl2TiCl4+2CO__。
(3)反应②的产物除红色固体A外,还有两种组成元素相同且相对分子质量相差16的气体。则该反应的化学方程式为__2FeSO4Fe2O3+SO2↑+SO3↑__。
【解析】根据反应物、生成物、反应条件及质量守恒定律与化学方程式的相关书写规则解答。(1)反应①中,H2TiO3分解生成水和二氧化钛,反应的化学方程式为H2TiO3 △ H2O+TiO2。(2)该反应中C和Cl2按质量比为12∶71的比例参加反应,则化学方程式中碳和氯气的系数之比为∶=1∶1,相应的化学方程式为TiO2+2C+2Cl2TiCl4+2CO。(3)反应②中的红色固体是氧化铁,两种组成元素相同且相对分子质量相差16的气体分别是二氧化硫和三氧化硫,则该反应的化学方程式为2FeSO4Fe2O3+SO2↑+SO3↑。
9.[衢州中考]有一种管道疏通剂,主要成分为铝粉和氢氧化钠混合粉末。工业原理是:利用铝和氢氧化钠遇水反应放出大量的热,加快氢氧化钠对毛发等淤积物的腐蚀,同时产生氢气增加管道内的气压,利于疏通。小柯利用如图装置测定疏通剂中铝的质量分数。
Ⅰ.取样品20g,倒入容积为200mL的锥形瓶中,然后在分液漏斗中加入水,置于电子天平上测出总质量m1。
Ⅱ.打开活塞,加入足量的水充分反应,直到没有固体剩余,静置一段时间,测出总质量m2。
Ⅲ.实验数据如表。
反应前总质量m1
反应后总质量m2
371.84g
371.24g
回答下列问题:
(1)配平化学方程式:2Al+2NaOH+2H2O===__2__NaAlO2+3H2↑
(2)根据化学方程式计算样品中铝的质量分数。
(3)以下情形会导致样品中铝的质量分数测量结果偏高的是__BC__。
A.向锥形瓶中倒入样品时,撒出了部分粉末
B.在反应过程中有水蒸气逸出
C.没有等装置中氢气全部排尽就称量
【答案】(2)反应产生的氢气质量为371.84g-371.24g=0.6g,
设参加反应的铝质量为x,
2Al+2NaOH+2H2O===2NaAlO2+3H2↑
54 6
x 0.6g =,解得x=5.4g,
样品中铝的质量分数:Al%=×100%=27%。
【解析】(3)向锥形瓶中倒入样品时,撒出了部分粉末,导致产生气体少,而计算时样品的质量依旧按照20g计算,所以偏低。反应过程中有水蒸气逸出,会使测定的氢气的质量变大,求出铝的质量偏大,会使测量结果偏高。氢气未排尽,留在装置中,相比于原来的空气,装置质量减小了,得到氢气的质量增加致使铝的质量分数计算结果偏高。
考点七、质量守恒定律的验证与探究
1.[衢州中考]质量守恒定律是自然界最基本的规律之一。下列装置及实验(天平未画出)能用来验证质量守恒定律的是 ( A )
A B C D
【解析】质量守恒定律只研究化学变化质量问题,物理变化不能用质量守恒定律解释。硝酸银和盐酸反应生成氯化银沉淀和硝酸,可以用来验证质量守恒定律;B实验中没有发生化学变化;C、D实验没有在密闭容器内进行,不能用来验证质量守恒定律。
2、[2018中考]某同学在研究质量守恒定律的实验过程中,记录下了如下数据:
Fe+S=FeS(反应需要加热)
第一次
第二次
第三次
硫粉的质量(克)
16
32
32
铁粉的质量(克)
28
28
56
硫化亚铁的质量(克)
44
44
88
(1)这三次实验中,从数据来看,哪几次符合质量守恒定律?
(2)第二次实验是否符合质量守恒定律? ,说明原因。
通过实验说明,参加反应的各物质质量之间存在着比例关系 。从上可知,参加反应的铁和硫的质量比为 。
( 4 )若该同学要进行第四次试验,如果要将48g硫粉完全反应,则需要铁粉多少?能生成硫化亚铁多少?
【解析】质量守恒定律是指参加反应的各物质质量总和等于反应生成的各物质质量总和。
(1)这三次实验中,从数据来看,第- -次中16+28=44,,第二次中32+28=60≠44,第三次中32+56=88 ,所以但从数据看,第一次和第三次符合质量守恒定律,第二次不符合;
(2 )根据所有化学反应都符合质量守恒定律判断,第二次试验也符合质量守恒定律。两数据相加不等,是因为硫过量;
(3)通过实验说明,参加反应的铁和硫的质量比=28:16=56:32=7:4 ;
(4)根据反应中硫和铁的质量比关系,如果要将48g硫粉完全反应,则需要铁粉的质量= 48gx7/4=84g ;能生成硫化亚铁的质量= 48g+84g= 132g.
【答案】(1)第一次和第三次 (2)符合 所有化学反应都符合质量守恒定律
(3)7:4 (4)84g 132g
3.[随州中考]小李用盐酸与碳酸钙粉末反应验证质量守恒定律,实验装置 如图:
(1)根据实验目的,小李必须测量的数据是__CD__。
A.锥形瓶质量
B.气球质量
C.反应前整个反应装置(包括里边的物质)质量
D.反应后整个反应装置(包括里边的物质)质量
(2)将反应装置放在天平左盘,使天平平衡后,再将碳酸钙粉末倒入锥形瓶中。反应结束后,气球鼓起,天平向右倾斜。小李按规范操作重新实验,得到相同结果。请你帮他分析原因:__气球膨胀,受到的浮力增大(或装置漏气)__。
(3)反应结束后,锥形瓶中无固体剩余,则生成气体质量__0.88__g,所得溶液中生成物的溶质质量分数(只需写出最终的计算表达式): 。
【解析】(3)设生成二氧化碳的质量为x,生成的氯化钙的质量为y,
CaCO3+2HCl===CaCl2+H2O+CO2↑
100 111 44
2g y x
=,=,解得x=0.88g,y=2.22g,
所得溶液中生成物的溶质质量分数为×100%。
4.[淮安中考]质量守恒定律的发现对科学的发展作出了巨大贡献。
(1)为验证质量守恒定律,小华设计如图甲所示装置进行实验。实验时,先将装有药品的装置放在天平上,添加砝码,移动游码至天平平衡(如图甲所示),然后取下装置,用针筒向锥形瓶中注入少量稀盐酸,反应后再将装置放置于天平上,观察到__天平平衡__,从而验证了质量守恒定律。若将锥形瓶改为烧杯,则不能验证质量守恒定律,原因是_装置没有密闭,气体逸出_。
(2)某反应的微观示意图如图乙所示。
①X的化学式是__SO2__。
②根据上述微观示意图,可得出化学反应遵循质量守恒定律的本质原因是 __化学反应前后,原子不变(或原子的种类和数目不变)__。
5.[2018中考]为了探究物质在化学变化时,参加反应的反应物总质量与生成物总质量是否相等.某校甲、乙两个兴趣小组分别设计了如图的实验来验证自己的假设.
[进行实验]
如图所示,甲小组把盛有适量CuSO4溶液的小试管放入盛有石灰水的烧杯中,乙小组把盛有适量Na2CO3溶液的小试管放入盛有稀盐酸的烧杯中;然后将烧杯放到天平上,用砝码平衡;接着取下烧杯并将其倾斜,使试管内和烧杯内的两种溶液混合发生反应,待反应后再把烧杯放到天平上,观察天平是否平衡.
根据要求,请回答:
[实验现象]
反应后,甲小组的天平指针指向刻度盘的 。
乙小组的天平指针指向刻度盘的 。(选填“左边”、“右边”或“中间”)
[解释与结论]
甲小组的结论为:
乙小组的解释为:
[反思与评价]
比较两个小组的实验设计,若使用的试剂不变,应改进的是:
由此,你将得出新的结论:探究或验证反应物与生成物的质量关系时,若要用到有气体参加或生成的反应
【答案】[实验现象] 中间;右边;
[解释与结论] 参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和;反应中有二氧化碳气体生成,从烧杯中跑出去了,因此烧杯内总质量会减少;
[反思与评价]
将乙小组中的烧杯改成密闭容器或使用气球作为缓冲装置;有气体参加或生成时,应该在密闭容器中进行实验。
[实验现象]
由于甲小组用铁与硫酸铜反应,生成硫酸钙和氢氧化铜,没有物质散失,质量不变天平指针指向刻度盘的中间;乙小组用的是稀盐酸和碳酸钠反应生成了氯化钠、水、二氧化碳,有气体跑出质量减少,指针指向刻度盘的右边;
[解释与结论]
甲小组天平平衡说明参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和;乙小组质量不相等是因为反应中有二氧化碳气体生成,从烧杯中跑出去了,因此烧杯内总质量会减少;
[反思与评价]
乙小组的反应有气体逸出,改进的方法是将乙小组中的烧杯改为密闭容器或使用气球作为缓冲装置;由此,得出结论:探究或验证反应物与生成物的质量关系时,若要遇到有气体参加或生成时,应该在密闭容器中进行实验。
6.[杭州中考]小金进行如图所示实验来验证质量守恒定律。在实验中用电子天平和量筒准确测量出表中m1、m2、m3、m4和V。(实验中操作正确,O2的密度为ρ g/cm3)
实验序号
1
2
…
m1(MnO2)(g)
m2(KClO3)(g)
m3(试管)(g)
m4(试管+加热后剩余固体)(g)
量筒内收集气体的体积V(cm3)
(1)装置中试管口略向下倾斜的原因是__防止冷凝水倒流引起试管炸裂__。
(2)根据质量守恒定律,m1、m2、m3、m4、V和ρ 之间应存在的等量关系为 __m1+m2+m3-m4=ρV__。
(3)每次实验结束后,小金在拆卸装置时总能闻到刺激性气味。他将加热后剩余固体中的MnO2分离并测量其质量,发现总小于加热前MnO2的质量。查阅资料后发现,一般认为加热KClO3和MnO2混合物的反应过程如下:
第1步:2MnO2+2KClO3 △ 2KMnO4+Cl2↑+O2↑;(其中Cl2有刺激性气味)
第2步:2KMnO4 △ K2MnO4+MnO2+O2↑;
第3步:K2MnO4+Cl2 △ 2KCl+MnO2+O2↑。
写出加热后剩余固体中MnO2质量小于加热前MnO2质量的原因:部分Cl2散失,未参加后续反应,导致部分锰元素以K2MnO4或KMnO4形式存在,故剩余固体中MnO2质量小于加热前MnO2质量(合理即可) 。
相关试卷
这是一份压力与压强(7个考点)-2021年中考科学(浙教版)重难点、易错点复习练习(教育机构专用),共29页。试卷主要包含了液体压强及探究影响因素,大气压的测量,大气压强计算及应用,压强的综合计算与实验探究等内容,欢迎下载使用。
这是一份植物与土壤(6个考点)-2021年中考科学(浙教版)重难点、易错点复习练习(教育机构专用),共22页。试卷主要包含了下列植物全部属于须根系的一组是,下列有关植物根尖的说法正确的是等内容,欢迎下载使用。
这是一份酸和碱 实验与探究(7个考点)-2021年中考科学(浙教版)重难点、易错点复习练习(教育机构专用),共40页。试卷主要包含了酸碱性与酸碱度,PH测量,常见酸的性质,常见碱的性质,酸与碱的中和反应,实验探究,与酸碱有关反应的实验与探究,与酸碱有关反应的计算,图形代表的含义等内容,欢迎下载使用。









