





初中化学人教版九年级下册实验活动6 酸、碱的化学性质教学演示课件ppt
展开1、紫色石蕊溶液遇酸溶液变成 色,遇碱溶液变成 色;无色酚酞溶液遇酸溶液 色,遇碱溶液变成 色。2、写出常见酸的化学式:盐酸 ;硫酸 ;硝酸 ;醋酸 ;碳酸 。3、写出常见碱的化学式:氢氧化钠 ;氢氧化钙 ;氢氧化钾 ;氨水 。4、氢氧化钠俗名 、 、 ;氢氧化钙俗名 、 。5、实验室常用来做干燥剂的酸是 (不能干燥 举一例);碱是 ;氧化物是 (这两者不能干燥 、 、 举三例)。
二.归纳酸、碱的化学性质1、酸的化学性质:(以盐酸为例)(能与盐酸反应的物质用“——”进行连接,下同) HCl 石蕊 Fe Cu Fe2O3 H2SO4 NaOH CuSO4 Na2CO3
请写出相关的化学方程式:① ,② ,③ ,④ .◆酸具有相似化学性质是由于酸溶液中都具有相同的 。
一.归纳酸、碱的化学性质1、酸的化学性质:(以盐酸为例:)(能与盐酸反应的物质用“——”进行连接,下同) HCl 石蕊 Fe Cu Fe2O3 H2SO4 NaOH CuSO4 Na2CO3
根据以上信息归纳酸的化学性质
1、酸能与指示剂作用
2、酸+活泼金属---盐+氢气
3、酸+金属氧化物---盐+水
4、酸+碱---盐+水
5、酸+盐---另一种酸+另一种盐
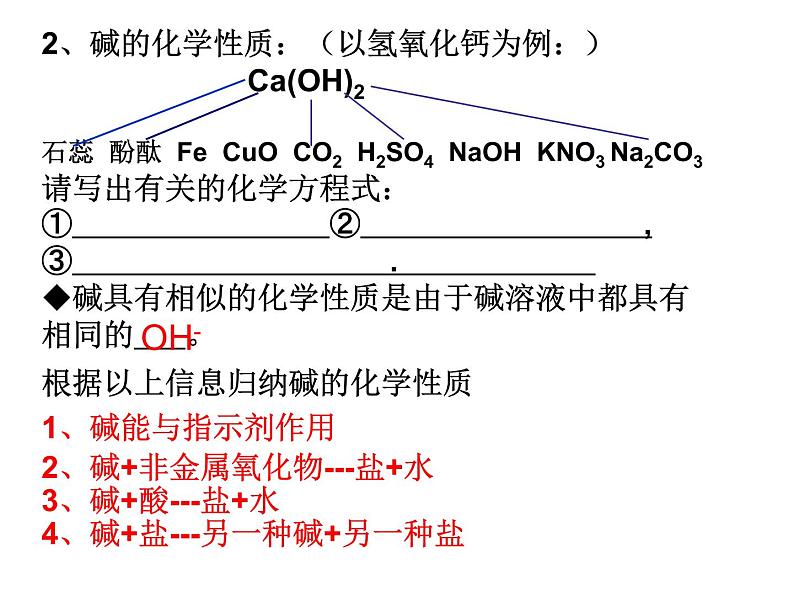
2、碱的化学性质:(以氢氧化钙为例:) Ca(OH)2石蕊 酚酞 Fe CuO CO2 H2SO4 NaOH KNO3 Na2CO3请写出有关的化学方程式:① ② ,③ . ◆碱具有相似的化学性质是由于碱溶液中都具有相同的 。
根据以上信息归纳碱的化学性质
2、碱+非金属氧化物---盐+水
3、碱+酸---盐+水
4、碱+盐---另一种碱+另一种盐
三、酸、碱化学性质的应用
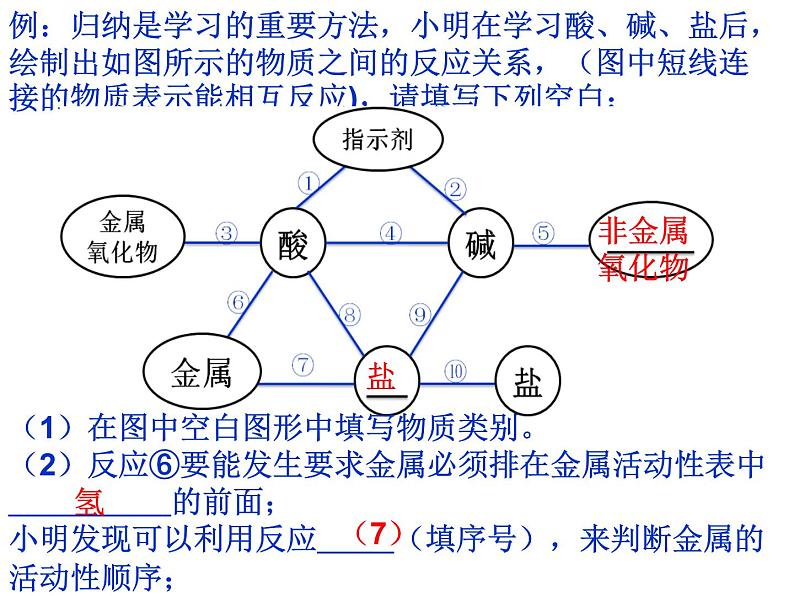
例:归纳是学习的重要方法,小明在学习酸、碱、盐后,绘制出如图所示的物质之间的反应关系,(图中短线连接的物质表示能相互反应),请填写下列空白:
(1)在图中空白图形中填写物质类别。(2)反应⑥要能发生要求金属必须排在金属活动性表中 的前面;小明发现可以利用反应 (填序号),来判断金属的活动性顺序;
(3) 属于置换反应的有反应 (填序号,下同);属于复分解反应的有 反应;(4)热水瓶用久后,瓶胆内壁常附着一层水垢【主要成分是CaCO3和Mg(OH)2】,请你写出除垢符合反应④的化学方程式 。
(3)(4)(8)(9)(10)
Mg(OH)2+2HCl=MgCl2+H2O
(5)验证反应⑨,可以选择下列 (两种物质序号)进行反应 A.Na2SO4 B.KNO3 C.Ba(OH)2 D.NaOH验证反应⑩,可以选择下列 (两种物质序号)进行反应A、BaCO3 B、Na2CO3C、CaCl2 D、Ca(OH)2
(6)盐酸或硫酸常用作金属表面的清洁剂是利用了酸的化学性质中的反应 (填序号),请你用化学方程式举一例 .(7)能生成水和盐的反应有 .
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
(8)向一瓶无色透明的溶液中滴加两滴无色酚酞溶液,溶液变红,说明该溶液是( )A、酸的水溶液 B、碱的水溶液 C、碱性溶液 D、酸性溶液
练1:向盛有酚酞和氢氧化钠溶液的烧杯中滴加稀硫酸,直至液体呈无色。为探究反应后溶液中溶质的组成,所选试剂不正确的是 ( )A、紫色石蕊溶液 B、锌粒C、氧化铜 D、氢氧化铜 E、碳酸钠 F、稀盐酸
分析1:溶质的组成有几种可能?
分析2:两种组成的差异是是否含有酸,因此解答这题从酸的化学性质来考虑。
练2.通过学习碱的性质,我校化学兴趣小组的同学对实验室的“氢氧化钙是否变质以及变持的程度”展开了探究活动,请你一同参与: ⑴提出问题:氢氧化钙是否变质?⑵猜想与假设:没有变质;部分变质;完全变质。
如何判断NaOH的这三种情况?
1、有三瓶失去标签的无色溶液A、B、C,已知它们分别是Ca(OH)2、HCl、NaCl中的一种,你能一次性鉴别他们吗?
只给你无色酚酞溶液你能把以上三种物质鉴别出来吗?
装入C试管内的液体是Ca(OH)2
装入A试管内的 液体是NaCl
装入B试管内的液体是HCl
只给你氯化镁溶液你能把以上三种物质鉴别出来吗?
6、用浓硫酸、浓盐酸、NaOH溶液、Ca(OH)2溶液填空:⑴敞口放置溶液质量减少的是 ;其中发生物理变化的是 ,发生化学变化的是 。⑵敞口放置溶液质量增加的是 ;其中发生物理变化的是 ,发生化学变化的是 。
浓盐酸、Ca(OH)2溶液
7.实验小组探究盐酸和氢氧化钠反应过程中溶液pH的变化规律,得到如图所示曲线。⑴该实验是将 溶液滴入 中;⑵ 点表示盐酸和氢氧化钠恰好完全反应;⑶三点中 点时的溶液能使酚酞试液变红⑷C点时,溶液中的溶质有 。
9.下列对露置在空气中已部分变质的氢氧化钠溶液样品进行的相关实验中,实验现象及结论合理的是 A.取少量溶液样品,滴入氯化钡溶液,有白色沉淀生成 B.取一定量溶液样品,滴入稀盐酸,立即有大量气体产生 C.取一定量溶液样品,滴入适量的澄清石灰水,过滤,向滤液中滴加酚酞溶液,溶液变红,证明原样品中含有氢氧化钠 D.向溶液样品中加入适量的澄清石灰水至恰好完全反应,过滤,可除去样品中的杂质
Na2CO3 + BaCl2 = BaCO3↓ + 2NaCl
Na2CO3 + Ca(OH)2 = CaCO3↓ + 2NaOH
2NaOH + CO2 = Na2CO3 + H2O
5、完成下列化学方程式(有些空格不止一个答案,你还能想到其他的答案吗?)1) +2HCl= + CO2↑+ ; + H2SO4=MgSO4+ ;2)Ca(OH)2+ = CaCO3↓+ ; NaOH+ = +H2O
8.除去下列物质中混有的少量杂质(括号内为杂质),所用方法正确的是A.CO2(CO)——通入氧气中点燃B.SO2(HCl)——通过足量的氢氧化钠溶液C.KCl固体 (KClO3)——加少量二氧化锰固体并加热D.NaCl溶液(NaHCO3)——滴加入稀盐酸至恰好完全反应
2NaOH + SO2 = Na2SO3 + H2O
3、盐的化学性质:(以碳酸钠为例:) Na2CO3Cu Zn CuO HCl NaOH BaCl2 若改用CuSO4呢?
根据以上信息归纳盐的化学性质
请写出相关的化学方程式:① ① .② ② . ③ .
1、盐(溶液)+金属---另一种金属+另一种盐(溶液)
2、盐+酸---另一种盐+另一种酸
3、盐+碱---另一种盐+另一种碱
4、盐+盐---两种新盐
15.通过学习碱的性质,我校化学兴趣小组的同学对实验室的“氢氧化钙是否变质以及变持的程度”展开了探究活动,请你一同参与: ⑴提出问题:氢氧化钙是否变质?⑵猜想与假设:没有变质;部分变质;完全变质。
14.下图中每条直线两端的物质在一定条件下都可以发生化学反应。其中甲、乙、丙、丁分别为Mg、BaCl2、Na2CO3、盐酸四种物质中的一种。
⑴写出甲和乙两种物质的化学式:甲 、乙 ;⑵写出下列物质发生反应的化学方程式:乙和Ca(OH)2: ;丙和丁: ;⑶其中稀硫酸和丁的反应属于基本反应类型中的 反应。
6.在一定质量的甲溶液中逐渐加入乙至过量,反应过程中溶液的总质量与加入乙的质量关系,能用下图曲线表示的是
A.①② B. ②④ C.②③④ D.①②④
7.向一定量的氢氧化钡溶液中逐滴滴加稀硫酸至过量,下列图像与该反应事实相符合的是
Ba(OH)2 + H2SO4 = BaSO4↓ + 2H2O
结论:通过上述比较,你已经初步掌握了酸、碱、盐的一些性质,现在请你大胆尝试一下,把以下能反应的物质用“——”进行连接。
二、酸、碱、盐的化学性质的应用1、完成下列化学方程式(有些空格不止一个答案,你还能想到其他的答案吗?)1) +2HCl= + CO2↑+ ; + H2SO4=MgSO4+ ;2)Na2CO3+ = CaCO3↓+ ; NaOH+ = +H2O
2、利用下列试剂鉴别出以下三种无色溶液:HCl溶液、Ca(OH)2溶液、NaCl溶液试剂:石蕊 酚酞 CuO HCl溶液 CuSO4溶液 Na2CO3溶液 用一种试剂一次性鉴别,可选用: 。若可以多次实验进行鉴别,可选用: 。
3、小刚在化学实验室发现,盛放NaOH溶液的试剂瓶瓶口和橡皮塞上出现了白色粉末。小刚叫来小军和小红,共同探究这种白色粉末的成分。他们依据所学的化学知识,对这种白色粉末的成分作了如下猜想:①可能是NaOH;②可能是Na2CO3;③可能是 。为了验证猜想,他们分别做了下面的实验。(1)小刚取少量白色粉末,滴加稀盐酸,有气体生成。由此小刚认为白色粉末是Na2CO3。请判断小刚所得结论是否正确,并简述理由 。(2)小军取少量白色粉末溶于水,向所得溶液中滴加酚酞试液,溶液变为红色。由此小军认为白色粉末是NaOH。请判断小刚所得结论是否正确,并简述理由 。
NaOH 和Na2CO3
不正确,只能说明白色粉末中含有Na2CO3
不正确,Na2CO3溶液也能使酚酞溶液变红色
(3)小红取少量白色粉末溶于水,向所得溶液中滴加BaCl2试液,有白色沉淀产生。由此判断白色粉末中含有 。为了验证猜想③,小红继续向溶液中滴加BaCl2试液至不再产生沉淀为止,然后过滤。你认为她接下来还应进行的实验是 ;在小红所做的实验中,若把BaCl2溶液换成Ba(OH)2溶液是否可行?请简述理由。 __________________________________________________________________________。
分析:Na2CO3已全部除去,接下来的实验是要验证NaOH的存在,只要利用碱的性质
向滤液中滴加无色酚酞,若变红色,证明还含有NaOH
不可行,换成Ba(OH)2会带进OH-,无法确定是否存在NaOH
人教版九年级下册实验活动6 酸、碱的化学性质教课课件ppt: 这是一份人教版九年级下册实验活动6 酸、碱的化学性质教课课件ppt,共23页。PPT课件主要包含了学习目标,变红色,变蓝色,不变色无色,金属氧化物,非金属氧化物,变成蓝色,变成红色,生锈的铁钉与盐酸,铁钉变光亮时取出等内容,欢迎下载使用。
初中化学人教版九年级下册实验活动6 酸、碱的化学性质课堂教学课件ppt: 这是一份初中化学人教版九年级下册实验活动6 酸、碱的化学性质课堂教学课件ppt,文件包含人教版化学九年级下册实验活动6酸碱的化学性质课件pptx、人教版化学九年级下册实验活动6酸碱的化学性质教案docx等2份课件配套教学资源,其中PPT共26页, 欢迎下载使用。
初中化学人教版九年级下册实验活动7 溶液酸碱性的检验课文内容ppt课件: 这是一份初中化学人教版九年级下册实验活动7 溶液酸碱性的检验课文内容ppt课件,共29页。PPT课件主要包含了pH=7溶液为中性,pH<7溶液为酸性,pH>7溶液为碱性,pH计,洗发液,护发素,碱性洗净发丝,酸性保护发质,练习与应用等内容,欢迎下载使用。













