

福建省福州一中2021届高三第五次模拟考试化学试卷
展开福州一中2021届高考模拟试题
化学
满分100分,考试用时75分钟
可能使用的相对原子质量:H 1 Li 7 C 12 N 14 O 16 Na 23 P 31 S 32 Cr 52 Cu 64 Br 80
一、选择题:本卷共40分。在每小题给出的四个选项中,只有一个选项是符合题目要求的。
1.化学与生产、生活、科技及环境等密切相关。下面说法正确的是
A.长时间放置的油脂会因水解而变质
B.三星堆黄金面具含金量85%,其硬度比纯金高
C.古代记载文字的器物——甲骨,其主要成分是蛋白质
D.制造医用口罩和防护服的主要原材料是聚丙烯(PP),它与乙烯互为同系物
2.设NA为阿伏加德罗常数的值,下列叙述中正确的是
A.7.8gNa2S与Na2O2的混合物,含离子总数为0.3NA
B.0.1molFe和0.1molCu分别与0.1molCl2完全反应,转移电子数之比为3:2
C.标准状况下,11.2LCHCl3中含有分子的数目为0.5NA
D.1L0.5mol·L-1的Na3PO4溶液中含有的总数为0.5NA
3.下列离子方程式书写正确的是
A.氧化亚铁溶于稀硝酸:FeO+2H+=Fe2+ +H2O
B.向KClO溶液中滴加浓盐酸:ClO-+Cl-+2H+=Cl2↑+H2O
C.向Ca(ClO)2溶液中通入少量SO2:Ca2++SO2+H2O+2ClO-=CaSO3↓+2HClO
D.向Mg(HCO3)2溶液中滴加足量NaOH溶液:Mg2+++OH-=MgCO3↓+H2O
4.有机化合物E()是制备新型缓解过敏药物的原料。下列说法正确的是
A.E的分子式为C13H11N2OCl,每个分子中含有两个苯环
B.E分子中无手性碳原子
C.E分子中所有原子有可能共平面
D.E可以发生水解、氧化、加成、消去等反应
5.X、Y、Z、W、Q是原子序数依次增大的5种短周期主族元素,X和W同主族,Z与W相邻,X的最外层电子数是内层的两倍,Y和Q的最高价氧化物对应的水化物都是一元酸。下列说法错误的是
A.Y、Q的简单氢化物能发生反应
B.简单离子的半径大小:
C.含氧酸的酸性:
D.Z和W的单质都能与溶液发生反应
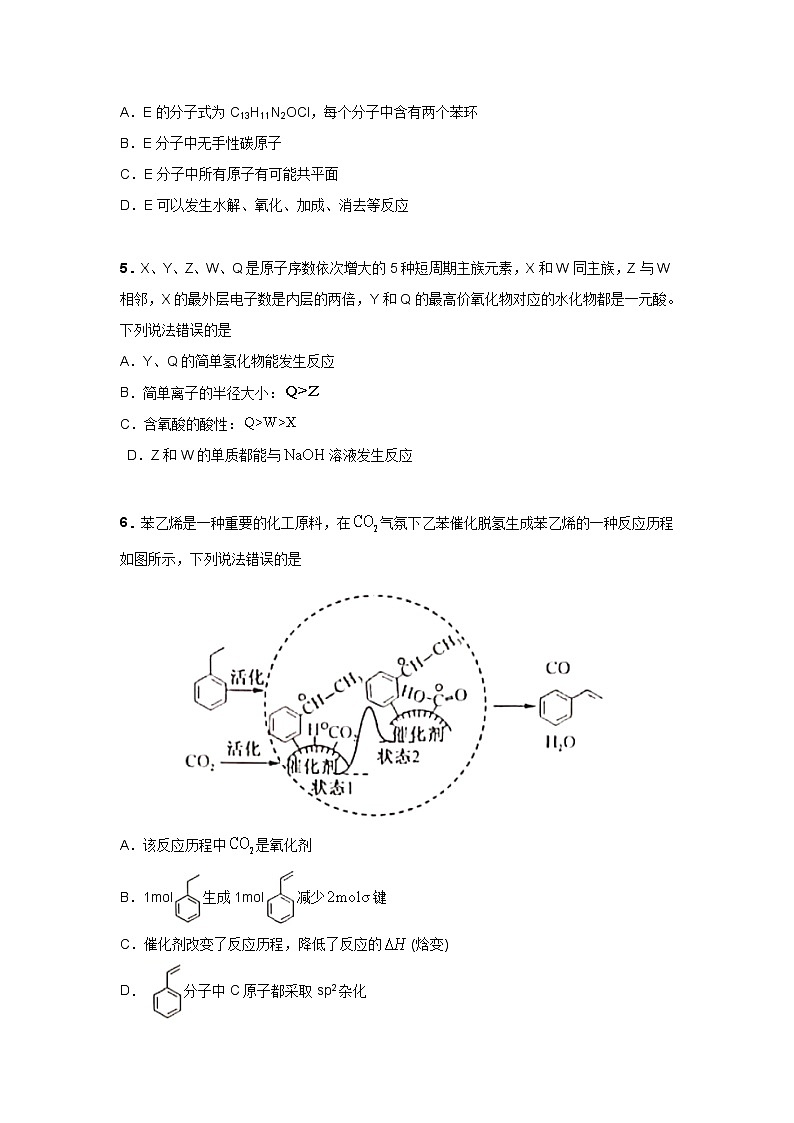
6.苯乙烯是一种重要的化工原料,在气氛下乙苯催化脱氢生成苯乙烯的一种反应历程如图所示,下列说法错误的是
A.该反应历程中是氧化剂
B.1mol生成1mol减少键
C.催化剂改变了反应历程,降低了反应的(焓变)
D.分子中C原子都采取sp2杂化
7.下列实验装置设计正确且能达到目的的是
A.实验I:制取氯气
B.实验II:加热熔融NaCl固体
C.实验III:分离乙酸乙酯和乙醚的混合物
D.实验IV:防止钢制管桩被腐蚀
8.科学家预言,被称为“黑金”的“新材料之王石墨烯”将“彻底改变21世纪”。我国关于石墨烯的专利总数世界排名第一。如图是我国研发的某种石墨烯电池有关原理示意图,左边装置工作时的电极反应为Li1-xC6+xLi++xe-=LiC6,Li[GS/Si]O2-xe-=Li1-x[GS/Si]O2+xLi+。下列说法错误的是
A.a与d电极上发生的反应类型相同
B.左右两个装置中的离子交换膜均为阳离子交换膜
C.电池放电时,正极反应为Li1-x[GS/Si]O2+xLi++xe-=Li[GS/Si]O2
D.若装置工作前c与d电极质量相等,则转移0.1mol电子后两个电极质量相差0.7g
9.下列实验操作中,其现象、解释及结论均正确的是
选项 | 实验操作 | 实验现象 | 解释或结论 |
A | 用pH试纸测定“84”消毒液pH | 试纸最终显蓝色 | NaClO在溶液中水解显碱性 |
B | 分别向两份相同的H2O2溶液中滴入5滴等浓度的CuSO4溶液和KMnO4溶液 | 前者产生气泡速率更快 | CuSO4比KMnO4的催化效果好 |
C | 向BaCl2溶液中通入SO2和X气体 | 产生白色沉淀 | 气体X一定具有强氧化性 |
D | 分别向两份相同的蛋白质溶液中滴入饱和硫酸铵溶液和醋酸铅溶液 | 均有固体析出 | 前者是物理变化,后者是化学变化 |
10.25°C时,向25 ml 0.1 mol∙L-1邻苯二甲酸(H2A)溶液中加入KOH固体或通入HCl气体,混合溶液的pH随-lgc(HA-)以及-lgc(A2-)的关系如图所示(忽略溶液体积变化和邻苯二甲酸的挥发)。下列有关叙述不正确的是
A.b点有关微粒浓度大小关系为c(K+) > c(HA-)> c(A2-)
B.c点c(K+) = 0.15 mol·L-1
C.邻苯二甲酸的Ka1约为1.0×10-3
D.从b点到e点,水电离产生的c(H+)先增大后减小
二、非选择题:本卷共5小题,共60分
11.(14分)重铬酸钠(Na2Cr2O7·2H2O)俗称红矾钠,在工业方面有广泛用途。我国目前主要是以铬铁矿(主要成份为FeO·Cr2O3,还含有Al2O3、MgO、SiO2等杂质)为主要原料进行生产,其主要工艺流程如下:
①中涉及的主要反应有:
主反应:4FeO·Cr2O3+8Na2CO3+7O2 8Na2CrO4+2Fe2O3+8CO2
副反应:SiO2+Na2CO3Na2SiO3+CO2↑、Al2O3+Na2CO32NaAlO2+CO2↑
部分阳离子以氢氧化物形式完全沉淀时溶液的pH:
沉淀物 | Al(OH)3 | Fe(OH)3 | Mg(OH)2 | Cr(OH)3 |
完全沉淀时溶液pH | 4.7 | 3.7 | 11.2 | 5.6 |
回答下列问题:
(1)“①”中反应是在回转窑中进行,反应时需不断搅拌,其作用是: ;
(2)“①”中若往原料中加入适量的石灰石,分析其作用可能是: ;
(3)“③”中调节pH至4.7,目的是: ;
(4)“⑤”中加硫酸酸化的目的是: 。
(5)“⑦”中采用冷却结晶得到红矾钠的原因是: 。
(6)称取重铬酸钠试样2.5000g配成250mL溶液,取出25.00mL于碘量瓶中,加入适量的稀硫酸和足量碘化钠(已知铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入几滴淀粉溶液指示剂,用0.1200mol·L-1Na2S2O3标准溶液滴定
(已知反应:I2+2S2O32-=== 2I-+S4O62-)
问题1:判断达到滴定终点的依据是: 。
问题2:若实验中共用去Na2S2O3标准溶液40.00ml,所得产品的中重铬酸钠(Na2Cr2O7·2H2O)的纯度 (保留四位有效数字)。(设整个过程中其它杂质不参与反应)
12.(14分)
某学习小组探究某浓度浓硝酸和稀硝酸与铁的反应。
实验 | |||
现象 | Ⅰ中:Fe表面产生大量无色气泡,液面上方变为红棕色 | Ⅱ中:Fe表面产生红棕色气泡,过一会儿停止 | Ⅲ中:连接导线,一段时间后Fe表面产生红棕色气泡,而后停止;随即又产生红棕色气泡,而后停止,……如此往复多次。Cu表面始终产生红棕色气泡 |
(1)Ⅰ中液面上方气体由无色变为红棕色的化学方程式为_______。
(2)取少量Ⅰ中溶液,加入_______(填名称),溶液变成红色,说明产生了Fe3+。
(3)Ⅱ中现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应。说明硝酸具有_______性。
(4)Ⅲ中,连接导线后体系形成了原电池。为分析反应过程,在Fe、Cu之间连接电流计,实验如下。
实验 | 现象 |
ⅰ.K闭合时,指针向左偏转(Cu做负极),Fe表面无明显现象 ⅱ.过一会儿指针向右偏,Fe表面产生红棕色气体;后又迅速向左偏,Fe表面停止产生气泡,……如此往复多次 ⅲ.一段时间后,指针一直处于右端,Fe表面持续产生红棕色气体 ⅳ.Cu表面始终产生红棕色气泡 |
①推测现象ⅰ中被还原的是_______。
②若将该装置Cu电极换成Zn电极,实验过程中是否会出现现象ii _______(填“是”、“否”) 。
③现象ⅲ中,Fe一直做负极,难以形成氧化层,可能的原因是_______。
④用方程式解释现象ⅳ:_______。
13.(12分)
人体内尿酸(HUr)含量偏高,关节滑液中产生尿酸钠晶体(NaUr)会引发痛风,
NaUr(s)Na+(aq)+Ur-(aq) △H >0。某课题组配制“模拟关节滑液”进行研究,回答下列问题:
已知:①37℃时,Ka(HUr) = 4×10-6,Kw = 2.4×10-14,Ksp(NaUr) = 6.4×10-5
②37℃时,模拟关节滑液pH = 7.4,c(Ur-) = 4.6×10-4 mol ∙ L-1
(1)尿酸电离方程式为________________________________________________
(2)Kh为盐的水解常数,37℃时, Kh(Ur-)= ___________________。
(3)37℃时,向HUr溶液中加入NaOH溶液配制“模拟关节滑液”,溶液中c(Na+) ______c(Ur-) (填“>”、“<”或“=”)。
(4)37℃时,向模拟关节滑液中加入NaCl(s)至c(Na+) = 0.2 mol ∙ L-1时,通过计算判断是否有NaUr晶体析出,请写出判断过程_____________________________________________
(5)对于尿酸偏高的人群,下列建议正确的是________。
a.加强锻炼,注意关节保暖 b.多饮酒,利用乙醇杀菌消毒
c.多喝水,饮食宜少盐、少脂 d.减少摄入易代谢出尿酸的食物
14.(10分)
N、Cu等元素的化合物在工农业生产中有着广泛的应用。
(1)下列N元素的电子排布式表示的状态中,失去一个电子所需能量最低的为 。
A. B.
C. D.
(2)存在两种分子内氢键,若用“···表示其氢键”,的分子结构为 。
(3)基态Cu2+价电子的空间运动状态有 种。
(4)分子中采取杂化的原子有 。(填原子符号)
(5)Cu元素与Br元素形成的化合物的晶胞结构如下图所示,该晶胞沿z轴在平面的投影图中,Cu原子构成的几何图形是 ,若晶胞的密度为,则Cu原子与Br原子之间的最短距离为 µm(列出计算式即可,表示阿伏加德罗常数的值)。
15.(10分)β–羰基酯化合物是重要的化工合成原料,在有机合成工业和制药工业具有广泛的用途。某β–羰基酯化合物G的合成路径如下:
回答下列问题:
(1)B的化学名称为________。
(2)C到D的反应类型为________。
(3)C中的官能团名称________。
(4)写出反应E到F的化学方程式 _______________________________________________。
(5)写出G的结构简式________。
(6)化合物的F的同分异构体H能同时满足以下三个条件,H的结构简式________。
(ⅰ)不能发生银镜反应;(ⅱ)易水解,且1 mol H和3 mol NaOH反应;
(ⅲ)苯环上二取代,且核磁共振氢谱峰面积比为1:1:2:2:6。
【答案】
BABBC CCDDB
11. (14分)
(1)使反应物接触更充分,加快反应速率;
(2)分解产生CaO,与铬铁矿中某些杂质反应形成炉渣有利于去除
或分解产生CO2从下而上穿过,使得炉料翻滚,加快原料的煅烧氧化
(3)使溶液中的AlO2-、SiO32-均转化为沉淀去除
(4) ,调节pH使Na2CrO4转化为Na2Cr2O7,有利于红矾钠晶体析出
(5)红矾钠随着温度的降低,溶解度明显下降
(6)问题1:当滴加最后一滴硫代硫酸钠标准溶液时,溶液蓝色恰好褪去,半分钟内不变色
问题2:95.36%
12.(14分)2NO + O2= 2NO2 硫氰化钾 强氧化性
铁表面的氧化层
否
反应放热,溶液温度升高;随反应进行,硝酸浓度降低
Cu+4HNO3 (浓) = Cu(NO3)2+2NO2↑+2H2O,NO+2H++e-= NO2↑+H2O
13.(12分)
(1)HUrH++Ur- (2分)
(2)6×10-9 (2分)
(3)> (2分)
(4)Q = c(Na+) ∙ c(Ur-) = 0.2 mol ∙ L-1 × 4.6×10-4 mol ∙ L-1 = 9.2×10-5 > Ksp(NaUr),故有尿酸钠晶体析出。
(5)acd (2分)
14. (10分)
(1)B(1分)
(2)、(2分)
(3)5(1分)
(4)C、N、O(2分)
(5)正方形(1分) (2分)
15. (10分)
(1)苯甲醚 (2)取代反应 (3)氯原子、醚键
(4)
(5)
(6)
福建省福州第三中学2023-2024学年高三上学期第五次质量检测化学试题: 这是一份福建省福州第三中学2023-2024学年高三上学期第五次质量检测化学试题,共11页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
2020-2021学年福建省福州一中高一(上)期中化学试卷: 这是一份2020-2021学年福建省福州一中高一(上)期中化学试卷,共7页。试卷主要包含了选择题,解答题等内容,欢迎下载使用。
2022届福建省福州高三三模化学试卷及答案: 这是一份2022届福建省福州高三三模化学试卷及答案,文件包含2022届福建省福州市高中毕业班+高三下学期5月质量检测化学试卷docx、2022届福建省福州市高中毕业班+高三下学期5月质量检测化学试卷答案docx等2份试卷配套教学资源,其中试卷共12页, 欢迎下载使用。












