化学第二节 元素周期律学案设计
展开
这是一份化学第二节 元素周期律学案设计,学案主要包含了学习目标,学习重点难点,归纳总结与反思,达标检测,四周期,则氢化物的稳定性等内容,欢迎下载使用。
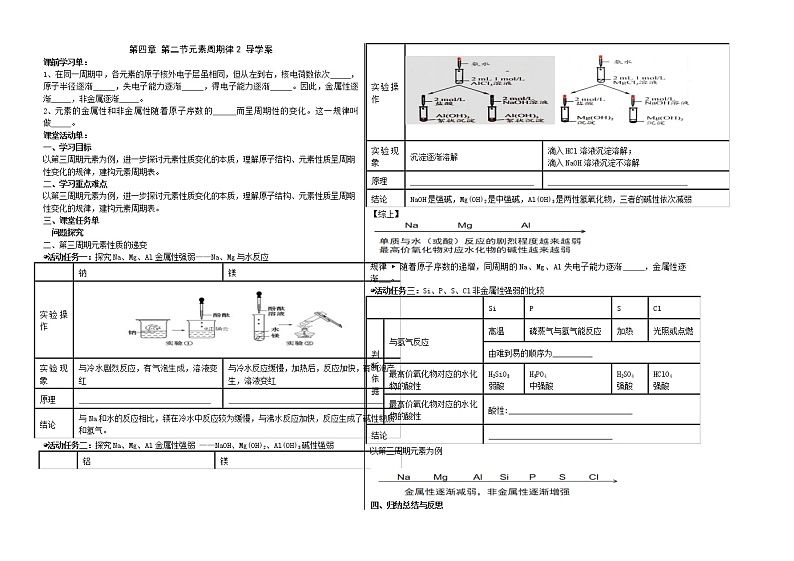
第四章 第二节元素周期律2 导学案 课前学习单:1、在同一周期中,各元素的原子核外电子层虽相同,但从左到右,核电荷数依次 ,原子半径逐渐 ,失电子能力逐渐 ,得电子能力逐渐 。因此,金属性逐渐 ,非金属逐渐 。2、元素的金属性和非金属性随着原子序数的 而呈周期性的变化。这一规律叫做 。课堂活动单:一、学习目标以第三周期元素为例,进一步探讨元素性质变化的本质,理解原子结构、元素性质呈周期性变化的规律,建构元素周期表。二、学习重点难点以第三周期元素为例,进一步探讨元素性质变化的本质,理解原子结构、元素性质呈周期性变化的规律,建构元素周期表。三、课堂任务单问题探究二、第三周期元素性质的递变◕活动任务一:探究Na、Mg、Al金属性强弱——Na、Mg与水反应 钠镁实验操作实验现象与冷水剧烈反应,有气泡生成,溶液变红与冷水反应缓慢,加热后,反应加快,有气泡产生,溶液变红原理 结论与Na和水的反应相比,镁在冷水中反应较为缓慢,与沸水反应加快,反应生成了碱性物质和氢气。◕活动任务二:探究Na、Mg、Al金属性强弱 ——NaOH、Mg(OH)2、Al(OH)3碱性强弱 铝镁实验操作
实验现象沉淀逐渐溶解滴入HCl溶液沉淀溶解;滴入NaOH溶液沉淀不溶解原理 结论NaOH是强碱,Mg(OH)2是中强碱,Al(OH)3是两性氢氧化物,三者的碱性依次减弱【综上】规律 ▶ 随着原子序数的递增,同周期的Na、Mg、Al失电子能力逐渐 ,金属性逐渐 。◕活动任务三:Si、P、S、Cl非金属性强弱的比较 SiPSCl判断依据与氢气反应高温磷蒸气与氢气能反应加热光照或点燃由难到易的顺序为__________最高价氧化物对应的水化物的酸性H2SiO3弱酸H3PO4中强酸H2SO4强酸HClO4强酸最高价氧化物对应的水化物的酸性酸性:_______________________________结论_______________________________以第三周期元素为例 四、归纳总结与反思同主族、同周期元素性质的递变规律同周期,从左至右,金属性逐渐 ,非金属性逐渐 。原子半径逐渐 。同主族,从下至上,金属性逐渐 ,非金属性逐渐 。原子半径逐渐 。五、达标检测1.下列递变情况不正确的是( )A.Na、Mg、Al原子最外层电子数依次增多,其简单离子的氧化性依次增强B.P、S、Cl最高正化合价依次升高,对应的气态氢化物的稳定性依次增强C.C、N、O原子半径依次增大D.Na、K、Rb氧化物对应的水化物碱性依次增强2.下列递变规律正确的是( )A.的酸性依次增强 B.HCl、HBr、HI的稳定性依次增C.钠、镁、铝的还原性依次减弱 D.离子半径逐渐增大3.用“ > ”或“<”、“>”填空。
(1)酸性:H2CO3 __________H2SiO3, H2SiO3__________ H3PO4
(2)碱性:Ca(OH)2 __________Mg(OH)2, Mg(OH)2__________ Al(OH)3
(3)气态氢化物稳定性:H2O__________H2S, H2S__________HCl纠错提高1.依据元素周期表及元素周期律,下列推断正确的是A.H3BO3的酸性比H2CO3的强B.Mg(OH)2的碱性比Be(OH)2的强C.Cl-、Br-、I-的还原性逐渐减弱D.若M+和R2+的核外电子层结构相同,则原子序数:R>M2.利用元素周期律和元素周期表的有关知识判断,下列各组元素性质或原子结构递变情况错误的是( )A.Li、Be、B原子最外层电子数依次增多 B.P、S、Cl元素最高正化合价依次升高C.N、O、F原子半径依次增大 D.Na、K、Rb的电子层数依次增多3.下列递变规律正确的是( )A.HClO4、H2SO4、H3PO4的酸性依次增强 B.HCl、HBr、HI的稳定性依次增强C.钠、镁、铝的还原性依次减弱 D.Na+、Mg2+、Al3+离子半径逐渐增大课后巩固单:1.如图表示1~18号元素(原子)的结构或性质随核电荷数递增的变化,该图中,纵坐标表示( )A.原子半径 B.电子层数 C.最高化合价 D.最外层电子数2.半导体材料一般位于元素周期表中的( )A.金属与非金属分界线附近 B.过渡元素区域 C.非金属区域 D.Ⅷ族3.科学家预测原子序数为114的元素,具有相当稳定的同位素,它的位置在第七周期ⅣA族,称为类铅。关于它的性质,预测错误的是( )A.它的最外层电子数为4 B.它的最高价氧化物的水化物是强酸C.它具有+2、+4价 D.它的金属性比铅强4.元素周期表可以指导人们进行规律性的推测和判断,下列说法不正确的是( )A.若aX2+和bY-的核外电子层结构相同,则原子序数:a=b+3B.由水溶液的酸性:HCl>HF,可推断出元素的非金属性:Cl>FC.锗与硅位于金属与非金属的交界处,都能作半导体材料D.S和Se分别位于第ⅥA族的第三、四周期,则氢化物的稳定性:H2S>H2Se5.原子序数从11依次增加到17的原子,下列所述递变关系错误的是( )A.原子电子层数不变 B.从钠到铝金属性增强C.最高正价数值逐渐增大 D.从硅到氯负价从-4→-16.利用元素周期律可以比较不同物质的某些性质。下列结论正确的是( )A.原子半径:Li>Be>B B.酸性:H2SO4>HClO4>H3PO4C.碱性:NaOH>Al(OH)3>Mg(OH)2 D.热稳定性:H2O>NH3>HF7.短周期元素W、X、Y、Z的原子序数依次增大。W原子的最外层电子数是其内层电子数的2倍,X是大气中含量最高的元素,Y与Z同主族,可形成化合物ZY2。下列说法正确的是( )A.原子半径大小顺序:r(Y)>r(X)>r(W) B.ZY2溶于水生成强酸C.Z的气态氢化物的热稳定性比Y的强 D.W元素有多种同素异形体8.根据元素周期表1~20号元素的性质和递变规律,回答下列问题。(1)属于金属元素的有__________种,金属性最强的元素与氧反应生成的化合物为__________ (填两种化合物的化学式)。(2)最高正化合价最高的元素是__________,其最高正化合价为__________。(3)单质既能与盐酸反应,又能与NaOH溶液反应的是__________,其最高价氧化物对应水化物具有__________(填“酸性”“碱性”或“两性”)。(4)第三周期中,原子半径最大的是(稀有气体元素除外)__________。(5)推测Si、N最简单氢化物的稳定性__________大于__________(填化学式)。9.下列说法中正确的是( )A.非金属元素呈现的最高化合价不超过该元素原子的最外层电子数B.非金属元素呈现的最低化合价,其绝对值等于该元素原子的最外层电子数C.最外层有2个电子的原子都是金属原子 D.最外层有5个电子的原子都是非金属原子10.某元素的最高正价与负价的代数和为4,则该元素可能为( )A.C B.P C.O D.S
相关学案
这是一份必修 第一册第二节 元素周期律学案,文件包含1课时1元素性质的周期性变化规律doc、2课时2元素周期表和元素周期律的应用doc等2份学案配套教学资源,其中学案共34页, 欢迎下载使用。
这是一份高中化学人教版 (2019)必修 第一册第二节 元素周期律学案设计,共2页。学案主要包含了学习目标,学习重点难点,归纳总结,当堂巩固等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)必修 第一册第四章 物质结构 元素周期律第二节 元素周期律学案设计,学案主要包含了学习目标,学习重点难点,归纳总结与反思,达标检测等内容,欢迎下载使用。










