






高中化学人教版 (2019)必修 第二册第二节 氮及其化合物教学ppt课件
展开本节内容主要包括∶氮及氮的固定、一氧化氮和二氧化氮、氨和铵盐、硝酸、酸雨及其防治。教材首先根据氮的原子结构知识,应用前一节掌握的研究非金属单质性质的基本思路预测氮的化学性质,渗透条件对化学反应的影响,引出氮的固定对人类生存的重要意义。之后,根据物质类别研究氮的化合物,包括一氧化氮、二氧化氮、硝酸、氨和铵盐的化学性质。以工业合成氨、工业制硝酸的生产原理为载体,应用氧化还原反应原理,设计含氮化合物的转化,使学生认识到从一种原料转化成多种产品,路径之一是通过氧化还原反应改变主要元素的化合价,提升"变化观念"等学科核心素养。教材设置铵根离子的检验、实验室制取氮的实验活动,让学生根据氨、铵根离子的性质和反应,选择合适的试剂。设计检验或者制取物质的方案,提升其科学探究的能力。最后,教材编入"酸雨及其防治"内容以及"测定雨水的pH"的研究与实践活动,综合运用硫和氮及其化合物的相关知识,寻求证据参与社会性议题的讨论,分析硫酸工业、合成氨工业对社会发展的价值和对环境的影响,有意识地渗透资源合理利用和环境保护的意识。
1.能从物质类别、氮元素化合价的角度认识硝酸的性质及含氮物质间的相互转化,促进“证据推理与模型认知”化学核心素养的发展。2.认识二氧化硫、氮氧化物为大气污染物,了解酸雨的形成、危害及其防治, 增强环保意识和社会责任感。
为什么硝酸泄漏会有黄色的气体产生?
纯硝酸是无色、易挥发(沸点是83℃)、有刺激性气味的液体,质量分数为95%以上的硝酸叫发烟硝酸。
浓硝酸不稳定,见光或受热易分解产生二氧化氮
硝酸知多少:强酸的通性
一元强酸:HNO3 = H+ + NO3-
酸的通性:能与金属、碱性氧化物、碱、某些盐、指示剂反应
练一练:试写出下列化学反应方程式
1、硝酸加入到生石灰上2、硝酸加入到氢氧化钠溶液中3、硝酸滴加到大理石上
2HNO3 + CaO = Ca(NO3)2 + H2O
HNO3 + NaOH = NaNO3 + H2O
2HNO3 + CaCO3 = Ca(NO3)2 + H2O + CO2↑
浓硝酸中的+5价氮元素具有很强的得电子能力。浓硝酸和稀硝酸都具有很强的氧化性,且浓度越大氧化性越强,还原剂一般被其氧化为最高价态。
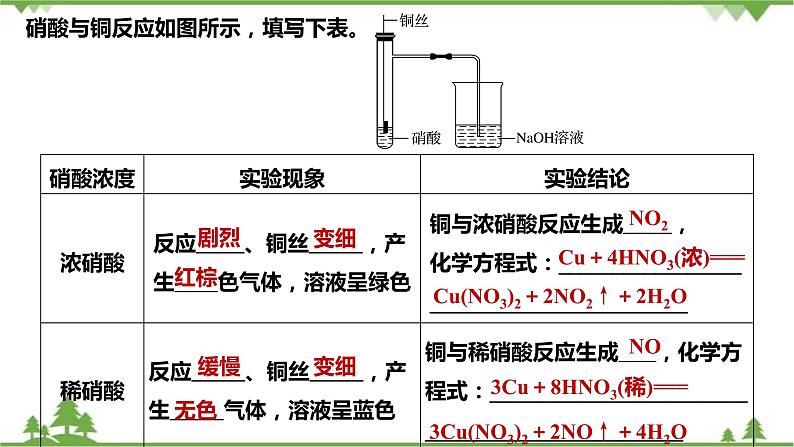
硝酸与铜反应如图所示,填写下表。
Cu+4HNO3(浓)===
Cu(NO3)2+2NO2↑+2H2O
3Cu+8HNO3(稀)===
3Cu(NO3)2+2NO↑+4H2O
根据浓硝酸和稀硝酸的强氧化性书写下列反应的化学方程式:①铁与稀硝酸(HNO3过量): 。②碳与浓硝酸共热生成CO2和NO2: 。③硫与浓硝酸共热生成H2SO4和NO2: 。
Fe+4HNO3(稀)===Fe(NO3)3+NO↑+2H2O
思考:硝酸有强氧化性,为什么工业上用铁或者铝制的容器运输浓硝酸?
初中化学已学习过,实验室制H2能否用活泼金属和硝酸反应制得?为什么?
向少量石蕊试液中逐滴加入浓硝酸,观察现象,并解释。
(1)硝酸与金属反应不能生成氢气。硝酸浓度不同,其还原产物不同,一般情况下,浓硝酸被还原为NO2,稀硝酸被还原为NO。(2)硝酸能与大多数金属(金、铂等除外)反应,将金属氧化为高价态金属的硝酸盐。但在常温下,浓硝酸能使铁、铝钝化。(3)热的浓硝酸可将非金属单质(碳、硫、磷等)氧化为最高价氧化物或最高价含氧酸。(4)硝酸的强氧化性还表现在可以氧化具有还原性的化合物或离子,如SO2、FeO、Fe2+、Br-、I-、S2-、SO32-等均能被硝酸氧化。
浓见光或受热易分解,其化学方程式为 。 长期存放的浓硝酸呈黄色是因为其分解生成的 溶于硝酸中;实验室常 将浓硝酸保存在 试剂瓶中,并放在 处。
思考:如何除去浓硝酸中的“黄色”?
在浓硝酸中通入足量的氧气,发生反应4NO2+O2+2H2O = 4HNO3,使NO2转化为硝酸,即可除去浓硝酸中的“黄色”。
(1)硝酸具有腐蚀性和挥发性,使用时要注意防护和通风( )(2)稀硝酸可溶解Fe(OH)2生成Fe(NO3)2和水( )(3)碳、铜与浓硝酸反应时,浓硝酸只表现强氧化性( )(4)浓硝酸、稀硝酸都具有强氧化性,它们都能使铁、铝钝化( )(5)王水是浓硝酸和浓盐酸体积比为1∶3的混合物,其氧化性比浓硝酸强( )
实验室制取氨的实验装置如图所示:
(1)反应原理: 。(2)碱石灰的作用: 。(3)由于氨极易溶于水,不能用排水法收集,常用 法来收集。
固+固,加热型(与氧气的制取装置相同)
复习:硫酸型酸雨形成过程
写出图中标号所示的化学方程式:①;② ;③ ;④ 。
SO3+H2O===H2SO4
2H2SO3+O2===2H2SO4
SO2+H2O H2SO3
写出图中标号所示的化学方程式:① ;② 。
2NO+O2===2NO2
3NO2+H2O===2HNO3+NO
酸雨的危害(1)直接 农作物,破坏森林和草原,使土壤、湖泊 。(2)加速建筑物、桥梁、工业设备、运输工具和电缆的 。(3)导致地下水中重金属元素含量增加,污染水源,危害人体健康。酸雨的防治(1)消除 ,改变能源结构,开发利用清洁能源,如太阳能、风能、氢能等。(2)对 的排放加以控制,如燃料脱硫处理,废气中二氧化硫回收利用、控制汽车尾气排放等。(3)健全法律法规,严格规定污染物的排放标准,提高环境保护意识。
1.现有雨水样品1份,每隔一段时间测定该雨水样品的pH,所得数据如下:
(1)分析数据,回答下列问题:①雨水样品的pH变化的原因是________________________________________(用化学方程式表示)。
②如果将刚取样的上述雨水和自来水相混合,pH将变___,原因是__________________________________________________________(用化学方程式表示)。
+SO2===H2SO4+2HCl或H2SO3+HClO===H2SO4+HCl
(2)下列措施中,可减少酸雨产生的途径的是____(填字母)。①少用煤作燃料 ②把工厂烟囱造高 ③燃料脱硫④在已酸化的土壤中加石灰 ⑤开发新能源A.①②③ B.②③④⑤C.①③⑤ D.①③④⑤
解析 减少酸雨的产生需减少SO2的排放,将煤转化为清洁能源(如煤的气化和液化),燃料脱硫、固硫,开发不含硫的新能源(如氢能、核能等),都是有力措施。因此①③⑤正确。
人教版 (2019)必修 第二册第二节 氮及其化合物课堂教学课件ppt: 这是一份人教版 (2019)必修 第二册第二节 氮及其化合物课堂教学课件ppt,共20页。PPT课件主要包含了强氧化性,什么是酸雨呢,酸雨是怎样形成的呢,催化剂,硫酸型酸雨,硝酸型酸雨等内容,欢迎下载使用。
人教版 (2019)必修 第二册第五章 化工生产中的重要非金属元素第二节 氮及其化合物教课ppt课件: 这是一份人教版 (2019)必修 第二册第五章 化工生产中的重要非金属元素第二节 氮及其化合物教课ppt课件,共17页。PPT课件主要包含了物理性质,有刺激性气味,挥发性,化学性质,②使指示剂变色,先变红后褪色微热,2不稳定性,阴暗避光处,3强氧化性,NO2等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第二册第一节 硫及其化合物教学ppt课件: 这是一份高中化学人教版 (2019)必修 第二册第一节 硫及其化合物教学ppt课件,文件包含512硫酸讲好课-2020-2021学年高一化学新教材新理念新设计同步课堂人教2019必修第二册pptx、教学实验浓硫酸与蔗糖反应mp4、教学实验浓硫酸与铜反应mp4、什么是酸雨及其危害---平安中国防灾宣导系列公益活动--_标清avi等4份课件配套教学资源,其中PPT共0页, 欢迎下载使用。













