





高中人教版 (2019)第六章 化学反应与能量第一节 化学反应与能量变化教学ppt课件
展开本节内容主要包括化学反应中的热能和电能。对于化学反应中的热能,教材除引出化学反应中的吸热、放热反应等热量变化现象和概念外,主要是借助化学反应中的热量变化揭示化学反应中能量变化的本质,并探讨其与社会、生产、生活的联系。对于化学反应中的电能,教材主要介绍原电池原理及应用——化学电池。热能和电能作为化学反应中能量变化的例子,教材的侧重不同,前者侧重揭示能量变化的本质,后者侧重化学能转变为电能的原理。木节重点知识理论性强,微观分析多,较为抽象;知识内涵丰富,信息量大。
1.知道干电池、充电电池、燃料电池等化学电源的特点。2.掌握构成电池的要素,了解不同电极材料对电池性能的影响。3.能正确书写简单化学电源的电极反应式。
分组讨论:视频中橙子给手机充电的原理?
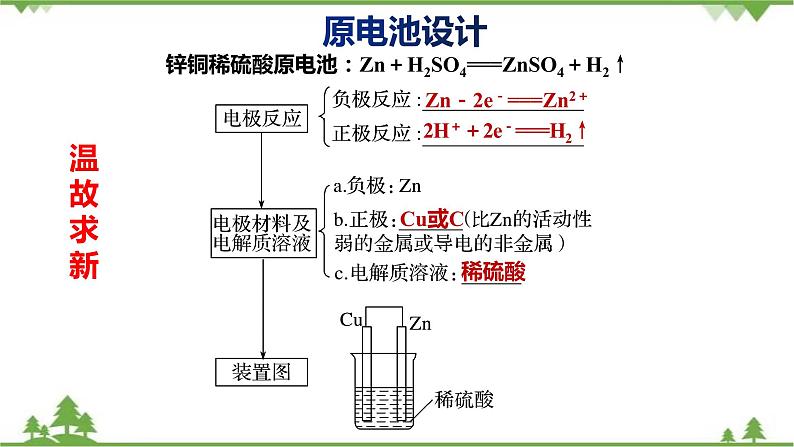
锌铜稀硫酸原电池:Zn+H2SO4===ZnSO4+H2↑
Zn-2e-===Zn2+
2H++2e-===H2↑
1.原理:理论上任何自发的氧化还原反应都可以设计成原电池
2.分析:首先分析找出氧化剂、还原剂,一般还原剂为负极材料(或在负极上被氧化),氧化剂(电解质溶液中的阳离子)在正极上被还原。
3.确定两极材料及电解质溶液
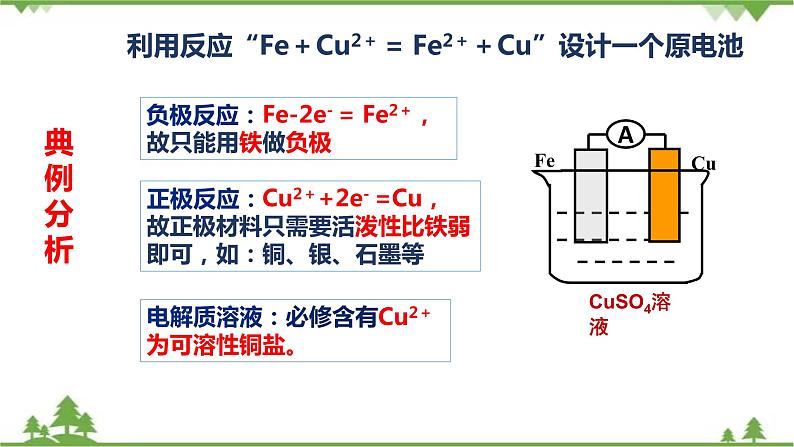
利用反应“Fe+Cu2+ = Fe2++Cu”设计一个原电池
负极反应:Fe-2e- = Fe2+,故只能用铁做负极
正极反应:Cu2++2e- =Cu,故正极材料只需要活泼性比铁弱即可,如:铜、银、石墨等
电解质溶液:必修含有Cu2+为可溶性铜盐。
理论上讲,任何自发的氧化还原反应都可以设计成原电池。选择适宜的材料和试剂,请利用反应“Fe+2Fe3+===3Fe2+”设计一个原电池。回答下列问题:(1)用双线桥分析上述离子反应,标出电子转移的方向和数目______________;其中氧化反应的半反应可表示为“Fe-2e-===Fe2+”,则还原反应的半反应为____________________。
2Fe3++2e-===2Fe2+
(2)若设计成原电池①负极材料是___,选择依据是__________________________________________________;②正极材料可选用__________,选择依据是___________________________________________。③_________________溶液作电解质。(3)写出电极反应式正极:___________________,负极:_______________。(4)该原电池中电子从________极流出,电解质溶液中的阳离子(Fe3+)移向_____________极。
固体铁单质能导电,可被电解质溶液中的Fe3+
铜(或石墨)的还原性比铁弱,且
FeCl3[或Fe2(SO4)3]
Fe-2e-===Fe2+
实践活动:水果电池的设计与制作
问题讨论:水果的作用是作: 。实验结论:构成原电池的要素有:①自发的氧化还原反应。②两个活泼性 的电极, 溶液,形成闭合回路。③根据电极材料判断电极:较活泼金属作 ,不活泼的金属或惰性电极作 。
注:水果电池的电流效果与电极材料、水果的种类有关,另外还与两电极间距离以及电极插入水果的深度等因素有关。
1.一次电池(1)特点:电池放电后 充电(内部的氧化还原反应 逆向进行),如锌锰干电池属于一次电池。(2)锌锰干电池的构造如图所示:①锌筒为 ,电极反应是 。②石墨棒为 ,最终被还原的物质是 。③NH4Cl糊的作用 。
2.二次电池(充电电池)(1)特点:二次电池在放电时所进行的 ,在充电时可以 ,使电池恢复到放电前的状态。(2)能量转化:化学能 电能(3)常见的充电电池:铅酸电池、镍氢电池、锂离子电池。3.燃料电池(1)特点:①反应物储存在电池外部,②能量转换效率高、清洁、安全,③供电量易于调节。(2)燃料电池常用的燃料有: 、 、乙醇等。常用氧化剂:氧气。
(1)理论上任何氧化还原反应都可设计成原电池( )(2)原电池中负极上发生氧化反应( )(3)原电池中正极材料一定发生还原反应( )(4)原电池中正极材料必须与电解质溶液的某种离子反应( )
(5)锌锰干电池工作一段时间后碳棒变细( )(6)氢氧燃料电池是将热能直接转变为电能( )(7)充电电池可以无限制地反复充电、放电( )(8)氢氧燃料电池比氢气直接燃烧发电能量利用率高( )
2.1800年伏打用锌片与铜片夹以盐水浸湿的纸片叠成电堆产生了电流,这个装置后来称为伏打电池(也叫伏打电堆),如下图所示。
观察示意图,思考回答下列问题:(1)负极是:___,电极反应_______________。(2)正极是:____。(3)猜测得电子发生还原反应的物质可能是______。
3.铅酸电池常用作汽车电瓶,其构造如图所示,工作时该电池总的方程式为:Pb+PbO2+2H2SO4===2PbSO4+2H2O按要求回答下列问题:(1)负极材料是____,正极材料是______,电解质溶液是_______。
(2)工作时,电解质溶液中的H+移向___________极。(3)工作时,电解质溶液中硫酸的浓度_____(填“增大”“减小”或“不变”)。(4)当铅蓄电池向外电路提供2 ml e-时,理论上负极板的质量增加___ g。
失e,沿导线传递,有电流产生
2H++2e- =H2↑
Zn-2e- =Zn2+
Zn+2H+=Zn2++H2↑
Zn+H2SO4=ZnSO4+H2↑
高中化学人教版 (2019)必修 第二册第二节 化学品的合理使用多媒体教学课件ppt: 这是一份高中化学人教版 (2019)必修 第二册第二节 化学品的合理使用多媒体教学课件ppt,共24页。PPT课件主要包含了原电池的构成要素,两极一液成回路,温故知新,我们下次见等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第二册第七章 有机化合物第三节 乙醇与乙酸教学ppt课件: 这是一份高中化学人教版 (2019)必修 第二册第七章 有机化合物第三节 乙醇与乙酸教学ppt课件,文件包含731乙醇讲好课-2020-2021学年高一化学新教材新理念新设计同步课堂人教2019必修第二册pptx、教学实验乙醇与钠反应mp4、教学实验乙醇的催化氧化mp4、乙醇的催化氧化反应swf、乙醇的结构swf等5份课件配套教学资源,其中PPT共0页, 欢迎下载使用。
高中化学人教版 (2019)必修 第二册第一节 硫及其化合物教学ppt课件: 这是一份高中化学人教版 (2019)必修 第二册第一节 硫及其化合物教学ppt课件,文件包含512硫酸讲好课-2020-2021学年高一化学新教材新理念新设计同步课堂人教2019必修第二册pptx、教学实验浓硫酸与蔗糖反应mp4、教学实验浓硫酸与铜反应mp4、什么是酸雨及其危害---平安中国防灾宣导系列公益活动--_标清avi等4份课件配套教学资源,其中PPT共0页, 欢迎下载使用。













