





高中化学第二节 化学反应的速率与限度教学课件ppt
展开本节包含三个问题∶化学反应的速率、限度和调控。前两个问题是化学基本原理,后一个问题是原理的应用。三个问题密切相关,但依据课程标准要求和学生知识基础的不同,内容深浅不一,呈现方式各异。1.化学反应的速率,重点是影响化学反应速率的因素2.化学反应的限度,只限于介绍化学平衡状态3.化学反应条件的控制,重在相关意识的形成
1.了解可逆反应及特点。2.理解化学平衡状态的特征及标志,知道改变条件化学平衡会发生移动。3.了解控制反应条件在生产、生活和科学研究中的作用。
1.可逆反应(1)定义在同一条件下 和 均能进行的化学反应。书写可逆反应的化学方程式时,不用“===”,用“ ”。
正、逆反应是在_________下同时进行的
反应物和生成物_____存在
练习:列举之前在教材中出现的可逆反应
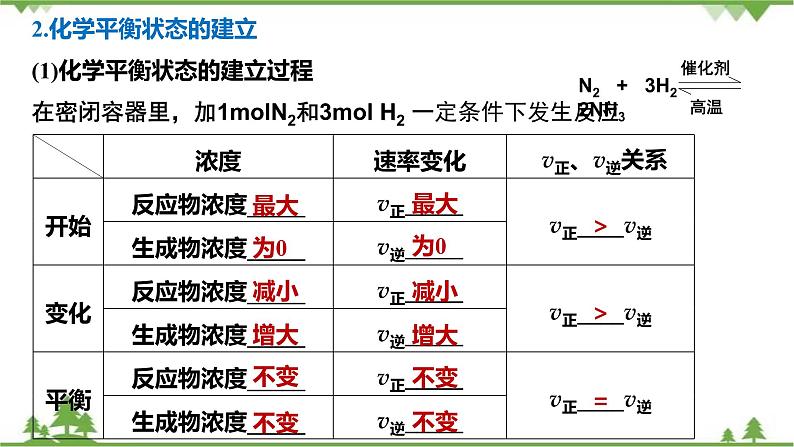
2.化学平衡状态的建立(1)化学平衡状态的建立过程在密闭容器里,加1mlN2和3ml H2 一定条件下发生反应
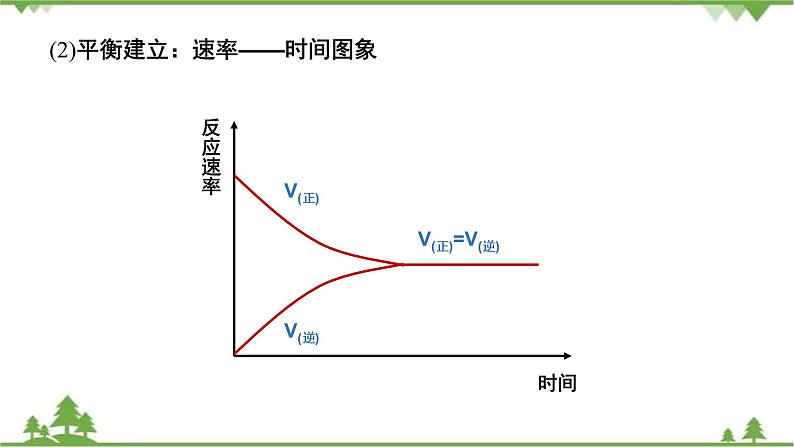
(2)平衡建立:速率——时间图象
3.化学平衡状态(1)化学平衡状态的概念
在一定条件下,一个可逆反应进行到一定程度时,正向反应速率与逆向反应速率相等时,反应物浓度和生成物浓度不再改变,达到一种表面静止的状态。
(2)化学平衡状态的特征
4.化学反应的限度(1)化学平衡状态是可逆反应在一定条件下所能达到或完成的 ,即该反应进行的限度。(2)对化学反应限度的理解①化学反应的限度决定了反应物在一定条件下的最大 。②同一可逆反应,不同条件下,化学反应的限度不同,即改变条件可以在一定程度上改变一个化学反应的 。
(2)1 ml N2和3 ml H2在一定条件下可完全生成2 ml NH3( )(3)一定条件,可以通过延长化学反应的时间来改变反应物的最大转化率( )(4)化学反应达到化学平衡状态时正、逆反应速率相等,是指同一物质的消耗速率和生成速率相等,若用不同物质表示时,反应速率不一定相等( )(5)可逆反应达到平衡状态时,各反应物、生成物的浓度相等( )
化学反应在一定条件下建立平衡状态时,化学反应将会停止( )
化学平衡状态的判断依据(1)直接依据——根据速率关系①同一物质:生成速率=消耗速率,即v正(A)=v逆(A)。②不同物质:速率之比=化学计量数之比,但必须是不同方向的速率,
速率必须一个是正反应速率,一个是逆反应速率,且经过换算后同一物质的消耗速率和生成速率相等
(2)间接依据——根据各组分的量首先分析该量是“变量”还是“恒量”,如为“恒量”,即随反应的进行永远不变,则不能作为判断平衡状态的依据;如为“变量”,即该量随反应进行而改变,当其“不变”时,则为平衡状态。
化学平衡状态的判断依据
在一定温度下,在恒容的容器中充入2 ml SO2和1 ml O2发生反应:2SO2+O2 2SO3。一段时间后,该反应达到化学平衡,下列能说明达到化学平衡状态的是_________(填序号)。①v正(SO2)=2v逆(O2) ②v(SO2)=v(SO3)③单位时间内消耗a ml SO2,同时生成a ml SO3④SO2、O2和SO3的浓度之比为2∶1∶2⑤混合气体的总的物质的量不再改变⑥混合气体的压强不再改变 ⑦混合气体的密度不再改变⑧混合气体的平均相对分子质量不再改变
化工生产中化学反应条件的控制
在化工生产中,为了提高反应进行的程度而调控反应条件时,需要考虑控制反应条件的成本和实际可能性。例如:合成氨的生产在温度较低时,氨的产率较高;压强越大,氨的产率越高。但温度低,反应速率小,需要很长时间才能达到化学平衡,生产成本高,工业上通常选择在 400~500℃下进行。而压强越大,对动力和生产设备的要求也越高,合成氨厂随着生产规模和设备条件的不同,采用的压强通常为10~30 MPa。
为提高燃料的燃烧效率,应如何调控燃烧反应的条件?(提示∶可以从以下几方面考虑,如燃料的状态、空气用量、炉膛材料、烟道废气中热能的利用,等等。)
煤被研得越细,粉末越小,与空气中O2的接触面积越大,燃烧越充分,反应速率越快。
空气充足,煤燃烧得充分,产物主要为CO2,放热量大;空气不足,则煤燃烧不充分,部分生成CO,CO排放到空气中造成污染,且生成CO时,放出的热量大大减小。
应选择保温隔热且耐热的炉(灶)膛材料。尽管煤燃烧是放热反应,但反应过程中煤燃烧需要提供部分能量才能进行,而利用煤燃烧放出的部分热量就可维持反应的持续进行。选用保温隔热材料的目的,是为防止热量散失。
1.反应CO(g)+H2O(g) CO2(g)+H2(g),达到平衡后,再向反应容器中充入含18O的一氧化碳,经过一段时间后,18O存在于A.CO 、CO D.CO、H2O、CO2
解析 含18O的一氧化碳和H2O正向反应生成含18O的二氧化碳,同时含18O的二氧化碳和H2又逆向反应生成了一氧化碳和水,故最终CO、H2O和CO2中都含有了18O。
(1)混合气体的颜色不再改变
(2)混合气体的平均相对分子质量不变
(3)混合气体的密度不变 ( )
(4)混合气体的压强不变 ( )
(5)单位时间内消耗2n mlNO2的同时生成2n mlO2 ( )
(6) O2气体的物质的量浓度不变
2. 在固定体积的的密闭容器中发生反应: 2NO2 2NO + O2 该反应达到平衡的标志是:
2020-2021学年第二节 氮及其化合物教学ppt课件: 这是一份2020-2021学年第二节 氮及其化合物教学ppt课件,文件包含522氨与铵盐讲好课-2020-2021学年高一化学新教材新理念新设计同步课堂人教2019必修第二册pptx、化学天地夺命氨气mp4等2份课件配套教学资源,其中PPT共18页, 欢迎下载使用。
高中化学人教版 (2019)必修 第二册第七章 有机化合物第三节 乙醇与乙酸教学ppt课件: 这是一份高中化学人教版 (2019)必修 第二册第七章 有机化合物第三节 乙醇与乙酸教学ppt课件,文件包含731乙醇讲好课-2020-2021学年高一化学新教材新理念新设计同步课堂人教2019必修第二册pptx、教学实验乙醇与钠反应mp4、教学实验乙醇的催化氧化mp4、乙醇的催化氧化反应swf、乙醇的结构swf等5份课件配套教学资源,其中PPT共0页, 欢迎下载使用。
高中化学人教版 (2019)必修 第二册第一节 硫及其化合物教学ppt课件: 这是一份高中化学人教版 (2019)必修 第二册第一节 硫及其化合物教学ppt课件,文件包含512硫酸讲好课-2020-2021学年高一化学新教材新理念新设计同步课堂人教2019必修第二册pptx、教学实验浓硫酸与蔗糖反应mp4、教学实验浓硫酸与铜反应mp4、什么是酸雨及其危害---平安中国防灾宣导系列公益活动--_标清avi等4份课件配套教学资源,其中PPT共0页, 欢迎下载使用。













