




高中化学人教版 (新课标)选修4 化学反应原理第二节 水的电离和溶液的酸碱性备课课件ppt
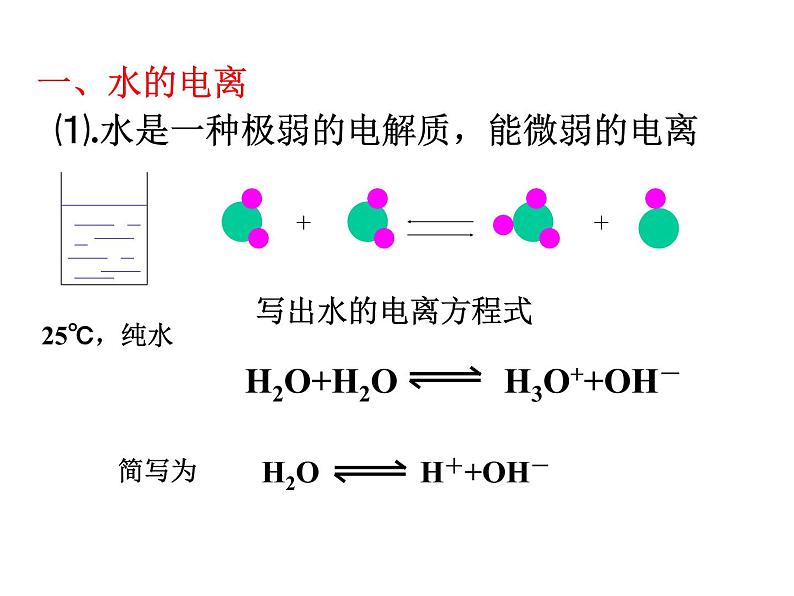
展开⑴.水是一种极弱的电解质,能微弱的电离
定量讨论: 纯水中c(H+)与c(OH-)大小有何关系?25℃时,水电离出来的c(H+)=c(OH—)=10—7ml/L ,说明水的电离程度如何? 水是一种极弱的电解质(通常的电流表无法检验其中离子)
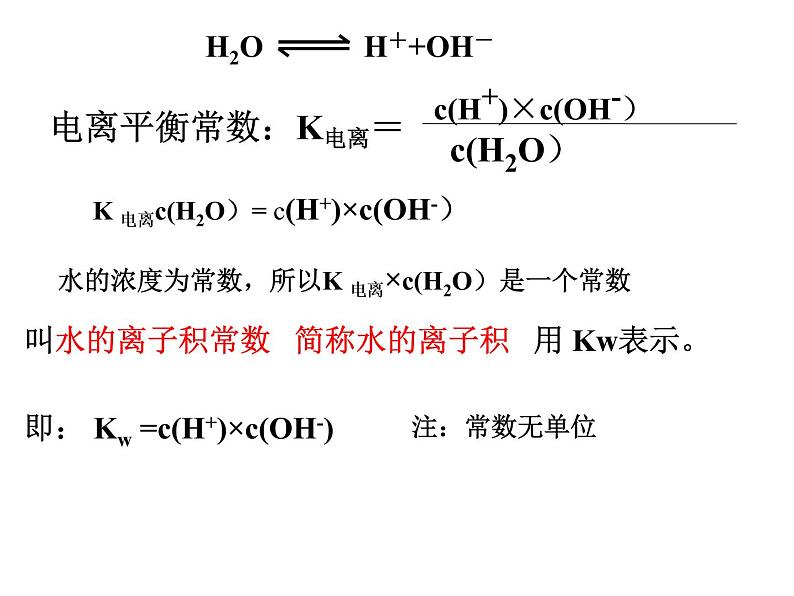
K 电离c(H2O)= c(H+)×c(OH-)
即: Kw =c(H+)×c(OH-)
叫水的离子积常数 简称水的离子积 用 Kw表示。
水的浓度为常数,所以K 电离×c(H2O)是一个常数
2、水的离子积常数(离子积)
①KW只是温度的函数(与浓度无关)温度升高, KW值增大
①在任何水溶液中,均存在水的电离平衡,即任何水溶液中都是H+、OH-共存。 一定温度下c(H+)和c(OH-)乘积是个定值。 ②Kw =c(H+)· c(OH-)不仅适于纯水,也适于酸碱盐溶液。含有H+的溶液一定是酸,含OH-的溶液一定是碱吗?
讨论升高温度,Kw增大。已知KW(100℃)=10-12,则在100 ℃时纯水中的c(H+)等于多少? c(H+) = 10-62. 温度不变,加入溶质对水的电离平衡及KW的影响。加入酸(如:HCl)或碱(如:NaOH)对水的电离有什么影响?(促进还是抑制?)Kw呢?
条件改变对水的电离平衡及Kw的影响
② 加酸碱能抑制水的电离,但Kw 不变③加Na, 促进水电离,但Kw 不变
1、判断正误:任何水溶液中都存在水的电离平衡。 25℃任何水溶液中(不论酸、碱或中性) ,都存在Kw=10-14 。 某温度下,某液体c(H+)= 10-7ml/L,则该溶液一定是纯水。
3、0.01ml/L盐酸溶液中。 c(H+) 、 c(OH-)分别为多少? 0.01ml/L NaOH溶液中。 c(H+) 、 c(OH-)分别为多少?
利用Kw的定量计算——求溶液中的[H+]或[OH-]
C(H+) = 10-2ml/L、 c(OH-) = 10-12 ml/L
C(H+) = 10-12ml/L 、 c(OH-) = 10-2ml/L
由水电离出的c(H+)H2O、c(OH-)H2O分别是多少?均是 c(H+)H2O= 10-12 ml/L 、c(OH-)H2O = 10-12 ml/L 任何水溶液中由水电离出来的c(H+) H2O与c(OH-) H2O相等
4、25℃,某溶液中由水电离产生的c(H+)H2O= 10-11 ml/L ,则该溶液呈酸性还是碱性?并求算该溶液中c (H+)的可能值 ?可能为酸性,也可能为碱性!酸性时:c(H+) = 10-3 ml/L 、 c(OH-)= 10-11 ml/L碱性时: c(H+)= 10-11 ml/L 、 c(OH-)= 10-3 ml/L
利用Kw的定量计算——求c(H+)H2O或c(OH-) H2O
5、 25℃、浓度均为0.1ml/L的下列溶液中c(H+)由大到小的排列顺序:①氨水 ②NaOH ③盐酸 ④醋酸
③>④ > ① > ②
不能用 c(H+) 等于多少来判断溶液酸、碱性,只 能c(H+) 、c(OH-)通过两者相对大小比较
讨论:KW100℃=10-12在100 ℃ 时,纯水中c(H+) 为多少?c(H+) =10-6ml/L 100℃ 时,c(H+) = 1×10—7ml/L溶液呈酸性还是碱性?碱性! c(H+) = 1×10—7ml/L、 c(OH-) = 1×10—5ml/L, c(OH-) > c(H+)
c(H+) = c(OH-)
c(H+)>c(OH-)
c(H+)<c(OH-)
c(H+) = 1×10—7ml/L c(OH-) = 1×10—7ml/L
c(H+) >1×10—7ml/Lc(OH-) <1×10—7ml/L
c(H+) <1×10—7ml/Lc(OH-) >1×10—7ml/L
2、溶液的酸碱性与pH
①定义: pH是c(H+)的负对数,即pH=-lg c(H+)。如:c(H+) = 1×10—7ml/L, pH=-lg10—7 =7.0②注意:当溶液中c(H+)或c(OH-)大于1ml时,不用pH表示溶液的酸碱性。适用于稀溶液c≤1ml/L。pH与溶液的酸碱性(25℃时)
用pH试纸测定某无色溶液的pH时,规范的操作是 A. 将pH试纸放入溶液中观察其颜色变化,跟标准比色卡比较 B. 将溶液倒在pH试纸上,跟标准比色卡比较 C. 用干燥的洁净玻璃棒蘸取溶液,滴在pH试纸上,跟标准比色卡比较 D. 在试管内放入少量溶液,煮沸,把pH试纸放在管口,观察颜色,跟标准比色卡比较
酸碱指示剂:判断溶液的酸碱性
(1) pH试纸:测定溶液的pH
(2) pH计:精确测定溶液的pH
2020-2021学年第三章 水溶液中的离子平衡第二节 水的电离和溶液的酸碱性课文配套ppt课件: 这是一份2020-2021学年第三章 水溶液中的离子平衡第二节 水的电离和溶液的酸碱性课文配套ppt课件,共14页。PPT课件主要包含了复习检测,单一溶液的计算,有关溶液pH的计算,-lg101等内容,欢迎下载使用。
高中化学人教版 (新课标)选修4 化学反应原理第二节 水的电离和溶液的酸碱性备课ppt课件: 这是一份高中化学人教版 (新课标)选修4 化学反应原理第二节 水的电离和溶液的酸碱性备课ppt课件,共29页。PPT课件主要包含了常温下,cH+,cOH-减小,cOH-增大,判断正误,pH的测定,pH计酸度计,精确测定,粗略测定,广泛pH试纸等内容,欢迎下载使用。
高中化学人教版 (新课标)选修4 化学反应原理第二节 水的电离和溶液的酸碱性课文配套课件ppt: 这是一份高中化学人教版 (新课标)选修4 化学反应原理第二节 水的电离和溶液的酸碱性课文配套课件ppt,共23页。PPT课件主要包含了酸碱中和滴定,H++OH-H2O,进行完全,已知浓度的溶液,未知浓度的溶液,⑶指示剂,指示剂的变色,用于配制标准液,放置滴定管,酸式滴定管等内容,欢迎下载使用。













