




高中化学第二章 化学反应速率和化学平衡第三节 化学平衡课文内容课件ppt
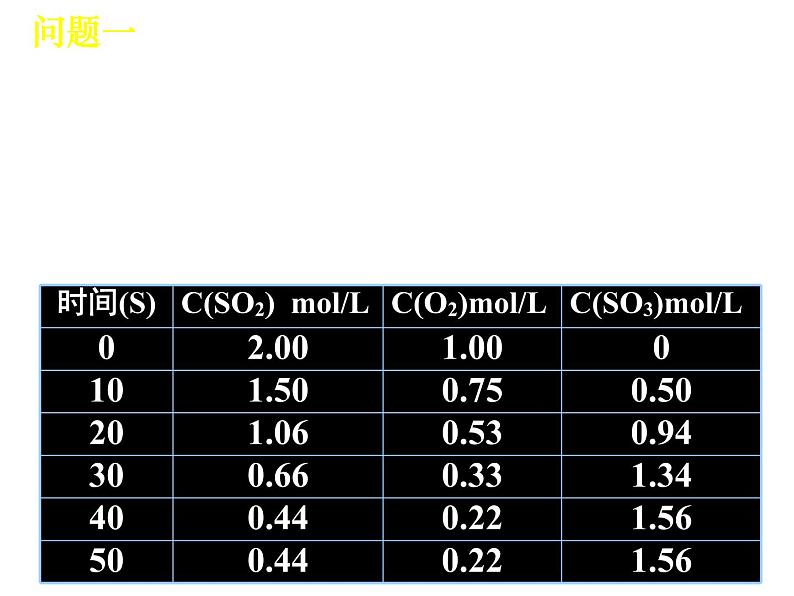
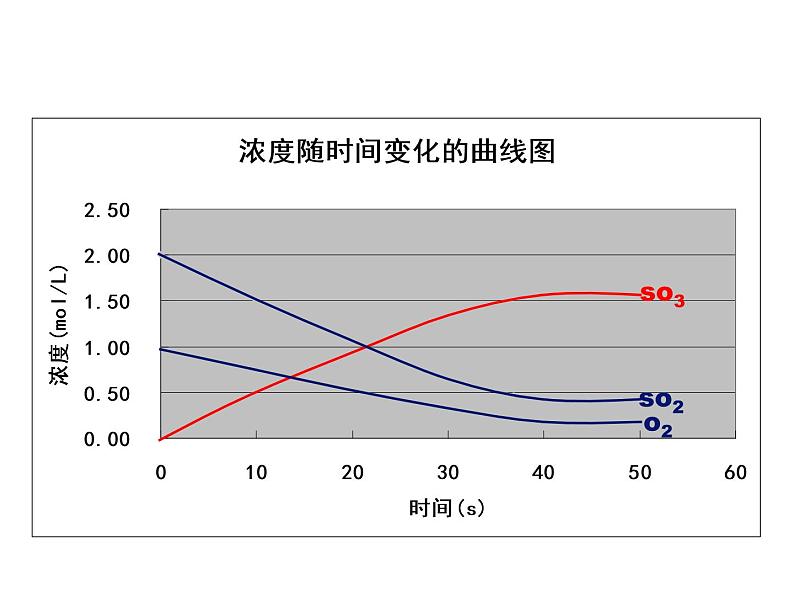
展开在500℃和V2O5的催化条件下, 往1L的密闭容器中充入2mlSO2和1mlO2, 进行可逆反应2SO2+O2 2SO3。为了更好研究可逆反应完成后各物质的状态, 每隔一定时间, 测出反应体系中各物质的浓度, 数据如下:
(3)一定时间后, 必然出现____________。此时, 反应物和生成物的___________ 不再变化, 该可逆反应达到_________________状态。
(2)反应过程中:反应物浓度______, 正反应速率_____, 生成物浓度_____, 逆反应速率______。
(1)反应刚开始时:反应物浓度________, 正反应速率_____, 生成物浓度为___, 逆反应速率为____。
在一定条件下的可逆反应里, 当正反应速率和逆反应速率相等时, 反应体系中所有参加反应的物质的质量或浓度可以保持恒定。这时的状态也就是在给定条件下, 反应达到了“限度”。
500℃和V2O5的催化条件下, 在10L密闭容器中加入4mlSO2和2ml O2, 经1h充分反应后可逆反应2SO2+O2 2SO3 达到平衡。你能判断此反应已处于平衡状态吗?
判断一:消耗2mlSO2的同时有2ml SO2生成了
判断二:消耗2mlSO2的同时消耗1ml O2
判断三:生成2mlSO2的同时消耗2ml O2
判断四:生成1mlO2的同时有1mlSO3分解了
500℃和V2O5的催化条件下, 在10L密闭容器中加入4mlSO2和2mlO2, 经1h充分反应后可逆反应2SO2(g)+O2(g) 2SO3(g)达到平衡。还有哪些标志可以帮助我们判断化学平衡状态?
标志1:O2的浓度不随时间变化而变化
标志2:容器内的气体压强保持不变
化学反应的可逆性非常普遍。当你学会从过程的可逆性和化学平衡的角度来观察和分析客观事物时, 你对自然的、乃至社会的现象将会更加深入、更加全面。 从上述意义上出发, 请你例举发生在你身边的有关平衡现象, 好吗?
如何打破原有平衡, 达到新的化学平衡状态 ?
在固定体积的的密闭容器中发生反应: 2NO2 2NO + O2该反应达到平衡的标志是:
(1)混合气体的颜色不再改变( )
(2)混合气体的平均相对分子质量不变( )
(3)混合气体的密度不变( )
(4)混合气体的压强不变( )
(5)单位时间内消耗2nmlNO2的同时生成 2nmlO2 ( )
(6)O2气体的物质的量浓度不变( )
高中化学人教版 (新课标)选修4 化学反应原理第三节 化学平衡评课课件ppt: 这是一份高中化学人教版 (新课标)选修4 化学反应原理第三节 化学平衡评课课件ppt,共11页。PPT课件主要包含了决定于生成物浓度,决定于反应物浓度,可逆反应的特点,过程分析,逐渐减小,逐渐增大,化学平衡状态,可逆反应,前提条件,v正=v逆等内容,欢迎下载使用。
2020-2021学年第二章 化学反应速率和化学平衡第三节 化学平衡教学ppt课件: 这是一份2020-2021学年第二章 化学反应速率和化学平衡第三节 化学平衡教学ppt课件,共19页。PPT课件主要包含了化学平衡的特征,逆等动定变,化学反应速率,催化剂,催化剂的影响等内容,欢迎下载使用。
高中化学人教版 (新课标)选修4 化学反应原理第三节 化学平衡集体备课ppt课件: 这是一份高中化学人教版 (新课标)选修4 化学反应原理第三节 化学平衡集体备课ppt课件,共32页。PPT课件主要包含了探究汇报,红色变深,红色变浅,橙色变深,黄色变深,化学平衡的移动,条件改变,一定时间后等内容,欢迎下载使用。













